تحلل الجلوتامين - ويكيبيديا
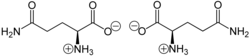
تحلل الجلوتامين (بالإنجليزية: Glutaminolysis) هو سلسلة من التفاعلات البيوكيميائية التي يُحلّل فيها الحمض الأمين الجلوتامين إلى حمض الجلوتاميك، وحمض الأسبارتيك، وثاني أكسيد الكربون، وحمض البيروفيك ، وحمض اللبنيك، والألانين، وحمض الليمون.[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20][21]
مسار الجلوتامين
[عدل]
يستخدم التحلل الجلوتاميني بشكل جزئي خطوات تفاعلية من دورة حمض الستريك ومكمل مالات-أسبارتات.
خطوات التفاعل من الجلوتامين إلى ألفا-كيتوجلوتارات
[عدل]يُحوّل الحمض الأميني الجلوتامين إلى ألفا-كيتوجلوتارات من خلال الخطوتين:
- التحلل المائي للمجموعة الأمينية من الجلوتامين مكونة الغلوتامات والأمونيوم.
الإنزيم المحفز: الجلوتاميناز (EC 3.5.1.2)
- يمكن أن تُفرز الجلوتامات أو أن تُستقلب بصورة أكثر إلى ألفا-كيتوجلوتارات. وذلك من خلال ثلاثة تفاعلات مختلفة ممكنة لتحويل حمض الجلوتاميك إلى ألفا-كيتوجلوتارات:
الإنزيمات المحفزة:
- إنزيم إزالة الهيدروجين من الجلوتامات ، EC 1.4.1.2
- إنزيم نقل الجلوتامات إلى البيروفيت، المعروف أيضًا باسم إنزيم نقل الألانين، EC 2.6.1.2
- إنزيم نقل الجلوتامات إلى الأوكسالوأسيتات، والمعروف أيضًا باسم إنزيم نقل الأسبارتيت، EC 2.6.1.1 (عنصر في دورة مالات الأسبارتات)

خطوات التفاعل لدورة حمض الستريك ودورة مالات الأسبارتات (مسار الأسبارتات مالات):
[عدل]- ألفا-كيتوجلوتارات + نيكوتيناميد الأدينين ثنائي النوكليوتيد (+NAD) + الإنزيم الكاشف الإنزيم أ ← إنزيم السكسينيل أ+ نيكوتيناميد الأدينين ثنائي النوكليوتيد + هيدروجين + ثنائي أكسيد الكربون
الإنزيم المحفز: مركب نازعة الهيدروجين ألفا كيتوجلوتارات.
- إنزيم السكسينيل + ثنائي فوسفات الغوانوزين + الفوسفات غير العضوي ← سكسينات + ثلاثي فوسفات الغوانوزين
الإنزيم المحفز: إنزيم السكسينيل أ المركب, EC 6.2.1.4.
- سكسينات + ثنائي نيوكليوتيد الفلافين والأدينين ← حمض الفوماريك + ثنائي النوكليوتيد ثنائي هيدروفلافين - أدنينا
لإنزيم المحفز: نازعة هيدروجين السكسينات, EC 1.3.5.1
- حمض الفوماريك + ماء ← حمض التفاح
الإنزيم المحفز: فومارات هيدراتاز، EC 4.2.1.2
- حمض التفاح + نيكوتيناميد الأدينين ثنائي النوكليوتيد (+NAD) ← أوكسالوأسيتات + نيكوتيناميد الأدينين ثنائي النوكليوتيد + الهيدروجين
الإنزيم المحفز: مالات ديهيدروجيناز، (مكون من مكوك أسبارتاتي مالات)EC 1.1.1.37
- أوكسالوأسيتات + مرافق إنزيم أ + ماء ← حمض الستريك + الإنزيم الكاشف الإنزيم أ
الإنزيم المحفز: سينسيز السيترات، EC 2.3.3.1
خطوات التفاعل من مالات إلى حمض البيروفيك وحمض اللاكتيك
[عدل]يُحفَّز تحويل مالات إلى حمض البيروفيك وحمض اللاكتيك بواسطة:
- إنزيم التحلل الكربوكسيلي للمالات (إنزيم الماليك; EC 1.1.1.39 و 1.1.1.40) المعتمد على اقتصاد النيكوتين أدينين ثنائي النيكلوتيد NAD(P) و
- إنزيم ديهايدروجيناز حمض اللاكتيك (إنزيم حمض اللاكتيك; EC 1.1.1.27)
ويكون ذلك وفق المعادلات التالية:
- حمض التفاح ++NAD(P) ← حمض البيروفيك + NAD(P)H + هيدروجين + ثاني أكسيد الكربون
- حمض البيروفيك + NADH + هيدروجين ← حمض اللاكتيك + نيكوتيناميد الأدينين ثنائي النوكليوتيد
التجزئة الخلوية لمسار استقلاب الجلوتامين
[عدل]جزء من تفاعلات مسار استقلاب الجلوتامين تحدث داخل الميتوكوندريا وإلى حد ما في السيتوبلازم (قارن الخطة الاستقلابية لمسار استقلاب الجلوتامين).
تحلل الجلوتامين: مصدر طاقة مهم في الخلايا السرطانية
[عدل]مسار استقلاب الجلوتامين يحدث في جميع الخلايا المتكاثرة، مثل الخلايا الليمفاوية، الخلايا التيموسية، الخلايا المبطنة للقولون، الخلايا الدهنية وخاصة في الخلايا الورمية.[1][2][3][4][5][6][7][8][10][11][12][13][14][16][18][19][22] استُهدف مسار استقلاب الجلوتامين لأغراض علاجية.[21] في خلايا الأورام، قُصَّت الدورة الحمضية لحمض الستريك بسبب تثبيط إنزيم أكونيتاز (EC 4.2.1.3) بواسطة تركيزات عالية من الجزيئات النشطة الأكسجينية المتفاعلة (ROS)[23][24] يحفز الأكونيتيز تحويل السيترات إلى إيزوسيترات. ومن جهة أخرى، تُعبِّر خلايا الأورام عن إنزيم غلوتاميناز الذي يعتمد على الفوسفات وإنزيم مالات ديكاربوكسيليز المعتمد على نيكوتيناميد الأدينين ثنائي النوكليوتيد (في أحماض النيكوتيناميد والأدينين) بشكل زائد،[9][25][26][27][28] والذين بالتأثير مع الخطوات المتبقية في دورة حمض الستريك من ألفا-كيتوغلوتارات إلى سترات يضفي إمكانية وجود مسار جديد لإنتاج الطاقة، تحلل حمض الأمين الغلوتاميني إلى حمض الغلوتاميك، وحمض الأسبارتيك، وحمض البيروفيك، وثاني أكسيد الكربون، وحمض اللاكتيك، وحمض الستريت.
بالإضافة إلى عملية التحلل السكري (الجلايكوليز)، تُعد تحلل الجلوتامين (الجلوتامينوليز) أحد الأعمدة الرئيسية الأخرى لإنتاج الطاقة في خلايا الأورام. تُحفِّز تركيزات الجلوتامين الخارجية العالية نمو الأورام وتعتبر أساسية لتحوُّل الخلايا.[27][29] ومن ناحية أخرى، فإن انخفاض تركيز الجلوتامين يترافق مع التمايز الظاهري والوظيفي للخلايا.[30]
فعالية الطاقة لانحلال الجلوتامين في الخلايا السرطانية
[عدل]- جزيء أدينوسين ثلاثي الفوسفات واحد عن طريق الفسفرة المباشرة للناتج الإجمالي.
- جزيئين من أدينوسين ثلاثي الفوسفات من أكسدة فلافين أدينين ثنائي النوكليوتيد FADH2.
- ثلاثة جزيئات من أدينوسين ثلاثي الفوسفات في وقت واحد لهيدروجين+ نيكوتيناميد الأدينين ثنائي النوكليوتيد NADH + المنتجة في تفاعل نازعة هيدروجين ألفا-كيتوجلوتارات، وتفاعل نازعة هيدروجين مالات وتفاعل مالات ديكاربوكسيلاز.
نظرًا لانخفاض نشاط إنزيم نازعة هيدروجين الغلوتامات والجلوتامات بيروفات ، في الخلايا السرطانية ، تُحوَّل الجلوتامات إلى ألفا كيتوجلوتارات بشكل أساسي عن طريق إنزيم غلوتامات أوكسالأسيتات ترانساميناز.[5][31]
مزايا انحلال الجلوتامين في الخلايا السرطانية
[عدل]- الجلوتامين هو أكثر الأحماض الأمينية وفرة في البلازما ومصدرًا إضافيًا للطاقة في الخلايا السرطانية خاصةً عندما يكون إنتاج الطاقة المحللة للجليك منخفضًا بسبب الكمية العالية من ورم M2-PK.
- الجلوتامين ومنتجات تحلله الجلوتامات والأسبارتات هي سباقات لتوليف الحمض النووي والسيرين.
- يعتبر تحلل الجلوتامين غير حساس للتركيزات العالية لأنواع الأكسجين التفاعلية (ROS).[32]
- بسبب اقتطاع دورة حامض الستريك، فإن كمية مرافق الإنزيم أ المتسللة في دورة حامض الستريك منخفضة ويتوفر مرافق الإنزيم أ لتخليق دي نوفو للأحماض الدهنية والكوليسترول. يمكن استخدام الأحماض الدهنية لتخليق الفوسفوليبيد أو يمكن إطلاقها.[33]
- تمثل الأحماض الدهنية وسيلة تخزين فعالة للهيدروجين. لذلك، فإن إطلاق الأحماض الدهنية هو وسيلة فعالة للتخلص من الهيدروجين الخلوي المنتج داخل نازعة هيدروجين الجليسرالدهيد 3-فوسفات المحللة للسكر (GAPDH; EC 1.2.1.9).[34]
- حمض الغلوتاميك والأحماض الدهنية كابت للمناعة. قد يؤدي إطلاق كلا المستقلبين إلى حماية الخلايا السرطانية من الهجمات المناعية.[35][36][37]
- تجمع حمض الغلوتاميك قد يدفع الامتصاص المرن للأحماض الأمينية الأخرى بواسطة نظام ASC.[17]
- يمكن تحويل الجلوتامين إلى سترات بدون إنتاج نيكوتيناميد الأدينين ثنائي النوكليوتيد، وفصل إنتاج نيكوتيناميد الأدينين ثنائي النوكليوتيد عن التخليق الحيوي.[38]
انظر أيضًا
[عدل]مصادر
[عدل]- ^ ا ب Krebs، HA؛ Bellamy D (1960). "The interconversion of glutamic acid and aspartic acid in respiring tissues". The Biochemical Journal. ج. 75 ع. 3: 523–529. DOI:10.1042/bj0750523. PMC:1204504. PMID:14411856.
- ^ ا ب Reitzer، LJ؛ Wice BM؛ Kennell D (1979). "Evidence that glutamine, not sugar, is the major energy source for cultured HeLa-cells". The Journal of Biological Chemistry. ج. 254 ع. 8: 2669–2676. DOI:10.1016/S0021-9258(17)30124-2. PMID:429309.
- ^ ا ب Zielke، HR؛ Sumbilla CM؛ Sevdalian DA؛ Hawkins RL؛ Ozand PT (1980). "Lactate: a major product of glutamine metabolism by human diploid fibroblasts". Journal of Cellular Physiology. ج. 104 ع. 3: 433–441. DOI:10.1002/jcp.1041040316. PMID:7419614. S2CID:39874039.
- ^ ا ب Mc Keehan، WL (1982). "Glycolysis, glutaminolysis and cell proliferation". Cell Biology International Reports. ج. 6 ع. 7: 635–650. DOI:10.1016/0309-1651(82)90125-4. PMID:6751566.
- ^ ا ب ج Moreadith RW، RW؛ Lehninger AL (1984). "The pathways of glutamate and glutamine oxidation by tumor cell mitochondria". The Journal of Biological Chemistry. ج. 259 ع. 10: 6215–6221. DOI:10.1016/S0021-9258(20)82128-0. PMID:6144677.
- ^ ا ب Zielke، HR؛ Zielke CL؛ Ozand PT (1984). "Glutamine: a major energy source for cultured mammalian cells". Federation Proceedings. ج. 43 ع. 1: 121–125. PMID:6690331.
- ^ ا ب Eigenbrodt، E؛ Fister P؛ Reinacher M (1985). "New perspectives on carbohydrate metabolism in tumor cells". Regulation of Carbohydrate Metabolism. ج. 2. ص. 141–179. ISBN:978-0-8493-5263-8.
- ^ ا ب Lanks، KW (1987). "End products of glucose and glutamine metabolism by L929 cells". The Journal of Biological Chemistry. ج. 262 ع. 21: 10093–10097. DOI:10.1016/S0021-9258(18)61081-6. PMID:3611053.
- ^ ا ب Board، M؛ Humm S؛ Newsholme EA (1990). "Maximum activities of key enzymes of glycolysis, glutaminolysis, pentose phosphate pathway and tricarboxylic acid cycle in normal, neoplastic and suppressed cells". The Biochemical Journal. ج. 265 ع. 2: 503–509. DOI:10.1042/bj2650503. PMC:1136912. PMID:2302181.
- ^ ا ب Medina، MA؛ Nunez de Castro I (1990). "Glutaminolysis and glycolysis interactions in proliferant cells". International Journal of Biochemistry. ج. 22 ع. 7: 681–683. DOI:10.1016/0020-711X(90)90001-J. PMID:2205518.
- ^ ا ب Goossens، V؛ Grooten J؛ Fiers W (1996). "The oxidative metabolism of glutamine. A modulator of reactive oxygen intermediate-mediated cytotoxicity of tumor necrosis factor in L929 fibrosarcoma cells". The Journal of Biological Chemistry. ج. 271 ع. 1: 192–196. DOI:10.1074/jbc.271.1.192. PMID:8550558.
- ^ ا ب Mazurek، S؛ Michel A؛ Eigenbrodt E (1997). "Effect of extracellular AMP on cell proliferation and metabolism of breast cancer cell lines with high and low glycolytic rates". Journal of Biological Chemistry. ج. 272 ع. 8: 4941–4952. DOI:10.1074/jbc.272.8.4941. PMID:9030554.
- ^ ا ب Eigenbrodt، E؛ Kallinowski F؛ Ott M؛ Mazurek S؛ Vaupel P (1998). "Pyruvate kinase and the interaction of amino acid and carbohydrate metabolism in solid tumors". Anticancer Research. ج. 18 ع. 5A: 3267–3274. PMID:9858894.
- ^ ا ب Piva، TJ؛ McEvoy-Bowe E (1998). "Oxidation of glutamine in HeLa cells: role and control of truncated TCA cycles in tumour mitochondria". Journal of Cellular Biochemistry. ج. 68 ع. 2: 213–225. DOI:10.1002/(SICI)1097-4644(19980201)68:2<213::AID-JCB8>3.0.CO;2-Y. PMID:9443077. S2CID:46111962.
- ^ Mazurek، S؛ Eigenbrodt E؛ Failing K؛ Steinberg P (1999). "Alterations in the glycolytic and glutaminolytic pathways after malignant transformation of rat liver oval cells". Journal of Cellular Physiology. ج. 181 ع. 1: 136–146. DOI:10.1002/(SICI)1097-4652(199910)181:1<136::AID-JCP14>3.0.CO;2-T. PMID:10457361. S2CID:24441099.
- ^ ا ب Mazurek، S؛ Zwerschke W؛ Jansen-Dürr P؛ Eigenbrodt E (2001). "Effects of the human papilloma virus HPV-16 E7 oncoprotein on glycolysis and glutaminolysis: role of pyruvate kinase type M2 and the glycolytic enzyme complex". Biochemical Journal. ج. 356 ع. Pt 1: 247–256. DOI:10.1042/0264-6021:3560247. PMC:1221834. PMID:11336658.
- ^ ا ب Aledo، JC (2004). "Glutamine breakdown in rapidly dividing cells: waste or investment ?". BioEssays. ج. 26 ع. 7: 778–785. DOI:10.1002/bies.20063. PMID:15221859.
- ^ ا ب Rossignol، R؛ Gilkerson R؛ Aggeler R؛ Yamagata K؛ Remington SJ؛ Capaldi RA (2004). "Energy substrate modulates mitochondrial structure and oxidative capacity in cancer cells". Cancer Research. ج. 64 ع. 3: 985–993. DOI:10.1158/0008-5472.CAN-03-1101. PMID:14871829.
- ^ ا ب Mazurek، S (2007). "Tumor cell energetic metabolome". Molecular System Bioenergetics. ص. 521–540. ISBN:978-3-527-31787-5.
- ^ DeBerardinis، RJ؛ Sayed N؛ Ditsworth D؛ Thompson CB (2008). "Brick by brick: metabolism and tumor growth". Current Opinion in Genetics & Development. ج. 18 ع. 1: 54–61. DOI:10.1016/j.gde.2008.02.003. PMC:2476215. PMID:18387799.
- ^ ا ب "Enhancing the efficacy of glutamine metabolism inhibitors in cancer therapy". Trends in Cancer. مؤرشف من الأصل في 2021-05-25.
- ^ Wolfrom، C؛ Kadhom N؛ Polini G؛ Poggi J؛ Moatti N؛ Gautier M (1989). "Glutamine dependency of human skin fibroblasts: modulation of hexoses". Experimental Cell Research. ج. 183 ع. 2: 303–318. DOI:10.1016/0014-4827(89)90391-1. PMID:2767153.
- ^ Gardner، PR؛ Raineri I؛ Epstein LB؛ White CW (1995). "Superoxide radical and iron modulate aconitase activity in mammalian cells". Journal of Biological Chemistry. ج. 270 ع. 22: 13399–13405. DOI:10.1074/jbc.270.22.13399. PMID:7768942.
- ^ Kim، KH؛ Rodriguez AM؛ Carrico PM؛ Melendez JA (2001). "Potential mechanisms for the inhibition of tumor cell growth by manganese superoxide dismutase". Antioxidants & Redox Signaling. ج. 3 ع. 3: 361–373. DOI:10.1089/15230860152409013. PMID:11491650.
- ^ Matsuno، T؛ Goto I (1992). "Glutaminase and glutamine synthetase activities in human cirrhotic liver and hepatocellular carcinoma". Cancer Research. ج. 52 ع. 5: 1192–1194. PMID:1346587.
- ^ Aledo JC، Segura JA، Medina MA، Alonso FJ، Núñez de Castro I، Márquez J (1994). "Phosphate-activated glutaminase expression during tumor development". FEBS Letters. ج. 341 ع. 1: 39–42. DOI:10.1016/0014-5793(94)80236-X. PMID:8137919. S2CID:12702894.
- ^ ا ب Lobo C، Ruiz-Bellido MA، Aledo JC، Márquez J، Núñez De Castro I، Alonso FJ (2000). "Inhibition of glutaminase expression by antisense mRNA decreases growth and tumourigenicity of tumour cells". Biochemical Journal. ج. 348 ع. 2: 257–261. DOI:10.1042/0264-6021:3480257. PMC:1221061. PMID:10816417.
- ^ Mazurek، S؛ Grimm H؛ Oehmke M؛ Weisse G؛ Teigelkamp S؛ Eigenbrodt E (2000). "Tumor M2-PK and glutaminolytic enzymes in the metabolic shift of tumor cells". Anticancer Research. ج. 20 ع. 6D: 5151–5154. PMID:11326687.
- ^ Turowski، GA؛ Rashid Z؛ Hong F؛ Madri JA؛ Basson MD (1994). "Glutamine modulates phenotype and stimulates proliferation in human colon cancer cell lines". Cancer Research. ج. 54 ع. 22: 5974–5980. PMID:7954430.
- ^ Spittler، A؛ Oehler R؛ Goetzinger P؛ Holzer S؛ Reissner CM؛ Leutmezer J؛ Rath V؛ Wrba F؛ Fuegger R؛ Boltz-Nitulescu G؛ Roth E (1997). "Low glutamine concentrations induce phenotypical and functional differentiation of U937 myelomonocytic cells". The Journal of Nutrition. ج. 127 ع. 11: 2151–2157. DOI:10.1093/jn/127.11.2151. PMID:9349841.
- ^ Matsuno، T (1991). "Pathway of glutamate oxidation and its regulation in HuH13 line of human hepatoma cells". Journal of Cellular Physiology. ج. 148 ع. 2: 290–294. DOI:10.1002/jcp.1041480215. PMID:1679060. S2CID:30893440.
- ^ Stephen J. Ralph؛ Rafael Moreno-Sánchez؛ Jiri Neuzil؛ Sara Rodríguez-Enríquez (24 أغسطس 2011). "Inhibitors of Succinate: Quinone Reductase/Complex II Regulate Production of Mitochondrial Reactive Oxygen Species and Protect Normal Cells from Ischemic Damage but Induce Specific Cancer Cell Death". Pharmaceutical Research . ج. 28 ع. 2695: 2695–2730. DOI:10.1007/s11095-011-0566-7. PMID:21863476. S2CID:21836546. مؤرشف من الأصل في 2022-03-08. اطلع عليه بتاريخ 2021-11-01.
Unlike aconitase, glutaminolysis is relatively insensitive to ROS levels.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Parlo، RA؛ Coleman PS (1984). "Enhanced rate of citrate export from cholesterol-rich hepatoma mitochondria. The truncated Krebs cycle and other metabolic ramifications of mitochondrial membrane cholesterol". The Journal of Biological Chemistry. ج. 259 ع. 16: 9997–10003. DOI:10.1016/S0021-9258(18)90917-8. PMID:6469976.
- ^ Mazurek، S؛ Grimm H؛ Boschek CB؛ Vaupel P؛ Eigenbrodt E (2002). "Pyruvate kinase type M2: a crossroad in the tumor metabolome". The British Journal of Nutrition. ج. 87: S23–S29. DOI:10.1079/BJN2001455. PMID:11895152.
- ^ Eck، HP؛ Drings P؛ Dröge W (1989). "Plasma glutamate levels, lymphocyte reactivity and death in patients with bronchial carcinoma". Journal of Cancer Research and Clinical Oncology. ج. 115 ع. 6: 571–574. DOI:10.1007/BF00391360. PMID:2558118. S2CID:23057794.
- ^ Grimm، H؛ Tibell A؛ Norrlind B؛ Blecher C؛ Wilker S؛ Schwemmle K (1994). "Immunoregulation by parental lipids: impact of the n-3 to n-6 fatty acid ratio". Journal of Parenteral and Enteral Nutrition. ج. 18 ع. 5: 417–421. DOI:10.1177/0148607194018005417. PMID:7815672.
- ^ Jiang، WG؛ Bryce RP؛ Hoorobin DF (1998). "Essential fatty acids: molecular and cellular basis of their anti-cancer action and clinical implications". Critical Reviews in Oncology/Hematology. ج. 27 ع. 3: 179–209. DOI:10.1016/S1040-8428(98)00003-1. PMID:9649932.
- ^ Fernandez-de-Cossio-Diaz, Jorge; Vazquez, Alexei (18 Oct 2017). "Limits of aerobic metabolism in cancer cells". Scientific Reports (بالإنجليزية). 7 (1): 13488. Bibcode:2017NatSR...713488F. DOI:10.1038/s41598-017-14071-y. ISSN:2045-2322. PMC:5647437. PMID:29044214.


 French
French Deutsch
Deutsch