رادون - ويكيبيديا
| ||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| غاز عديم اللون الطيف الخطي للرادون | ||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | رادون، 86، Rn | |||||||||||||||||||||||||||||||||
| تصنيف العنصر | غاز نبيل | |||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 18، 6، p | |||||||||||||||||||||||||||||||||
| الكتلة الذرية | (222) غ·مول−1 | |||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Xe]; 4f14 5d10 6s2 6p6] | |||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 32, 18, 8 (صورة) | |||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||
| الطور | غاز | |||||||||||||||||||||||||||||||||
| الكثافة | (0 °س، 101.325 كيلوباسكال) 9.73 غ/ل | |||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الغليان | 4.4 غ·سم−3 | |||||||||||||||||||||||||||||||||
| نقطة الانصهار | 202.0 ك، −71.15 °س، −96.07 °ف | |||||||||||||||||||||||||||||||||
| نقطة الغليان | 211.3 ك، −61.85 °س، −79.1 °ف | |||||||||||||||||||||||||||||||||
| النقطة الحرجة | 377 ك، 6.28 ميغاباسكال | |||||||||||||||||||||||||||||||||
| حرارة الانصهار | 3.247 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||
| حرارة التبخر | 18.10 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 20.786 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 2 | |||||||||||||||||||||||||||||||||
| الكهرسلبية | 2.2 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 1037 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 150 بيكومتر | |||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 220 بيكومتر | |||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري مكعب | |||||||||||||||||||||||||||||||||
| المغناطيسية | لا مغناطيسي | |||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 3.61 ميلي واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||
| رقم CAS | 10043-92-2 | |||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الرادون | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
الرادون (بالإنجليزية: Radon)، هو عنصر كيميائي له الرمز Rn والعدد الذري 86 في الجدول الدوري، وهو غاز خامل عديم اللون والطعم والرائحة، كما أنه من العناصر المشعة. الرادون خامل كيميائيا وغير قابل للاشتعال وسام جدا وهو ثاني أكثر أسباب سرطان الرئة[1] بعد التدخين. يتكون الرادون عن طريق تحلل اليورانيوم والثوريوم ولأن هذين العنصرين لهما عمر نصف طويل فإن الرادون سيوجد في المستقبل.
الرادون يحدث بشكل طبيعي بكميات دقيقة كخطوة وسيطة في سلاسل الاضمحلال الإشعاعي العادية التي يتحلل من خلالها الثوريوم واليورانيوم ببطء إلى الرصاص والعديد من العناصر المشعة الأخرى قصيرة العمر. الرادون نفسه هو نتاج الاضمحلال الفوري للراديوم. أكثر نظائره ثباتًا، 222 Rn، له عمر نصف يبلغ 3.8 يومًا فقط، مما يجعله أحد أندر العناصر. نظرًا لأن الثوريوم واليورانيوم هما من أكثر العناصر المشعة شيوعًا على الأرض، في حين أن لهما أيضًا ثلاثة نظائر بنصف عمر يصل إلى عدة مليارات من السنين، فسيظل الرادون موجودًا على الأرض لفترة طويلة في المستقبل على الرغم من قصر عمره النصفي. ينتج عن اضمحلال الرادون العديد من النويدات الأخرى قصيرة العمر، والمعروفة باسم بنات الرادون، والتي تنتهي بنظائر ثابتة من الرصاص.[2]
على عكس جميع العناصر الوسيطة الأخرى في سلاسل الاضمحلال المذكورة أعلاه، يعتبر الرادون، في ظل الظروف القياسية، غازيًا ويمكن استنشاقه بسهولة، وبالتالي يمثل خطرًا على الصحة. غالبًا ما يكون أكبر مساهم منفرد في جرعة الإشعاع الخلفية للفرد، ولكن نظرًا للاختلافات المحلية في الجيولوجيا، [3] يختلف مستوى التعرض لغاز الرادون من مكان إلى آخر. المصدر الشائع هو المعادن المحتوية على اليورانيوم في الأرض، وبالتالي تتراكم في المناطق الجوفية مثل الأقبية. يمكن أن يحدث أيضا الرادون في بعض المياه الجوفية مثل مياه الينابيع والينابيع الساخنة.[4]
أظهرت الدراسات الوبائية وجود صلة واضحة بين استنشاق تركيزات عالية من الرادون والإصابة بسرطان الرئة. الرادون مادة ملوثة تؤثر على جودة الهواء الداخلي في جميع أنحاء العالم. وفقًا لوكالة حماية البيئة الأمريكية (EPA)، يعد الرادون ثاني أكثر أسباب الإصابة بسرطان الرئة شيوعًا، بعد تدخين السجائر، مما يتسبب في وفاة 21000 من سرطان الرئة سنويًا في الولايات المتحدة. تحدث حوالي 2900 حالة وفاة بين الأشخاص الذين لم يدخنوا قط. في حين أن الرادون هو السبب الثاني الأكثر شيوعًا لسرطان الرئة، إلا أنه السبب الأول بين غير المدخنين، وفقًا لتقديرات وكالة حماية البيئة (EPA) الموجهة للسياسة.[5] توجد شكوك كبيرة بشأن الآثار الصحية للتعرض لجرعات منخفضة.[6] على عكس غاز الرادون نفسه، فإن بنات الرادون مواد صلبة وتلتصق بالأسطح، مثل جزيئات الغبار المحمولة في الهواء، والتي يمكن أن تسبب سرطان الرئة إذا تم استنشاقها.[7]
مميزات
[عدل]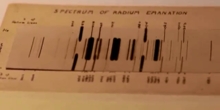
الخصائص الفيزيائية
[عدل]الرادون هو غاز عديم اللون والرائحة والمذاق [8] وبالتالي لا يمكن اكتشافه بواسطة الحواس البشرية وحدها. عند درجة الحرارة والضغط القياسيين، فإنه يشكل غازًا أحادي الذرة بكثافة 9.73 كجم / م 3، حوالي 8 أضعاف كثافة الغلاف الجوي للأرض عند مستوى سطح البحر، 1.217 كجم / م 3.[9] إنه أحد أكثر الغازات كثافة في درجة حرارة الغرفة وهو الأكثر كثافة من بين الغازات النبيلة. على الرغم من عدم وجود لون عند درجة الحرارة والضغط القياسيين، إلا أنه عند تبريده دون درجة التجمد البالغة 202 ك (−71 °م؛ −96 °ف)، ينبعث تألق إشعاعي لامع يتحول من الأصفر إلى الأحمر البرتقالي مع انخفاض درجة الحرارة.[10] عند التكثف، يتوهج بسبب الإشعاع الشديد الذي ينتج عنه.[11] إنه قابل للذوبان في الماء بشكل ضئيل، ولكنه أكثر قابلية للذوبان من الغازات النبيلة الأخف. إنه أكثر قابلية للذوبان في السوائل العضوية منه في الماء. معادلة الذوبان الخاصة به هي كما يلي، [12][13][14]
أين هو الجزء المولي من الرادون، هي درجة الحرارة المطلقة، و و هي ثوابت المذيبات.
الخواص الكيميائية
[عدل]الرادون هو عضو في عناصر التكافؤ الصفري التي تسمى الغازات النبيلة، وهي كيميائية ليست شديدة التفاعل. إن نصف عمر الرادون -222 البالغ 3.8 أيام يجعله مفيدًا في العلوم الفيزيائية باعتباره متتبعًا طبيعيًا. لأن الرادون هو غاز في الظروف القياسية، على عكس سلسلة اضمحلاله، يمكن استخراجه بسهولة من أجل البحث.[15]
إنه خامل لمعظم التفاعلات الكيميائية الشائعة، مثل الاحتراق، لأن غلاف التكافؤ الخارجي يحتوي على ثمانية إلكترونات. ينتج عن ذلك تكوين ثابت ومستقر للطاقة يتم فيه ربط الإلكترونات الخارجية بإحكام.[16] أول طاقة تأين لها - أدنى طاقة مطلوبة لاستخراج إلكترون واحد منها - هي 1037 كيلوجول / مول.[17] وفقا لل اتجاهات الدورية، الرادون لديها أقل الكهربية من فترة واحدة عنصر قبل ذلك، زينون، وبالتالي أكثر استجابة. خلصت الدراسات المبكرة إلى أن ثبات هيدرات الرادون يجب أن يكون بنفس ترتيب هيدرات الكلور (Cl2) أو ثاني أكسيد الكبريت (SO2)، وأعلى بكثير من استقرار هيدرات كبريتيد الهيدروجين (H2S).[18]
بسبب تكلفتها ونشاطها الإشعاعي، نادرًا ما يتم إجراء البحوث الكيميائية التجريبية باستخدام الرادون، ونتيجة لذلك هناك عدد قليل جدًا من مركبات الرادون التي تم الإبلاغ عنها، سواء كانت فلوريد أو أكاسيد. يمكن أن يتأكسد الرادون بواسطة عوامل مؤكسدة قوية مثل الفلور، وبالتالي تكوين ثنائي فلوريد الرادون (RnF2).[19][20] يتحلل مرة أخرى إلى عناصره عند درجة حرارة أعلى من 523 ك (250 °م؛ 482 °ف)، ويتم اختزاله بواسطة الماء إلى غاز الرادون وفلوريد الهيدروجين: يمكن أيضًا تقليله مرة أخرى إلى عناصره بواسطة غاز الهيدروجين. [21] لديها تقلبات منخفضة وكان يعتقد أنها RnF2. بسبب قصر عمر الرادون والنشاط الإشعاعي لمركباته، لم يكن من الممكن دراسة المركب بأي تفاصيل. تتنبأ الدراسات النظرية على هذا الجزيء أنه يجب أن يكون له مسافة رابطة Rn-F تبلغ 2.08 أنجستروم (Å)، وأن المركب أكثر استقرارًا من الناحية الديناميكية الحرارية وأقل تقلبًا من نظيره الأخف وزناً ثنائي فلوريد الزينون (XeF2).[22] جزيء الاوكتاهدرا RnF6 وكان من المتوقع أن يكون أقل من ذلك RnF6 المحتوى الحراري للتشكيل من ديفلوريد.[23] يعتقد أن أيون [RnF] + يتكون من خلال التفاعل التالي:[24]
- Rn (g) + 2 [O2]+[SbF6]- (s) → [RnF]+[Sb2F11]- (s) + 2 O2 (g)
لهذا السبب، خماسي فلوريد الأنتيمون مع الكلور ثلاثي فلوريد و N2F2Sb2F11 لإزالة غاز الرادون في مناجم اليورانيوم بسبب تكوين مركبات الرادون والفلور.[15] يمكن أن تتشكل مركبات الرادون عن طريق اضمحلال الراديوم في هاليدات الراديوم، وهو تفاعل تم استخدامه لتقليل كمية الرادون التي تتسرب من الأهداف أثناء التشعيع.[21] بالإضافة إلى ذلك، أملاح [RnF] + الكاتيون مع الأنيونات SbF6-، TaF6-، و BiF6- معروفة.[21] يتأكسد الرادون أيضًا بواسطة ثنائي فلوريد ثنائي الأوكسجين إلى RnF2 في 173 ك (−100 °م؛ −148 °ف).[21]
تعتبر أكاسيد الرادون من بين المركبات القليلة الأخرى التي تم الإبلاغ عنها من غاز الرادون؛ [25] فقط ثلاثي أكسيد (RnO3) تم تأكيده.[26] الفلورايد العالي وتم ادعاء RnF6 [26] وتم حسابها على أنها مستقرة، [27] ولكن من المشكوك فيه ما إذا كان قد تم تصنيعها بعد.[26] قد تكون قد لوحظت في التجارب حيث تم تقطير منتجات غير معروفة تحتوي على الرادون مع سداسي فلوريد الزينون: قد تكون هذه هي RnF4، RnF6 أو كليهما.[21] يُزعم أن تسخين غاز الرادون باستخدام الزينون والفلور وخماسي فلوريد البروم وفلوريد الصوديوم أو فلوريد النيكل أعلى أيضًا والذي يتحلل بالماء لتشكيل RnO3. في حين تم اقتراح أن هذه الادعاءات كانت حقًا بسبب الرادون المترسب كمركب صلب [RnF]
2
2 [NiF 6 ] 2−، حقيقة أن الرادون يترسب من محلول مائي مع CsXeO3F كتأكيد على أن RnO3، والذي تم دعمه من خلال مزيد من الدراسات للمحلول المائي. أن [البحرية السلطانية العمانية 3 F] - لم تشكل في تجارب أخرى قد يكون نتيجة لارتفاع تركيز الفلورايد المستخدمة. تشير دراسات الهجرة الكهربائية أيضًا إلى وجود [HRnO 3 ] + وأنيوني [HRnO 4 ] - أشكال الرادون في محلول مائي ضعيف الحمضية > 5)، وقد تم التحقق من صحة الإجراء مسبقًا عن طريق فحص ثلاثي أكسيد الزينون المتماثل.[26]
من المحتمل أن الصعوبة في تحديد الفلوريدات الأعلى من الرادون تنبع من إعاقة الرادون حركيًا من التأكسد إلى ما بعد الحالة ثنائية التكافؤ بسبب الأيونية القوية لثنائي فلوريد الرادون (RnF2) والشحنة الموجبة العالية على الرادون في RnF + ؛ قد يكون الفصل المكاني لجزيئات RnF 2 ضروريًا للتعرف بوضوح على فلوريد الرادون الأعلى، والتي منها RnF4 المتوقع أن يكون RnF6 بسبب انقسام المدار الدوراني لقذيفة الرادون 6p (سيكون لدى Rn IV غلاف مغلق 6s 2
1/2
1/2 التكوين). لذلك، بينما RnF4 يجب أن يتمتع باستقرار مماثل لثبات زينون رباعي فلوريد (XeF XeF4)، RnF6 المرجح أن يكون XeF6 6 أقل استقرارًا من سداسي فلوريد الزينون (XeF6): من المحتمل أيضًا أن يكون سداسي فلوريد الرادون جزيء ثماني السطوح منتظم، على عكس الهيكل المشوه ثماني السطوح لـ XeF6، بسبب تأثير الزوج الخامل.[28][29] قد يشير الاستقراء أسفل مجموعة الغازات النبيلة أيضًا إلى احتمال وجود RnO و RnO 2 و RnOF 4، بالإضافة إلى أول كلوريد الغازات النبيلة المستقرة كيميائيًا RnCl 2 و RnCl 4، ولكن لم يتم العثور على أي منها حتى الآن.[21]
تم توقع أن يكون الرادون كربونيل (RnCO) مستقرًا وله هندسة جزيئية خطية.[30] الجزيئات Rn2 و RnXe مستقرًا بشكل كبير عن طريق اقتران مدار الدوران.[31] تم اقتراح الرادون المحبوس داخل فوليرين كدواء للأورام.[32][33] على الرغم من وجود Xe (VIII)، لم يُزعم وجود مركبات Rn (VIII)؛ يجب أن يكون RnF 8 غير مستقر كيميائيًا بدرجة عالية (XeF 8 غير مستقر ديناميكيًا حراريًا). من المتوقع أن يكون مركب Rn (VIII) الأكثر استقرارًا هو الباريوم بيرادونيت (Ba 2 RnO 6)، وهو مشابه لبيركسينات الباريوم.[27] يرجع عدم استقرار Rn (VIII) إلى التثبيت النسبي لصدفة 6s، المعروف أيضًا باسم تأثير الزوج الخامل.[27]
يتفاعل الرادون مع فلوريد الهالوجين السائل ClF، و ClF 3، و ClF 5، و BrF 3، و BrF 5، و IF 7 لتكوين RnF 2. في محلول فلوريد الهالوجين، يكون الرادون غير متطاير ويوجد مثل الكاتيونات RnF + و Rn 2+ ؛ تؤدي إضافة الأنيونات الفلورايد إلى تكوين مجمعات RnF3- و RnF42-، بالتوازي مع كيمياء البريليوم (II) والألمنيوم (III).[21] تم تقدير جهد القطب القياسي للزوجين Rn 2+ / Rn على أنه +2.0 V، [34] على الرغم من عدم وجود دليل على تكوين أيونات الرادون أو المركبات المستقرة في محلول مائي.[21]
النظائر
[عدل]الرادون ليس له نظائر مستقرة. تم تمييز تسعة وثلاثين نظيرًا مشعًا، وتتراوح كتلتها الذرية من 193 إلى 231.[35][36] أكثر النظائر استقرارًا هو 222 Rn، وهو ناتج اضمحلال لـ 226 Ra، وهو منتج اضمحلال لـ 238 U. [37] يوجد أيضًا مقدار ضئيل من النظير (غير المستقر للغاية) 218 Rn بين بنات 222 Rn.
ثلاثة نظائر رادون أخرى لها نصف عمر يزيد عن ساعة: 211 Rn و 210 Rn و 224 Rn. النظير 220 Rn هو نتاج اضمحلال طبيعي لنظير الثوريوم الأكثر استقرارًا (232 ث)، ويشار إليه عادةً باسم الثورون. يبلغ عمر النصف 55.6 ثانية ويصدر أيضًا إشعاع ألفا. وبالمثل، مشتق 219 آكانيوز من معظم النظائر استقرارا من الأكتينيوم (227 م) -named «الأكتينون» -و هو باعث ألفا مع نصف حياة 3.96 ثواني.[35] لا توجد نظائر الرادون تحدث بشكل ملحوظ في سلسلة اضمحلال النبتونيوم (237 Np)، على الرغم من إنتاج كمية ضئيلة من النظير (غير المستقر للغاية) 217 Rn.

وليدات
[عدل]ينتمي 222 Rn إلى سلسلة اضمحلال الراديوم واليورانيوم 238، وله عمر نصف يبلغ 3.8235 يومًا. منتجاتها الأربعة الأولى (باستثناء مخططات الانحلال الهامشي) قصيرة العمر للغاية، مما يعني أن التفكك المقابل يدل على توزيع الرادون الأولي. يمر اضمحلالها بالتسلسل التالي:[35]
- 222 Rn، 3.82 يومًا، يتحلل ألفا إلى...
- 218 Po، 3.10 دقيقة، تتحلل ألفا إلى...
- 214 Pb، 26.8 دقيقة، تحلل بيتا إلى...
- 214 Bi، 19.9 دقيقة، تحلل بيتا إلى...
- 214 بو، 0.1643 مللي ثانية، يتحلل ألفا إلى...
- 210 Pb، الذي يبلغ نصف عمر أطول بكثير 22.3 سنة، بيتا يتحلل إلى...
- 210 ثنائية، 5.013 يومًا، تحلل بيتا إلى...
- 210 بو، 138.376 يومًا، تتحلل ألفا إلى...
- 206 رطل، مستقر.
عامل توازن الرادون [38] هو النسبة بين نشاط جميع سلالات الرادون قصيرة المدة (المسؤولة عن معظم تأثيرات الرادون البيولوجية) والنشاط الذي سيكون في حالة توازن مع الرادون الأم.
إذا تم تزويد حجم مغلق بالرادون باستمرار، فإن تركيز النظائر قصيرة العمر سيزداد حتى يتم الوصول إلى التوازن حيث معدل اضمحلال كل منتج من منتجات الاضمحلال سوف يساوي ذلك الخاص بالرادون نفسه. عامل التوازن هو 1 عندما يكون كلا النشاطين متساويين، مما يعني أن نواتج الاضمحلال بقيت قريبة من أصل الرادون لفترة كافية للوصول إلى التوازن، في غضون ساعتين. في ظل هذه الظروف، فإن كل pCi / L إضافي من الرادون سيزيد من التعرض بمقدار 0.01 مستوى العمل (WL، مقياس النشاط الإشعاعي الذي يشيع استخدامه في التعدين). لا يتم استيفاء هذه الشروط دائمًا؛ في كثير من المنازل، يكون عامل التوازن عادةً 40٪ ؛ وهذا يعني أنه سيكون هناك 0.004 WL البنات لكل pCi / L من الرادون في الهواء.[39] 210 Pb تستغرق وقتًا أطول (عقود) لتتوازن مع الرادون، ولكن إذا سمحت البيئة بتراكم الغبار على مدى فترات طويلة من الزمن، فإن 210 Pb ومنتجاتها المتحللة قد تساهم في مستويات الإشعاع الإجمالية أيضًا.
بسبب شحنتها الكهروستاتيكية، تلتصق سلالات الرادون بالأسطح أو جزيئات الغبار، بينما لا يلتصق الرادون الغازي. يزيلها التعلق من الهواء، وعادة ما يتسبب في أن يكون عامل التوازن في الغلاف الجوي أقل من 1. ينخفض عامل التوازن أيضًا عن طريق دوران الهواء أو أجهزة ترشيح الهواء، ويزيد من خلال جزيئات الغبار المحمولة جواً، بما في ذلك دخان السجائر. عامل التوازن الموجود في الدراسات الوبائية هو 0.4.[40]
التاريخ وأصل المصطلح
[عدل]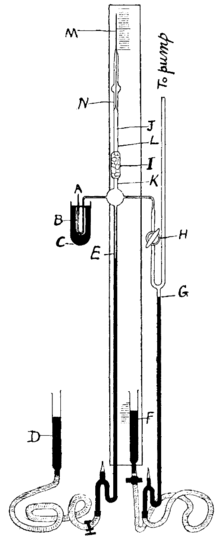
كان الرادون خامس عنصر مشع تم اكتشافه في عام 1899 من قبل إرنست رذرفورد وروبرت بي أوينز في جامعة ماكجيل في مونتريال، [41] بعد اليورانيوم والثوريوم والراديوم والبولونيوم.[42][43][44][45][46] في عام 1899، لاحظ بيير وماري كوري أن الغاز المنبعث من الراديوم ظل مشعًا لمدة شهر.[47] في وقت لاحق من ذلك العام، لاحظ رذرفورد وأوينز الاختلافات عند محاولتهما قياس الإشعاع من أكسيد الثوريوم.[41] لاحظ رذرفورد أن مركبات الثوريوم تصدر باستمرار غازًا مشعًا يظل مشعًا لعدة دقائق، (باللاتينية: emanare)، [48] وبعد ذلك «انبعاث الثوريوم» ("Th Em"). في عام 1900، أبلغ فريدريك إرنست دورن عن بعض التجارب التي لاحظ فيها أن مركبات الراديوم تنبعث من غاز مشع أطلق عليه اسم «انبعاث الراديوم» ("Ra Em").[49][50] في عام 1901، أظهر رذرفورد وهارييت بروكس أن الانبعاث مشعة، لكن الفضل في اكتشاف هذا العنصر هو كوريس.[51] في عام 1903، لوحظ انبعاث مماثل من الأكتينيوم بواسطة أندريه لويس ديبيرن، [52][53] وكان يطلق عليها «انبعاث الأكتينيوم» ("Ac Em").
وسرعان ما تم اقتراح عدة أسماء بالأسبانية مختصرة للانبعاثات الثلاثة وهم: (exradio، exthorio، exactinio)، وفي عام 1904 تم اقتراح الأسماء؛ [54] الرادون (Ro)، الثورون (To)، وأكتون (Ao)، وفي عام 1918 تم اقتراح الأسماء [55] راديون، ثوريون، وأكتينون في عام 1919، [56] وفي النهاية تم اعتماد الأسماء الآتية: الرادون، والثورون، والأكتينون في عام 1920.[57] (لا يرتبط اسم الرادون باسم عالم الرياضيات النمساوي يوهان رادون). أدى تشابه أطياف هذه الغازات الثلاثة مع أطياف الأرجون والكريبتون والزينون، والقصور الذاتي الكيميائي الملحوظ إلى السير ويليام رامزي في عام 1904 إلى أن «الانبعاث» قد تحتوي على عنصر جديد من عائلة الغازات النبيلة.[54]
في أوائل القرن العشرين في الولايات المتحدة، دخل الذهب الملوث بابنة الرادون 210 Pb إلى صناعة المجوهرات. كان هذا من بذور الذهب التي احتوت على 222 Rn التي تم صهرها بعد أن تآكل الرادون.[58][59]
في عام 1909، عزل رامزي وروبرت وايتلاو جراي الرادون وحددا درجة حرارة انصهاره وكثافته التقريبية. في عام 1910، قرروا أنه كان أثقل غاز معروف.[60] لقد كتبوا أن " (بالفرنسية: L'expression l'émanation du radium est fort incommode)" ويعني حرفياً («تعبير «انبعاث الراديوم» محرج جدًا») وتم اقترح الاسم الجديد نيتون (Nt) (من (باللاتينية: nitens)، ساطع) للتأكيد على خاصية اللمعان الإشعاعي، [61] وفي عام 1912 تم قبولها من قبل اللجنة الدولية للأوزان الذرية. في عام 1923، اختارت اللجنة الدولية للعناصر الكيميائية والاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) من بين أسماء الرادون (Rn) والثورون (Tn) والأكتينون (An). في وقت لاحق، عندما تم ترقيم النظائر بدلاً من تسميتها، أخذ العنصر اسم النظير الأكثر استقرارًا، الرادون، بينما تمت إعادة تسمية Tn إلى 220 Rn وتم تغيير اسم An إلى 219 Rn، مما تسبب في بعض الارتباك في الأدبيات المتعلقة باكتشاف العنصر كما هو الحال في دورن اكتشف الرادون النظير، لم يكن أول من اكتشف الرادون العنصر.[62]
في أواخر الستينيات، تمت الإشارة أيضًا إلى العنصر ببساطة باسم الانبعاث.[63] تم الحصول على أول مركب مركب من الرادون، فلوريد الرادون، في عام 1962.[64] حتى اليوم، قد تشير كلمة الرادون إلى العنصر أو نظيره 222 Rn، مع بقاء الثورون قيد الاستخدام كاسم قصير لـ 220 Rn لوقف هذا الغموض. نادرًا ما يتم العثور على اسم أكتينون لـ 219 Rn اليوم، وربما يرجع ذلك إلى قصر عمر النصف لهذا النظير.[62]
خطر التعرض الشديد لغاز الرادون في المناجم، حيث يمكن أن يصل التعرض إلى 1,000,000 Bq / m 3، معروف منذ زمن طويل. في عام 1530، وصف باراسيلسوس مرض الهزال الذي يصيب عمال المناجم، والمعدن الضخم، وأوصى جورج أجريكولا بالتهوية في المناجم لتجنب هذا المرض الجبلي (بيرجسوخت).[65][66] في عام 1879، تم تحديد هذه الحالة على أنها سرطان الرئة من قبل هارتنج وهيس في تحقيقهم لعمال المناجم من شنيبيرج، ألمانيا. أجريت الدراسات الرئيسية الأولى حول الرادون والصحة في سياق تعدين اليورانيوم في منطقة يواكيمستال في بوهيميا.[67] في الولايات المتحدة، اتبعت الدراسات والتخفيف عقودًا فقط من الآثار الصحية على عمال مناجم اليورانيوم في جنوب غرب الولايات المتحدة الذين تم توظيفهم خلال أوائل الحرب الباردة. لم يتم تنفيذ المعايير حتى عام 1971.[68]
تم توثيق وجود غاز الرادون في الهواء الداخلي منذ عام 1950. ابتداءً من السبعينيات، بدأ البحث لمعالجة مصادر الرادون الداخلي، ومحددات التركيز، والتأثيرات الصحية، ونهج التخفيف. في الولايات المتحدة، حظيت مشكلة الرادون الداخلي بدعاية واسعة النطاق وتحقيقات مكثفة بعد حادثة تم نشرها على نطاق واسع في عام 1984. أثناء المراقبة الروتينية في محطة الطاقة النووية في ولاية بنسلفانيا، وجد أن عاملًا ملوثًا بالنشاط الإشعاعي. تم تحديد تركيز عالٍ من غاز الرادون في منزله لاحقًا على أنه المسؤول.[69]
حقيقة
[عدل]وحدات التركيز
[عدل]
تشير جميع المناقشات حول تركيزات الرادون في البيئة إلى 222 Rn. في حين أن متوسط معدل الإنتاج البالغ 220 Rn (من سلسلة اضمحلال الثوريوم) هو تقريبًا نفس معدل 222 Rn، فإن كمية 220 Rn في البيئة أقل بكثير من 222 Rn بسبب قصر عمر النصف لـ 220 Rn (55 ثانية، مقابل 3.8 يوم على التوالي).[2]
يُقاس تركيز الرادون في الغلاف الجوي عادةً بوحدة بيكريل لكل متر مكعب (Bq / m 3)، وهي الوحدة المشتقة من النظام الدولي للوحدات. وحدة قياس أخرى شائعة في الولايات المتحدة هي بيكوكري لكل لتر (pCi / L)؛ 1 pCi / L = 37 بكريل / م 3.[39] يبلغ متوسط التعرض المحلي النموذجي حوالي 48 Bq / m 3 في الداخل، على الرغم من أن هذا يختلف على نطاق واسع، و 15 بيكريل / م 3 في الهواء الطلق.[71]
في صناعة التعدين، يُقاس التعرض تقليديًا في مستوى العمل (WL)، والتعرض التراكمي في شهر مستوى العمل (WLM)؛ 1 WL يساوي أي مجموعة من 222 بنات Rn قصيرة العمر (218 Po و 214 Pb و 214 Bi و 214 Po) في 1 لتر من الهواء يطلق 1.3 × 10 5 MeV لطاقة ألفا المحتملة ؛ [39] 1 WL يعادل 2.08 × 10 −5 جول لكل متر مكعب من الهواء (J / m 3).[2] يتم التعبير عن وحدة SI للتعرض التراكمي بالجول-ساعة لكل متر مكعب (J · h / m 3). WLM واحد يعادل 3.6 × 10 −3 جول · ح / م 3. التعرض ل 1 WL لشهر عمل واحد (170 ساعة) يساوي 1 التعرض التراكمي WLM. التعرض التراكمي 1 تعادل WLM تقريبًا العيش لمدة عام واحد في جو بتركيز غاز الرادون 230 بكريل / م 3.[72]
يتحلل 222 Rn إلى 210 Pb والنظائر المشعة الأخرى. يمكن قياس مستويات 210 Pb. معدل ترسب هذا النظائر المشعة يعتمد على الطقس.
تركيزات الرادون الموجودة في البيئات الطبيعية منخفضة للغاية بحيث لا يمكن اكتشافها بالوسائل الكيميائية. أ 1000 تركيز Bq / m 3 (مرتفع نسبيًا) يتوافق مع 0.17 بيكوجرام لكل متر مكعب (pg / m 3). يبلغ متوسط تركيز غاز الرادون في الغلاف الجوي حوالي 6 ×10−18 نسبة مولارية، أو حوالي 150 ذرة في كل مليلتر من الهواء.[73] ينشأ نشاط الرادون في الغلاف الجوي للأرض بأكمله من بضع عشرات من جرامات الرادون، والتي يتم استبدالها باستمرار بتآكل كميات أكبر من الراديوم والثوريوم واليورانيوم.[74]
طبيعي
[عدل]
ينتج الرادون عن طريق الانحلال الإشعاعي للراديوم -226 الموجود في خامات اليورانيوم وصخور الفوسفات والصخر الزيتي والصخور النارية والمتحولة مثل الجرانيت والزنيس والشست، وبدرجة أقل في الصخور الشائعة مثل الحجر الجيري.[3][75] كل ميل مربع من التربة السطحية حتى عمق 6 بوصة (2.6 كم 2 إلى عمق 15 سم)، يحتوي على ما يقرب من 1 غرام من الراديوم، الذي يطلق غاز الرادون بكميات صغيرة في الغلاف الجوي.[2] على المستوى العالمي، تشير التقديرات إلى أنه يتم إطلاق 2.4 مليار كوري (90 مكافئًا) من الرادون من التربة سنويًا.[76]
يمكن أن يختلف تركيز الرادون بشكل كبير من مكان إلى آخر. في الهواء الطلق، تتراوح من 1 إلى 100 بيكريل / م 3، حتى أقل (0.1 بكريل / م 3) فوق المحيط. في الكهوف أو المناجم المهواة، أو المنازل سيئة التهوية، يرتفع تركيزها إلى 20-2000 بكريل / م 3.[77]
يمكن أن يكون تركيز الرادون أعلى بكثير في سياقات التعدين. تعليمات لوائح التهوية للحفاظ على تركيز الرادون في مناجم اليورانيوم تحت «مستوى العمل»، مع مستويات 95 في المائة تصل إلى ما يقرب من 3 WL (546 222 Rn لكل لتر من الهواء ؛ 20.2 كيلو بيكريل / م 3، تم قياسه من 1976 إلى 1985).[2] يبلغ متوسط التركيز في الهواء في معرض وادي غاشتاين (غير المزود بالتهوية) 43 كيلو بيكريل / م 3 (1.2nCi / L) بقيمة قصوى تبلغ 160 كيلو بيكريل / م 3 (4.3nCi / L).[78]
يظهر الرادون في الغالب مع سلسلة الاضمحلال لسلسلة الراديوم واليورانيوم (222 Rn)، وبشكل هامشي مع سلسلة الثوريوم (220 Rn). ينبع العنصر بشكل طبيعي من الأرض، وبعض مواد البناء، في جميع أنحاء العالم، حيث توجد آثار لليورانيوم أو الثوريوم، وخاصة في المناطق التي تحتوي على تربة تحتوي على الجرانيت أو الصخر الزيتي، والتي تحتوي على تركيز أعلى من اليورانيوم. ليست كل مناطق الجرانيت عرضة لانبعاثات عالية من غاز الرادون. لكونه غازًا نادرًا، فإنه عادة ما يهاجر بحرية من خلال الصدوع والتربة المجزأة، وقد يتراكم في الكهوف أو المياه. نظرًا لعمرها النصفي القصير جدًا (أربعة أيام لـ 222 Rn)، ينخفض تركيز الرادون بسرعة كبيرة عندما تزداد المسافة من منطقة الإنتاج. يختلف تركيز الرادون اختلافًا كبيرًا باختلاف الموسم والظروف الجوية. على سبيل المثال، ثبت أنه يتراكم في الهواء إذا كان هناك انعكاس جوي ورياح قليلة.[79]
يمكن العثور على تركيزات عالية من الرادون في بعض مياه الينابيع والينابيع الساخنة.[80] مدن بولدر، مونتانا بباد كروزناخ، ألمانيا؛ ودولة اليابان لديها ينابيع غنية بالراديوم تنبعث منها غاز الرادون. لتصنيفها على أنها مياه غاز الرادون المعدنية، يجب أن يكون تركيز الرادون أعلى من 2 nCi / L (74 كيلو بيكريل / م 3).[81] يصل نشاط مياه الرادون المعدنية إلى 2000 كيلو بيكريل / م 3 في ميرانو و 4000 كيلو بيكريل / م 3 في لوريسيا (إيطاليا).[78]
تركيزات الرادون الطبيعية في الغلاف الجوي للأرض منخفضة جدًا لدرجة أن المياه الغنية بالرادون التي تلامس الغلاف الجوي ستفقد الرادون باستمرار عن طريق التطاير. وبالتالي، تحتوي المياه الجوفية على تركيز أعلى يبلغ 222 Rn من المياه السطحية، لأن الرادون ينتج باستمرار عن طريق التحلل الإشعاعي البالغ 226 Ra الموجود في الصخور. وبالمثل، غالبًا ما تحتوي المنطقة المشبعة من التربة على نسبة أعلى من الرادون من المنطقة غير المشبعة بسبب الخسائر المنتشرة في الغلاف الجوي.[82][83]
في عام 1971، تجاوز أبولو 15 110 كـم (68 ميل) فوق هضبة أرسطرخس على القمر، واكتشفت ارتفاعًا ملحوظًا في جسيمات ألفا يعتقد أنها ناجمة عن اضمحلال 222 Rn. تم الاستدلال على وجود 222 Rn لاحقًا من البيانات التي تم الحصول عليها من مطياف جسيمات ألفا لونار بروسبكتر [84]
يوجد الرادون في بعض البترول. نظرًا لأن الرادون له منحنى ضغط ودرجة حرارة مماثل للبروبان، وتقوم مصافي النفط بفصل البتروكيماويات بناءً على نقاط غليانها، فإن الأنابيب التي تحمل البروبان المنفصل حديثًا في مصافي النفط يمكن أن تصبح مشعة بسبب تحلل الرادون ومنتجاته.[85]
غالبًا ما تحتوي المخلفات من صناعة البترول والغاز الطبيعي على الراديوم وبناته. يمكن أن يكون مقياس الكبريتات من بئر النفط غنيًا بالراديوم، بينما تحتوي المياه والنفط والغاز من البئر غالبًا على الرادون. يتحلل الرادون ليشكل نظائر مشعة صلبة تشكل طلاءات داخل الأنابيب.[85]
التراكم في المباني
[عدل]

تم اكتشاف تركيزات عالية من غاز الرادون في المنازل عن طريق الصدفة في عام 1985 بعد أن كشفت الاختبارات الإشعاعية الصارمة التي أجريت في محطة توليد الطاقة النووية الجديدة في ليمريك أن ستانلي واتراس، مهندس البناء في المحطة، قد تلوث بالمواد المشعة على الرغم من أن المفاعل لم يسبق له مثيل. تم تغذيته.[86] تبلغ حالات التعرض المحلية النموذجية حوالي 100 بيكريل / م 3 (2.7 بيكسل / لتر) بالداخل. سيتم العثور على مستوى معين من غاز الرادون في جميع المباني. يدخل غاز الرادون في الغالب إلى المبنى مباشرةً من التربة عبر أدنى مستوى في المبنى يكون على اتصال بالأرض. يمكن أن تؤدي المستويات العالية من الرادون في إمدادات المياه أيضًا إلى زيادة مستويات هواء الرادون في الأماكن المغلقة. نقاط الدخول النموذجية لغاز الرادون إلى المباني هي شقوق في الأساسات والجدران الصلبة، ومفاصل البناء، والفجوات في الأرضيات المعلقة وحول أنابيب الخدمة، والفجوات داخل الجدران، وإمدادات المياه.[8] قد تختلف تركيزات الرادون في نفس المكان بمقدار الضعف / النصف خلال ساعة واحدة. أيضًا، قد يختلف التركيز في غرفة واحدة من المبنى بشكل كبير عن التركيز في الغرفة المجاورة.[2] تعتبر خصائص التربة في المساكن أهم مصدر لغاز الرادون في الطابق الأرضي، كما أن تركيز الرادون الداخلي أعلى لوحظ في الطوابق السفلية. تم الإبلاغ عن معظم تركيزات الرادون العالية من أماكن قريبة من مناطق الصدع؛ ومن ثم فإن وجود علاقة بين معدل الزفير من العيوب وتركيزات الرادون الداخلي واضح.
سيختلف توزيع تركيزات الرادون بشكل عام من غرفة إلى أخرى، ويتم حساب متوسط القراءات وفقًا للبروتوكولات التنظيمية. يُفترض عادةً أن تركيز الرادون الداخلي يتبع التوزيع اللوغاريتمي الطبيعي في منطقة معينة.[87] وبالتالي، يتم استخدام المتوسط الهندسي بشكل عام لتقدير «متوسط» تركيز الرادون في منطقة ما.[88]
يتراوح متوسط التركيز من أقل من 10 بيكريل / م 3 إلى أكثر من 100 بكريل / م 3 في بعض الدول الأوروبية.[89] تتراوح الانحرافات المعيارية الهندسية النموذجية الموجودة في الدراسات بين 2 و 3، مما يعني (بالنظر إلى قاعدة 68-95-99.7) أنه من المتوقع أن يكون تركيز الرادون أكثر من مائة مرة من متوسط التركيز في 2٪ إلى 3٪ من الحالات.
تم العثور على بعض من أعلى مخاطر الرادون في الولايات المتحدة في ولاية أيوا ومناطق جبال الأبلاش في جنوب شرق ولاية بنسلفانيا.[90] تمتلك ولاية أيوا أعلى متوسط لتركيزات الرادون في الولايات المتحدة بسبب التجلد الكبير الذي أدى إلى ترسب الصخور الجرانيتية من الدرع الكندي ووضعها كتربة تشكل الأراضي الزراعية الغنية بولاية أيوا.[91] اجتاز العديد من المدن داخل الولاية، مثل مدينة أيوا، متطلبات البناء المقاوم للرادون في المنازل الجديدة. تم العثور على ثاني أعلى قراءات في أيرلندا في مباني المكاتب في بلدة مالو الأيرلندية، مقاطعة كورك، مما أثار مخاوف محلية بشأن سرطان الرئة.[92]
في أماكن قليلة، تم استخدام مخلفات اليورانيوم في مدافن النفايات وتم البناء عليها لاحقًا، مما أدى إلى زيادة التعرض المحتمل لغاز الرادون.[2]
نظرًا لأن الرادون غاز عديم اللون والرائحة، فإن الطريقة الوحيدة لمعرفة مقدار ما هو موجود في الهواء أو الماء هو إجراء الاختبارات. في الولايات المتحدة، تتوفر مجموعات اختبار الرادون للجمهور في متاجر البيع بالتجزئة، مثل متاجر الأجهزة، للاستخدام المنزلي، والاختبار متاح من خلال محترفين مرخصين، وهم غالبًا مفتشون منزليون. الجهود المبذولة لتقليل مستويات الرادون في الأماكن المغلقة تسمى تخفيف الرادون. في الولايات المتحدة، توصي وكالة حماية البيئة (EPA) باختبار جميع المنازل بحثًا عن غاز الرادون. في المملكة المتحدة بموجب نظام تصنيف الصحة والسلامة للإسكان (HHSRS)، يلتزم مالكو العقارات بتقييم المخاطر والأخطار المحتملة على الصحة والسلامة في العقارات السكنية.[93]
الإنتاج الصناعي
[عدل]يتم الحصول على الرادون كمنتج ثانوي لمعالجة خامات اليورانيوم بعد تحويله إلى محاليل 1٪ من أحماض الهيدروكلوريك أو أحماض الهيدروبروميك. يحتوي خليط الغاز المستخرج من المحاليل على H2، O2، هو، آكانيوز، CO2، H2O والمحروقات. يتم تنقية الخليط عن طريق تمريره فوق النحاس عند 993 ك (720 °م؛ 1,328 °ف) لإزالة H2 و O2، ثم KOH وP2O5 ـ تستخدم لإزالة الأحماض والرطوبة عن طريق الامتصاص. يتم تكثيف الرادون بواسطة النيتروجين السائل وتنقيته من الغازات المتبقية عن طريق التسامي.[94]
مقياس التركيز
[عدل]| بكريل / م 3 | بكي / لتر | مثال حادثة |
|---|---|---|
| 1 | ~ 0.027 | عادةً ما يكون تركيز الرادون على شواطئ المحيطات الكبيرة 1 بكريل / م 3. يمكن أن يكون تركيز أثر الرادون فوق المحيطات أو في القارة القطبية الجنوبية أقل من 0.1 بكريل / م 3. |
| 10 | 0.27 | متوسط التركيز القاري في الهواء الطلق: من 10 إلى 30 بكريل / م 3. بناءً على سلسلة من الاستطلاعات، يُقدر المتوسط العالمي لتركيز الرادون الداخلي بـ 39 بكريل / م 3. |
| 100 | 2.7 | التعرض المحلي الداخلي النموذجي. اعتمدت معظم البلدان تركيز الرادون 200-400 Bq / m 3 للهواء الداخلي كإجراء أو مستوى مرجعي. إذا أظهر الاختبار مستويات أقل من 4 بيكوكوري من الرادون لكل لتر من الهواء (150 Bq / m 3)، فلا داعي لاتخاذ أي إجراء. تعرض تراكمي 230 يقابل بيكريل / م 3 من تركيز غاز الرادون خلال فترة سنة واحدة 1 WLM. |
| 1,000 | 27 | تركيزات عالية جدًا من الرادون (> 1000 Bq / m 3) في منازل مبنية على تربة تحتوي على نسبة عالية من اليورانيوم و / أو نفاذية عالية للأرض. إذا كانت المستويات 20 بيكوكري رادون لكل لتر من الهواء (800 بكريل / م 3) أو أعلى، يجب على صاحب المنزل النظر في نوع من الإجراءات لتقليل مستويات الرادون في الأماكن المغلقة. التركيزات المسموح بها في مناجم اليورانيوم حوالي 1220 بيكريل / م 3 (33 بيكسل / لتر) [95] |
| 10000 | 270 | يبلغ متوسط التركيز في الهواء في معرض وادي غاشتاين (عديم التهوية) 43 كيلو بيكريل / م 3 (حوالي 1.2 nCi / L) بقيمة قصوى تبلغ 160 كيلو بيكريل / م 3 (حوالي 4.3 nCi / L).[78] |
| 100,000 | ~ 2700 | حوالي 100000 بيكريل / م 3 (2.7 nCi / L) في قبو ستانلي واتراس.[96][97] |
| 1,000,000 | 27000 | تصل التركيزات إلى 1,000,000 يمكن العثور على بيكريل / م 3 في مناجم اليورانيوم عديمة التهوية. |
| ~5.54 × 1019 | ~1.5 × 1018 | الحد الأعلى النظري: غاز الرادون (222 Rn) بتركيز 100٪ (1 جو، 0 درجة مئوية)؛ 1.538 × 10 5 كوري / جرام ؛ [98] 5.54 × 10 19 بيكريل / م 3. |
التطبيقات
[عدل]طبي
[عدل]كان أحد أشكال الشعوذة في أوائل القرن العشرين هو علاج أمراض الإشعاع.[99] كانت عبارة عن غرفة صغيرة محكمة الغلق للمرضى ليتعرضوا لغاز الرادون لما له من «آثار طبية». أصبحت الطبيعة المسببة للسرطان للرادون بسبب إشعاعاته المؤينة واضحة في وقت لاحق. تم استخدام النشاط الإشعاعي الضار لجزيئات الرادون لقتل الخلايا السرطانية، [100] ولكنه لا يزيد من صحة الخلايا السليمة. يتسبب الإشعاع المؤين في تكوين الجذور الحرة، مما يؤدي إلى تلف الخلايا، مما يؤدي إلى زيادة معدلات الإصابة بالأمراض، بما في ذلك السرطان.
تم اقتراح التعرض للرادون للتخفيف من أمراض المناعة الذاتية مثل التهاب المفاصل في عملية تعرف باسم هرمونات الإشعاع.[101][102] نتيجة لذلك، في أواخر القرن العشرين وأوائل القرن الحادي والعشرين، جذبت "المناجم الصحية" التي تم إنشاؤها في حوض، مونتانا، الأشخاص الذين يسعون للحصول على الإغاثة من المشاكل الصحية مثل التهاب المفاصل من خلال التعرض المحدود لمياه المناجم المشعة والرادون. هذه الممارسة غير محبذة بسبب الآثار السيئة الموثقة جيدًا للجرعات العالية من الإشعاع على الجسم.[103]
تم تطبيق حمامات المياه المشعة منذ عام 1906 في ياشيموف، جمهورية التشيك، ولكن حتى قبل اكتشاف الرادون، تم استخدامها في باد جاستين، النمسا. كما تُستخدم الينابيع الغنية بالراديوم في نهر أونسن الياباني التقليدي في ميساسا بمحافظة توتوري. يتم تطبيق العلاج بالشرب في باد برامباخ، ألمانيا. ويتم العلاج بالاستنشاق في جاشتاينر هيلستولين، النمسا، في سويرادو ازدروي ، تشيرنياوا زدروي، كواري، ليدك زدروي، بولندا، في هارغيتا باي، رومانيا، وفي بولدر بولاية مونتانا. في الولايات المتحدة وأوروبا، هناك العديد من «منتجعات الرادون»، حيث يجلس الناس لدقائق أو ساعات في جو عالي الرادون.[102][104]
تم إنتاج الرادون تجاريًا لاستخدامه في العلاج الإشعاعي، ولكن في الغالب تم استبداله بالنويدات المشعة المصنوعة في مسرعات الجسيمات والمفاعلات النووية. تم استخدام الرادون في البذور القابلة للزرع، المصنوعة من الذهب أو الزجاج، وتستخدم في المقام الأول لعلاج السرطانات، والمعروفة باسم المعالجة الكثبية. تم إنتاج بذور الذهب عن طريق ملء أنبوب طويل بغاز الرادون الذي يتم ضخه من مصدر الراديوم، ثم يتم تقسيم الأنبوب إلى أقسام قصيرة عن طريق العقص والقطع. تحافظ الطبقة الذهبية على الرادون بالداخل، وتقوم بتصفية إشعاعات ألفا وبيتا، مع السماح لأشعة جاما بالهروب (التي تقتل الأنسجة المريضة). قد تتراوح الأنشطة من 0.05 إلى 5 مليكورات لكل بذرة (من 2 إلى 200 MBq).[100] يتم إنتاج أشعة جاما بواسطة الرادون وأول العناصر قصيرة العمر من سلسلة اضمحلالها (218 Po، 214 Pb، 214 Bi، 214 Po).
الرادون ومنتجاته الأولى المتحللة قصيرة العمر، تُترك البذرة في مكانها. بعد 11 نصف عمر (42 يومًا)، يكون نشاط إشعاع الرادون عند 1/2000 من مستواه الأصلي. في هذه المرحلة، ينشأ النشاط المتبقي السائد من منتج اضمحلال الرادون 210 Pb، والذي يبلغ نصف عمره (22.3 سنة) 2000 مرة من الرادون ونسله 210 Bi و 210 Po.
علمي
[عدل]يختلف انبعاث الرادون من التربة باختلاف نوع التربة ومحتوى اليورانيوم السطحي، لذلك يمكن استخدام تركيزات الرادون الخارجية لتتبع الكتل الهوائية بدرجة محدودة. تم استخدام هذه الحقيقة من قبل بعض علماء الغلاف الجوي (عاصفة الرادون). بسبب فقدان الرادون السريع للهواء والاضمحلال السريع نسبيًا، يُستخدم الرادون في الأبحاث الهيدرولوجية التي تدرس التفاعل بين المياه الجوفية والجداول. يعتبر أي تركيز كبير من غاز الرادون في مجرى مائي مؤشرًا جيدًا على وجود مدخلات محلية من المياه الجوفية.
وقد استخدمت غاز الرادون التربة تركيز بطريقة تجريبية لخريطة دفن الجيولوجية تحت السطحية قرب أخطاء لأن تركيزات عادة ما تكون أعلى على أخطاء.[105] وبالمثل، فقد وجد استخدامًا محدودًا في التنقيب عن التدرجات الحرارية الأرضية.[96]
قام بعض الباحثين بالتحقيق في التغيرات في تركيزات الرادون في المياه الجوفية للتنبؤ بالزلازل.[106][107][108] لوحظت الزيادات في غاز الرادون قبل زلازل طشقند عام 1966 [109] و1994 ميندورو [108] يبلغ عمر النصف للرادون حوالي 3.8 يومًا، مما يعني أنه لا يمكن العثور عليه إلا بعد وقت قصير من إنتاجه في سلسلة الاضمحلال الإشعاعي. لهذا السبب، تم الافتراض أن الزيادات في تركيز الرادون ترجع إلى ظهور شقوق جديدة تحت الأرض، والتي من شأنها أن تسمح بزيادة تداول المياه الجوفية، مما يؤدي إلى التخلص من غاز الرادون. قد لا يُفترض بشكل غير معقول أن تولد شقوق جديدة يسبق الزلازل الكبرى. في السبعينيات والثمانينيات من القرن الماضي، وجدت القياسات العلمية لانبعاثات الرادون بالقرب من الصدوع أن الزلازل تحدث غالبًا بدون إشارة الرادون، وغالبًا ما تم اكتشاف الرادون دون أن يتبعه زلزال. ثم تم رفضه من قبل الكثيرين باعتباره مؤشرًا غير موثوق به.[110] اعتبارًا من عام 2009، كان قيد التحقيق باعتباره مقدمة محتملة من قبل وكالة ناسا.[111]
الرادون ملوث معروف ينبعث من محطات توليد الطاقة الحرارية الأرضية لأنه موجود في المواد التي يتم ضخها من أعماق الأرض. يتشتت بسرعة، ولم يتم إثبات أي خطر إشعاعي في التحقيقات المختلفة. بالإضافة إلى ذلك، تعيد الأنظمة النموذجية حقن المادة في أعماق الأرض بدلاً من إطلاقها على السطح، وبالتالي يكون تأثيرها البيئي ضئيلًا.[112]
في الأربعينيات والخمسينيات من القرن الماضي، تم استخدام الرادون في التصوير الشعاعي الصناعي.[113][114] سرعان ما استبدلت مصادر الأشعة السينية الأخرى، التي أصبحت متاحة بعد الحرب العالمية الثانية، الرادون لهذا التطبيق، حيث كانت أقل تكلفة وأقل خطرًا من إشعاع ألفا.
المخاطر الصحية
[عدل]في المناجم
[عدل]صنفت الوكالة الدولية لأبحاث السرطان منتجات اضمحلال الرادون -222 على أنها مواد مسرطنة للإنسان، [115] وكغاز يمكن استنشاقه، فإن سرطان الرئة يمثل مصدر قلق خاص للأشخاص المعرضين لمستويات مرتفعة من الرادون للاستمرار. فترات. خلال الأربعينيات والخمسينيات من القرن الماضي، عندما لم يتم تنفيذ معايير السلامة التي تتطلب تهوية باهظة الثمن في المناجم على نطاق واسع، [116] ارتبط التعرض للرادون بسرطان الرئة بين عمال المناجم غير المدخنين لليورانيوم ومواد الصخور الصلبة الأخرى في ما يعرف الآن بجمهورية التشيك، وفيما بعد بين عمال المناجم من جنوب غرب الولايات المتحدة [117][118][119] وجنوب أستراليا.[120] على الرغم من أن هذه المخاطر كانت معروفة في أوائل الخمسينيات من القرن الماضي، [121] ظل هذا الخطر المهني يُدار بشكل سيئ في العديد من المناجم حتى السبعينيات. خلال هذه الفترة، فتح العديد من رواد الأعمال مناجم يورانيوم سابقة في الولايات المتحدة لعامة الناس وأعلنوا عن فوائد صحية مزعومة من استنشاق غاز الرادون تحت الأرض. تضمنت الفوائد الصحية المزعومة تخفيف الآلام والجيوب الأنفية والربو والتهاب المفاصل، [122][123] ولكن ثبت أنها خاطئة وحظرت الحكومة مثل هذه الإعلانات في عام 1975.[124]
منذ ذلك الوقت، تم استخدام التهوية وغيرها من التدابير لتقليل مستويات الرادون في معظم المناجم المتضررة التي لا تزال تعمل. في السنوات الأخيرة، انخفض متوسط التعرض السنوي لعمال مناجم اليورانيوم إلى مستويات مماثلة للتركيزات التي يتم استنشاقها في بعض المنازل. وقد قلل هذا من خطر الإصابة بالسرطان الناجم عن الرادون، على الرغم من أن المشكلات الصحية قد تستمر لأولئك الذين يعملون حاليًا في المناجم المتأثرة ولأولئك الذين تم توظيفهم فيها في الماضي.[125] نظرًا لانخفاض الخطر النسبي لعمال المناجم، تقلصت أيضًا القدرة على اكتشاف المخاطر الزائدة بين هؤلاء السكان.[126]
يمكن أيضًا أن تكون المخلفات الناتجة عن معالجة خام اليورانيوم مصدرًا للرادون. يمكن إطلاق غاز الرادون الناتج عن المحتوى العالي من الراديوم في المقالب المكشوفة وبرك المخلفات بسهولة في الغلاف الجوي ويؤثر على الأشخاص الذين يعيشون في المناطق المجاورة.[127]
بالإضافة إلى سرطان الرئة، افترض الباحثون احتمال زيادة خطر الإصابة بسرطان الدم بسبب التعرض للرادون. الدعم التجريبي من الدراسات التي أجريت على عامة السكان غير متسق، ووجدت دراسة أجريت على عمال مناجم اليورانيوم وجود علاقة بين التعرض للرادون وسرطان الدم الليمفاوي المزمن.[128]
قد يكون عمال المناجم (وكذلك عمال الطحن ونقل الخامات) الذين عملوا في صناعة اليورانيوم في الولايات المتحدة بين الأربعينيات و 1971 مؤهلين للحصول على تعويض بموجب قانون تعويض التعرض للإشعاع (RECA). يمكن للأقارب الباقين على قيد الحياة أيضًا التقدم بطلب في الحالات التي يكون فيها الشخص الذي كان يعمل سابقًا متوفى.
لا تتأثر مناجم اليورانيوم فقط بمستويات مرتفعة من غاز الرادون. تتأثر مناجم الفحم على وجه الخصوص أيضًا لأن الفحم قد يحتوي على يورانيوم وثوريوم أكثر من مناجم اليورانيوم العاملة تجاريًا.
التعرض على المستوى المحلي
[عدل]يؤدي التعرض المطول لمستويات أعلى من تركيز غاز الرادون إلى زيادة الإصابة بسرطان الرئة.[129] منذ عام 1999، كانت هناك تحقيقات في جميع أنحاء العالم حول كيفية تقدير تركيزات الرادون. في الولايات المتحدة وحدها، تم تسجيل المتوسطات لتكون على الأقل 40 بيكريل / متر مكعب. ستيك وآخرون. أجرى دراسة حول الاختلاف بين الرادون الداخلي والخارجي في ولاية أيوا ومينيسوتا. تم العثور على إشعاع أعلى في منطقة مأهولة بالسكان بدلاً من المناطق غير المأهولة في أمريكا الوسطى ككل. في بعض مقاطعات ولاية أيوا الشمالية الغربية وجنوب غرب مينيسوتا، تتجاوز تركيزات الرادون في الهواء الطلق المتوسط الوطني لتركيزات الرادون الداخلية.[129] على الرغم من المتوسط أعلاه، كانت أرقام مينيسوتا وأيوا متقاربة بشكل استثنائي، بغض النظر عن المسافة. هناك حاجة ماسة لجرعات دقيقة من الرادون لفهم المشاكل التي يمكن أن يسببها الرادون في المجتمع بشكل أكبر. من المفهوم أن تسمم الرادون يؤدي إلى صحة سيئة، وسرطان الرئة، ولكن مع مزيد من البحث، يمكن أن تغير الضوابط النتائج في انبعاثات الرادون داخل وخارج الوحدات السكنية.[129]
تم ربط التعرض للرادون (بنات الرادون في الغالب) بسرطان الرئة في العديد من دراسات الحالات والشواهد التي أجريت في الولايات المتحدة وأوروبا والصين. هناك ما يقرب من 21000 حالة وفاة سنويًا في الولايات المتحدة بسبب سرطان الرئة الناجم عن الرادون.[5] في سلوفينيا، البلد الذي يحتوي على نسبة عالية من الرادون، يموت حوالي 120 شخصًا سنويًا بسبب غاز الرادون.[130] وجدت واحدة من أكثر دراسات الرادون شمولاً التي أجريت في الولايات المتحدة من قبل الدكتور آر ويليام فيلد وزملاؤه أن خطر الإصابة بسرطان الرئة يزيد بنسبة 50٪ حتى في حالات التعرض المطول بمستوى عمل وكالة حماية البيئة البالغ 4 بيكو لتر / لتر. تدعم التحليلات المجمعة في أمريكا الشمالية وأوروبا هذه النتائج.[131] ومع ذلك، فإن النقاش حول النتائج المعاكسة لا يزال مستمراً، [132][133][134] وخاصة دراسة الحالات والشواهد بأثر رجعي لعام 2008 لمخاطر الإصابة بسرطان الرئة والتي أظهرت انخفاضًا كبيرًا في معدل الإصابة بالسرطان لتركيزات الرادون بين 50 و 123 بيكريل / م 3.[135]
تستند معظم نماذج التعرض السكني للرادون على دراسات لعمال المناجم، ومن المرغوب فيه بدرجة أكبر التقديرات المباشرة للمخاطر التي يتعرض لها أصحاب المنازل.[125] نظرًا لصعوبات قياس مخاطر غاز الرادون بالنسبة للتدخين، فقد استفادت منه نماذج تأثيرها في كثير من الأحيان.
يعتبر الرادون السبب الرئيسي الثاني لسرطان الرئة والسبب البيئي الرئيسي لوفيات السرطان من قبل وكالة حماية البيئة، وأولها التدخين.[136] توصل آخرون إلى استنتاجات مماثلة بالنسبة للمملكة المتحدة [125] وفرنسا.[137] قد ينشأ التعرض للرادون في المنازل والمكاتب من بعض التكوينات الصخرية الجوفية، وكذلك من بعض مواد البناء (مثل بعض الجرانيت). ينشأ الخطر الأكبر للتعرض لغاز الرادون في المباني التي تكون محكمة الإغلاق، وغير جيدة التهوية، وفيها تسريبات في الأساس تسمح للهواء من التربة إلى الطوابق السفلية وغرف المسكن.
تم قياس ثورون بتركيزات عالية نسبيًا في المباني ذات العمارة الترابية، مثل المنازل التقليدية نصف الخشبية والمنازل الحديثة ذات التشطيبات الجدارية المصنوعة من الطين. نظرًا لعمره النصفي القصير، لا يحدث الثورون إلا بالقرب من الأسطح الترابية كمصادره بينما يمكن العثور على نسله في جميع أنحاء الهواء الداخلي لمثل هذه المباني. لذلك، يحدث التعرض للإشعاع في أي مكان داخل هذه المنازل. في مساكن مختلفة ذات هندسة معمارية ترابية في ألمانيا، وجدت دراسة جرعات إشعاع داخلية سنوية بسبب استنشاق الثورون وذريته التي تصل إلى عدة ملي سيفرت.[138]
مستوى العمل والمرجع
[عدل]قدمت منظمة الصحة العالمية في عام 2009 مستوى مرجعي موصى به (المستوى المرجعي الوطني)، 100 بيكريل / م 3، لغاز الرادون في المساكن. تشير التوصية أيضًا إلى أنه في حالة عدم إمكانية ذلك، يجب اختيار 300 بيكريل / م 3 كأعلى مستوى. يجب ألا يكون المستوى المرجعي الوطني حدًا، ولكن يجب أن يمثل الحد الأقصى لمتوسط تركيز غاز الرادون السنوي المقبول في المسكن.[139]
يختلف تركيز غاز الرادون القابل للتنفيذ في المنزل اعتمادًا على المنظمة التي تقوم بالتوصية، على سبيل المثال، تشجع وكالة حماية البيئة على اتخاذ الإجراء بتركيزات منخفضة تصل إلى 74 بيكريل / م 3 (2pCi / L)، [71] ويوصي الاتحاد الأوروبي باتخاذ إجراءات عندما تصل التركيزات إلى 400 بيكريل / م 3 (11pCi / L) للمنازل القديمة و 200 بيكريل / م 3 (5pCi / L) للجديدة.[140] في 8 يوليو 2010، أصدرت وكالة حماية الصحة في المملكة المتحدة نصيحة جديدة تحدد «المستوى المستهدف» من 100 بيكريل / م 3 مع الاحتفاظ بـ «مستوى العمل» 200 بكريل / م 3.[141] تم نشر مستويات مماثلة (كما هو الحال في المملكة المتحدة) من قبل الهيئة النرويجية للإشعاع والأمان النووي (DSA) [142] مع الحد الأقصى للمدارس ورياض الأطفال والمساكن الجديدة عند 200 بيكريل / م 3، حيث 100 بيكريل / م 3 هي تعيين كمستوى العمل.[143] في جميع المساكن الجديدة يجب اتخاذ تدابير وقائية ضد تراكم الرادون.
الاستنشاق والتدخين
[عدل]تشير نتائج الدراسات الوبائية إلى أن خطر الإصابة بسرطان الرئة يزداد مع التعرض للرادون السكني. من الأمثلة المعروفة على مصدر الخطأ التدخين، وهو عامل الخطر الرئيسي لسرطان الرئة. في الولايات المتحدة، يُقدر أن تدخين السجائر يسبب 80٪ إلى 90٪ من جميع سرطانات الرئة.[144]
وفقًا لوكالة حماية البيئة، فإن خطر الإصابة بسرطان الرئة للمدخنين كبير بسبب التأثيرات التآزرية للرادون والتدخين. بالنسبة لهذه الفئة من السكان، سيموت حوالي 62 شخصًا من إجمالي 1000 بسبب سرطان الرئة مقارنةً بـ 7 أشخاص من إجمالي 1000 شخص لم يدخنوا مطلقًا.[5] لا يمكن استبعاد أن خطر غير المدخنين يجب أن يفسر في المقام الأول بتأثير الرادون.
الرادون، مثل عوامل الخطر الخارجية الأخرى المعروفة أو المشتبه بها لسرطان الرئة، هو تهديد للمدخنين والمدخنين السابقين. تم توضيح ذلك من خلال دراسة التجميع الأوروبية.[145] جاء في تعليق [145] على دراسة التجميع: «ليس من المناسب الحديث ببساطة عن خطر من غاز الرادون في المنازل. الخطر ناتج عن التدخين، ويضاعف من ذلك التأثير التآزري لغاز الرادون بالنسبة للمدخنين. بدون تدخين، يبدو التأثير ضئيلًا لدرجة أنه لا يُذكر».
وفقًا لدراسة التجميع الأوروبية، هناك اختلاف في مخاطر الأنواع الفرعية النسيجية لسرطان الرئة والتعرض للرادون. يكون سرطان الرئة ذو الخلايا الصغيرة، الذي يرتبط ارتباطًا وثيقًا بالتدخين، أكثر عرضة للإصابة بعد التعرض للرادون. بالنسبة للأنواع الفرعية النسيجية الأخرى مثل السرطان الغدي، وهو النوع الذي يؤثر بشكل أساسي على غير المدخنين، يبدو أن خطر الرادون أقل.[145][146]
تظهر دراسة الإشعاع من العلاج الإشعاعي بعد استئصال الثدي أن النماذج البسيطة المستخدمة سابقًا لتقييم المخاطر المشتركة والمنفصلة عن الإشعاع والتدخين بحاجة إلى التطوير.[147] يتم دعم ذلك أيضًا من خلال مناقشة جديدة حول طريقة الحساب، نموذج عدم العتبة الخطي، والذي تم استخدامه بشكل روتيني.[148]
أظهرت دراسة من عام 2001، شملت 436 من غير المدخنين ومجموعة ضابطة من 1649 من غير المدخنين، أن التعرض لغاز الرادون يزيد من خطر الإصابة بسرطان الرئة لدى غير المدخنين. يبدو أن المجموعة التي تعرضت لدخان التبغ في المنزل معرضة لخطر أكبر بكثير، في حين أن أولئك الذين لم يتعرضوا للتدخين السلبي لم يظهروا أي خطر متزايد مع زيادة التعرض لغاز الرادون.[149]
ابتلاع
[عدل]آثار الرادون في حالة ابتلاعه غير معروفة، على الرغم من أن الدراسات وجدت أن نصف العمر البيولوجي له يتراوح من 30 إلى 70 دقيقة، مع إزالة 90٪ في 100 دقيقة. في عام 1999، قام المجلس القومي الأمريكي للبحوث بالتحقيق في مسألة غاز الرادون في مياه الشرب. تم اعتبار المخاطر المرتبطة بالابتلاع تكاد لا تذكر.[150] قد تحتوي المياه من المصادر الجوفية على كميات كبيرة من الرادون اعتمادًا على الصخور المحيطة وظروف التربة، بينما لا تحتوي المصادر السطحية عمومًا.[151]
تأثيرات المحيط من غاز الرادون
[عدل]يحمل سطح المحيط فقط حوالي 10 ^ -4 226 Ra، حيث بلغت قياسات تركيز 222 Ra 1٪ في قارات مختلفة.[152] الأهمية الرئيسية لفهم 222 تدفقات Ra من المحيط، هي معرفة أن زيادة استخدام الرادون تنتشر وتتزايد أيضًا في الغلاف الجوي. يتم تبادل تركيزات سطح المحيط داخل الغلاف الجوي، مما يؤدي إلى زيادة 222 غاز الرادون عبر السطح البيني الجوي-البحري.[152] على الرغم من أن المناطق التي تم اختبارها كانت ضحلة جدًا، إلا أن القياسات الإضافية في مجموعة متنوعة من الأنظمة الساحلية يجب أن تساعد في تحديد طبيعة 222 رادونًا تمت ملاحظته.[152] بالإضافة إلى تناوله من خلال مياه الشرب، يتم إطلاق غاز الرادون أيضًا من الماء عند ارتفاع درجة الحرارة وانخفاض الضغط وتهوية الماء. حدثت الظروف المثلى لإطلاق غاز الرادون والتعرض أثناء الاستحمام. ماء بتركيز رادون 10 4 يمكن أن تزيد pCi / L من تركيز الرادون الداخلي بنسبة 1 pCi / L في ظل الظروف العادية.[75]
الاختبار والتخفيف
[عدل]توجد اختبارات بسيطة نسبيًا لغاز الرادون. في بعض البلدان يتم إجراء هذه الاختبارات بشكل منهجي في مناطق ذات مخاطر نظامية معروفة. أجهزة الكشف عن الرادون متوفرة تجارياً. توفر أجهزة الكشف عن الرادون الرقمية قياسات مستمرة تعطي قراءات يومية وأسبوعية وقصيرة المدى وطويلة المدى عبر شاشة رقمية. أجهزة اختبار الرادون قصيرة المدى المستخدمة لأغراض الفحص الأولي غير مكلفة، وفي بعض الحالات تكون مجانية. هناك بروتوكولات مهمة لإجراء اختبارات الرادون على المدى القصير ومن الضروري اتباعها بدقة. تتضمن المجموعة أداة تجميع يقوم المستخدم بتعليقها في أدنى أرضية صالحة للسكن في المنزل لمدة يومين إلى سبعة أيام. ثم يرسل المستخدم المجمع إلى المختبر لتحليله. تتوفر أيضًا مجموعات طويلة الأجل، والتي تأخذ مجموعات تصل إلى عام واحد أو أكثر. يمكن لمجموعة اختبار الأرض المفتوحة اختبار انبعاثات الرادون من الأرض قبل بدء البناء.[5] يمكن أن تختلف تركيزات الرادون يوميًا، وتتطلب تقديرات التعرض الدقيقة للرادون قياسات الرادون على المدى الطويل في المساحات التي يقضي فيها الفرد قدرًا كبيرًا من الوقت.[153]


تتقلب مستويات الرادون بشكل طبيعي، بسبب عوامل مثل الظروف الجوية العابرة، لذلك قد لا يكون الاختبار الأولي تقييمًا دقيقًا لمتوسط مستوى الرادون في المنزل. تكون مستويات الرادون في أقصى حد لها خلال أبرد جزء من اليوم عندما تكون فروق الضغط أكبر.[75] لذلك، نتيجة عالية (فوق 4pCi / L) يبرر إعادة الاختبار قبل تنفيذ مشاريع تخفيف أكثر تكلفة. القياسات بين 4 و 10 تضمن pCi / L اختبار الرادون طويل المدى. القياسات أكثر من 10 لا تضمن pCi / L سوى اختبار قصير المدى آخر حتى لا تتأخر إجراءات المكافحة دون مبرر. يُنصح مشترو العقارات بتأخير أو رفض الشراء إذا لم ينجح البائع في تخفيف غاز الرادون إلى 4pCi / L أو أقل.[5]
نظرًا لأن عمر النصف لغاز الرادون هو 3.8 أيام فقط، فإن إزالة أو عزل المصدر سيقلل بشكل كبير من المخاطر في غضون أسابيع قليلة. طريقة أخرى لتقليل مستويات الرادون هي تعديل تهوية المبنى. بشكل عام، تزداد تركيزات الرادون الداخلية مع انخفاض معدلات التهوية.[2] في مكان جيد التهوية، يميل تركيز الرادون إلى التوافق مع القيم الخارجية (عادةً 10 بيكريل / م 3، تتراوح من 1 إلى 100 بكريل / م 3).[5]
الطرق الأربعة الرئيسية لتقليل كمية غاز الرادون المتراكم في المنزل هي:[5][154]
- إزالة الضغط من الطبقة السفلية (شفط التربة) عن طريق زيادة التهوية تحت الأرضية.
- تحسين تهوية المنزل وتجنب نقل غاز الرادون من الطابق السفلي إلى غرف المعيشة.
- تركيب نظام حوض الرادون في القبو.
- ترآيب نظام تهوية بالضغط الإيجابي أو الإمداد الإيجابي.
وفقًا لوكالة حماية البيئة، [5] طريقة تقليل غاز الرادون «... تستخدم بشكل أساسي في نظام أنابيب التهوية والمروحة، التي تسحب الرادون من أسفل المنزل وتخرجه إلى الخارج»، وهو ما يسمى أيضًا بخفض ضغط الألواح الفرعية، إزالة ضغط التربة النشطة، أو شفط التربة. يمكن التخفيف من غاز الرادون الداخلي عمومًا عن طريق إزالة الضغط من الألواح السفلية واستنفاد هذا الهواء المحمل بغاز الرادون إلى الخارج بعيدًا عن النوافذ وفتحات المباني الأخرى. «[] توصي وكالة حماية البيئة عمومًا بالطرق التي تمنع دخول غاز الرادون. يمنع شفط التربة، على سبيل المثال، الرادون من دخول منزلك عن طريق سحب الرادون من أسفل المنزل وتنفيسه عبر أنبوب، أو أنابيب، إلى الهواء فوق المنزل حيث يتم تخفيفه بسرعة» و«لا توصي وكالة حماية البيئة استخدام الختم وحده لتقليل غاز الرادون لأنه، في حد ذاته، لم يُظهر السداد أنه يخفض مستويات الرادون بشكل كبير أو ثابت».[155]
يمكن دمج أنظمة التهوية بالضغط الإيجابي مع مبادل حراري لاستعادة الطاقة في عملية تبادل الهواء مع الخارج، وببساطة، فإن استنفاد هواء الطابق السفلي إلى الخارج ليس بالضرورة حلاً قابلاً للتطبيق لأن هذا يمكن أن يسحب غاز الرادون إلى المسكن. قد تستفيد المنازل المبنية على مساحة الزحف من مجمع الرادون المثبت تحت «حاجز الرادون» (قطعة من البلاستيك تغطي مساحة الزحف).[5][156] بالنسبة لمساحات الزحف، تنص وكالة حماية البيئة على أن «الطريقة الفعالة لتقليل مستويات الرادون في المنازل الفضائية الزاحفة تتضمن تغطية أرضية الأرض بغطاء بلاستيكي عالي الكثافة. يتم استخدام أنبوب تهوية ومروحة لسحب الرادون من أسفل اللوح وتنفيسه إلى الخارج. يُطلق على هذا الشكل من أشكال شفط التربة اسم الشفط تحت الغشاء، وعندما يتم تطبيقه بشكل صحيح فهو الطريقة الأكثر فعالية لتقليل مستويات الرادون في المنازل الفضائية الزحف.» [155]
استخدامات عامة للرادون
[عدل]طبيا
[عدل]في أوائل القرن العشرين استخدم لعلاج الأمراض بحيث يعرض المرضى للإشعاع في غرف صغيرة قبل اكتشاف آثاره المسرطنة.
قد اقترحت فكرة التعرض للرادون وتسمى بهرمون الإشعاع والتي تهدف لعلاج أمراض المناعة الذاتية مثل التهاب المفاصل وقد جذبت الناس اليها رغم آثارها الضارة.
يستخدم لعلاج بعض أنواع السرطان.
علميا
[عدل]يمكن استخدامه لتوقع الزلازل رغم رفضه كمصدر موثوق.
قد استخدم في التصوير الشعاعي لكنه استبدل بالأشعة السينية لأنه أقل تكلفة وأقل خطرا.
انظر أيضًا
[عدل]- مشروع الرادون الدولي.
- خلية لوكاس.
- هالة متعددة الألوان (تُعرف أيضًا باسم راديوهالو).
- قانون تعويض التعرض للإشعاع.
مراجع
[عدل]- ^ Samet، J. M. (1992). "Indoor radon and lung cancer. Estimating the risks". The Western journal of medicine. ج. 156 ع. 1: 25–9. PMC:1003141. PMID:1734594.
- ^ ا ب ج د ه و ز ح Toxicological profile for radon نسخة محفوظة 2016-04-15 على موقع واي باك مشين., Agency for Toxic Substances and Disease Registry, U.S. Public Health Service, In collaboration with U.S. Environmental Protection Agency, December 1990.
- ^ ا ب Kusky، Timothy M. (2003). Geological Hazards: A Sourcebook. Greenwood Press. ص. 236–239. ISBN:9781573564694. مؤرشف من الأصل في 2021-12-26.
- ^ "Facts about Radon". Facts about. مؤرشف من الأصل في 2005-02-22. اطلع عليه بتاريخ 2008-09-07.
- ^ ا ب ج د ه و ز ح ط "A Citizen's Guide to Radon". www.epa.gov. وكالة حماية البيئة الأمريكية. 12 أكتوبر 2010. مؤرشف من الأصل في 2021-12-11. اطلع عليه بتاريخ 2012-01-29.
- ^ Dobrzynski، Ludwik؛ Fornalski، Krzysztof W.؛ Reszczyńska، Joanna (23 نوفمبر 2017). "Meta-analysis of thirty-two case–control and two ecological radon studies of lung cancer". Journal of Radiation Research. ج. 59 ع. 2: 149–163. DOI:10.1093/jrr/rrx061. PMID:29186473.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Public Health Fact Sheet on Radon — Health and Human Services". Mass.Gov. مؤرشف من الأصل في 2011-11-21. اطلع عليه بتاريخ 2011-12-04.
- ^ ا ب "A Citizen's Guide to Radon: The Guide to Protecting Yourself and Your Family from Radon". Epa.gov. 2016. مؤرشف من الأصل في 2021-12-24.
- ^ Williams، David R. (19 أبريل 2007). "Earth Fact Sheet". ناسا. مؤرشف من الأصل في 2021-12-24. اطلع عليه بتاريخ 2008-06-26.
- ^ "Radon". Jefferson Lab. مؤرشف من الأصل في 2021-12-17. اطلع عليه بتاريخ 2008-06-26.
- ^ Thomas، Jens (2002). Noble Gases. Marshall Cavendish. ص. 13. ISBN:978-0-7614-1462-9. مؤرشف من الأصل في 2021-12-26.
- ^ Gerrard، W (1979). Solubility Data Series (PDF) (ط. Vol.2). Pergamon Press. ص. 264–271. مؤرشف من الأصل (PDF) في 2021-11-06.
- ^ Battino، R (1979). Solubility Data Series (PDF) (ط. Vol.2). Pergamon Press. ص. 227–234. مؤرشف من الأصل (PDF) في 2021-11-06.
- ^ Saito، M (1999). "Determination of Radon Solubilities to 1,2-Dimethylbenzene, 1,3- Dimethylbenzene, 1,4-Dime thylbenzene, 1,3,5-Trimethylbenzene, 1, 2,4-Trimethylbenzene and 1-Isopropyl-4-methylbenzene". Nippon Kagaku Kaishi ع. 6: 363–368. DOI:10.1246/nikkashi.1999.363. مؤرشف من الأصل في 2021-12-26.
- ^ ا ب Keller، Cornelius؛ Wolf، Walter؛ Shani، Jashovam (2005)، "Radionuclides, 2. Radioactive Elements and Artificial Radionuclides"، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش، DOI:10.1002/14356007.o22_o15
- ^ Bader، Richard F. W. "An Introduction to the Electronic Structure of Atoms and Molecules". جامعة ماكماستر. مؤرشف من الأصل في 2021-12-17. اطلع عليه بتاريخ 2008-06-26.
- ^ David R. Lide (2003). "Section 10, Atomic, Molecular, and Optical Physics; Ionization Potentials of Atoms and Atomic Ions". CRC Handbook of Chemistry and Physics (ط. 84th). Boca Raton, Florida: CRC Press.
- ^ Avrorin, V. V.؛ Krasikova، R. N.؛ Nefedov، V. D.؛ Toropova، M. A. (1982). "The Chemistry of Radon". Russian Chemical Reviews. ج. 51 ع. 1: 12. Bibcode:1982RuCRv..51...12A. DOI:10.1070/RC1982v051n01ABEH002787.
- ^ Stein, L. (1970). "Ionic Radon Solution". ساينس. ج. 168 ع. 3929: 362–4. Bibcode:1970Sci...168..362S. DOI:10.1126/science.168.3929.362. PMID:17809133.
- ^ Pitzer, Kenneth S. (1975). "Fluorides of radon and element 118". Chemical Communications. ج. 44 ع. 18: 760–761. DOI:10.1039/C3975000760b. مؤرشف من الأصل في 2021-12-08.
- ^ ا ب ج د ه و ز ح Stein، Lawrence (1983). "The Chemistry of Radon". Radiochimica Acta. ج. 32 ع. 1–3: 163–171. DOI:10.1524/ract.1983.32.13.163.
- ^ Meng-Sheng Liao؛ Qian-Er Zhang (1998). "Chemical Bonding in XeF2, XeF4, KrF2, KrF4, RnF2, XeCl2, and XeBr2: From the Gas Phase to the Solid State". The Journal of Physical Chemistry A. ج. 102 ع. 52: 10647. Bibcode:1998JPCA..10210647L. DOI:10.1021/jp9825516.
- ^ Filatov, Michael؛ Cremer، Dieter (2003). "Bonding in radon hexafluoride: An unusual relativistic problem?". Physical Chemistry Chemical Physics. ج. 5 ع. 6: 1103. Bibcode:2003PCCP....5.1103F. DOI:10.1039/b212460m.
- ^ Holloway, J. (1986). "Noble-gas fluorides". Journal of Fluorine Chemistry. ج. 33 ع. 1–4: 149. DOI:10.1016/S0022-1139(00)85275-6.
- ^ Avrorin, V. V.؛ Krasikova, R. N.؛ Nefedov, V. D.؛ Toropova, M. A. (1982). "The Chemistry of Radon". Russian Chemical Reviews. ج. 51 ع. 1: 12. Bibcode:1982RuCRv..51...12A. DOI:10.1070/RC1982v051n01ABEH002787.
- ^ ا ب ج د Sykes، A. G. (1998). "Recent Advances in Noble-Gas Chemistry". Advances in Inorganic Chemistry. Academic Press. ج. 46. ص. 91–93. ISBN:978-0120236466. اطلع عليه بتاريخ 2012-11-02.
- ^ ا ب ج Thayer، John S. (2010). "Relativistic Effects and the Chemistry of the Heavier Main Group Elements". Relativistic Methods for Chemists. Challenges and Advances in Computational Chemistry and Physics. ج. 10. ص. 80. DOI:10.1007/978-1-4020-9975-5_2. ISBN:978-1-4020-9974-8.
- ^ Liebman، Joel F. (1975). "Conceptual Problems in Noble Gas and Fluorine Chemistry, II: The Nonexistence of Radon Tetrafluoride". Inorg. Nucl. Chem. Lett. ج. 11 ع. 10: 683–685. DOI:10.1016/0020-1650(75)80185-1.
- ^ Seppelt، Konrad (2015). "Molecular Hexafluorides". Chemical Reviews. ج. 115 ع. 2: 1296–1306. DOI:10.1021/cr5001783. PMID:25418862.
- ^ Malli, Gulzari L. (2002). "Prediction of the existence of radon carbonyl: RnCO". International Journal of Quantum Chemistry. ج. 90 ع. 2: 611. DOI:10.1002/qua.963.
- ^ Runeberg, Nino؛ Pyykkö، Pekka (1998). "Relativistic pseudopotential calculations on Xe2, RnXe, and Rn2: The van der Waals properties of radon". International Journal of Quantum Chemistry. ج. 66 ع. 2: 131. DOI:10.1002/(SICI)1097-461X(1998)66:2<131::AID-QUA4>3.0.CO;2-W.
- ^ Browne، Malcolm W. (5 مارس 1993). "Chemists Find Way to Make An 'Impossible' Compound". The New York Times. مؤرشف من الأصل في 2021-12-17. اطلع عليه بتاريخ 2009-01-30.
- ^ Dolg, M.; Küchle, W.; Stoll, H.; Preuss, H.; Schwerdtfeger, P. (20 Dec 1991). "Ab initio pseudopotentials for Hg to Rn: II. Molecular calculations on the hydrides of Hg to At and the fluorides of Rn". Molecular Physics (بالإنجليزية). 74 (6): 1265–1285. Bibcode:1991MolPh..74.1265D. DOI:10.1080/00268979100102951. ISSN:0026-8976.
- ^ Bratsch، Steven G. (29 يوليو 1988). "Standard Electrode Potentials and Temperature Coefficients in Water at 298.15 K". Journal of Physical and Chemical Reference Data. ج. 18 ع. 1: 1–21. Bibcode:1989JPCRD..18....1B. DOI:10.1063/1.555839. مؤرشف من الأصل في 2021-12-26.
- ^ ا ب ج Sonzogni, Alejandro. "Interactive Chart of Nuclides". Brookhaven National Laboratory. مؤرشف من الأصل في 2021-11-18. اطلع عليه بتاريخ 2008-06-06.
- ^ Neidherr، D.؛ Audi، G.؛ Beck، D.؛ Baum، K.؛ Böhm، Ch.؛ Breitenfeldt، M.؛ Cakirli، R. B.؛ Casten، R. F.؛ George، S. (19 مارس 2009). "Discovery of 229Rn and the Structure of the Heaviest Rn and Ra Isotopes from Penning-Trap Mass Measurements" (PDF). Physical Review Letters. ج. 102 ع. 11: 112501–1–112501–5. Bibcode:2009PhRvL.102k2501N. DOI:10.1103/PhysRevLett.102.112501. PMID:19392194. مؤرشف من الأصل (PDF) في 2021-02-24.
- ^ "Principal Decay Scheme of the Uranium Series". Gulflink.osd.mil. مؤرشف من الأصل في 2008-10-25. اطلع عليه بتاريخ 2008-09-12.
- ^ "Why Measure RDPs?". مؤرشف من الأصل في 2015-02-25. اطلع عليه بتاريخ 2009-07-07.
- ^ ا ب ج "EPA Assessment of Risks from Radon in Homes" (PDF). Office of Radiation and Indoor Air, US Environmental Protection Agency. يونيو 2003. مؤرشف من الأصل (PDF) في 2008-02-27.
- ^ Health effects of exposure to radon, Volume 6 of BEIR (Series). National Academies Press. 1999. ص. 179. ISBN:978-0-309-05645-8. مؤرشف من الأصل في 2021-12-26.
- ^ ا ب Rutherford, E.؛ Owens, R. B. (1899). "Thorium and uranium radiation". Trans. R. Soc. Can. ج. 2: 9–12.
- ^ الرادون جامعة أم القرى، تاريخ الولوج 05 مايو 2011 نسخة محفوظة 30 ديسمبر 2009 على موقع واي باك مشين.
- ^ Partington, J. R. (1957). "Discovery of Radon". نيتشر. ج. 179 ع. 4566: 912. Bibcode:1957Natur.179..912P. DOI:10.1038/179912a0.
- ^ "Timeline of Element Discovery". شركة نيويورك تايمز. 2008. مؤرشف من الأصل في 2021-12-17. اطلع عليه بتاريخ 2008-02-28.
- ^ Schüttmann, W. (1988). "Zur Entdeckungsgeschichte des Radons". Isotopenpraxis Isotopes in Environmental and Health Studies (بالألمانية). 24 (4): 158. DOI:10.1080/10256018808623931.
- ^ Brenner، David J. (2000). "Rutherford, the Curies, and Radon". Medical Physics . ج. 27 ع. 3: 618. Bibcode:2000MedPh..27..618B. DOI:10.1118/1.598902. PMID:10757614.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Curie, P.; Curie, Mme. Marie (1899). "Sur la radioactivite provoquee par les rayons de Becquerel". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences (بالفرنسية). 129: 714–6.
- ^ Rutherford, E. (1900). "A radioactive substance emitted from thorium compounds". Phil. Mag. ج. 40 ع. 296: 1–4. DOI:10.1080/14786440009463821. مؤرشف من الأصل في 2021-12-17.
- ^ Dorn, Friedrich Ernst (1900). "Über die von radioaktiven Substanzen ausgesandte Emanation" (PDF). Abhandlungen der Naturforschenden Gesellschaft zu Halle (بالألمانية). Stuttgart. 22: 155. Archived from the original (PDF) on 2021-12-17.
- ^ Dorn, F. E. (1900). "Die von radioactiven Substanzen ausgesandte Emanation" (PDF). Abhandlungen der Naturforschenden Gesellschaft zu Halle (بالألمانية). 23: 1–15. Archived from the original (PDF) on 2021-12-17.
- ^ Rutherford, E.؛ Brooks, H. T. (1901). "The new gas from radium". Trans. R. Soc. Can. ج. 7: 21–25.
- ^ Giesel, Fritz (1903). "Über den Emanationskörper aus Pechblende und über Radium". Chemische Berichte (بالألمانية). 36: 342. DOI:10.1002/cber.19030360177. Archived from the original on 2021-05-30.
- ^ Debierne, André-Louis (1903). "Sur la radioactivite induite provoquee par les sels d'actinium". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences (بالفرنسية). 136: 446. Archived from the original on 2021-12-17.
- ^ ا ب Ramsay, Sir William؛ Collie, J. Norman (1904). "The Spectrum of the Radium Emanation". وقائع الجمعية الملكية. ج. 73 ع. 488–496: 470–476. DOI:10.1098/rspl.1904.0064.
- ^ Schmidt, Curt (1918). "Periodisches System und Genesis der Elemente". Zeitschrift für anorganische und allgemeine Chemie (بالألمانية). 103: 79–118. DOI:10.1002/zaac.19181030106. Archived from the original on 2021-03-08.
- ^ Perrin, Jean (1919). "Matière et lumière. Essai de synthèse de la mécanique chimique". Annales de Physique. IX (بالفرنسية). 11: 5–108. DOI:10.1051/anphys/191909110005. Archived from the original on 2021-12-26.
- ^ Adams, Elliot Quincy (1920). "The Independent Origin of Actinium". Journal of the American Chemical Society. ج. 42 ع. 11: 2205. DOI:10.1021/ja01456a010. مؤرشف من الأصل في 2021-12-26.
- ^ "Poster Issued by the New York Department of Health (ca. 1981)". Oak Ridge Associated Universities. 11 أكتوبر 2021. مؤرشف من الأصل في 2021-12-18. اطلع عليه بتاريخ 2021-10-11.
- ^ "Rings and Cancer". Time. 13 سبتمبر 1968. مؤرشف من الأصل في 2009-05-22. اطلع عليه بتاريخ 2009-05-05.
- ^ R. W. Gray؛ W. Ramsay (1909). "Some Physical Properties of Radium Emanation". J. Chem. Soc. Trans. ج. 1909: 1073–1085. DOI:10.1039/CT9099501073. مؤرشف من الأصل في 2021-12-26.
- ^ Ramsay, W.; Gray, R. W. (1910). "La densité de l'emanation du radium". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences (بالفرنسية). 151: 126–128. Archived from the original on 2021-12-17.
- ^ ا ب Thornton، Brett F.؛ Burdette، Shawn C. (22 أغسطس 2013). "Recalling radon's recognition". Nature Chemistry. ج. 5 ع. 9: 804. Bibcode:2013NatCh...5..804T. DOI:10.1038/nchem.1731. PMID:23965684.
- ^ Grosse, A. V. (1965). "Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em)". Journal of Inorganic and Nuclear Chemistry. ج. 27 ع. 3: 509. DOI:10.1016/0022-1902(65)80255-X.
- ^ Fields, Paul R.؛ Stein, Lawrence؛ Zirin, Moshe H. (1962). "Radon Fluoride". J. Am. Chem. Soc. ج. 84 ع. 21: 4164. DOI:10.1021/ja00880a048.
- ^ Masse, Roland (2002) Le radon, aspects historiques et perception du risque. radon-france.com.
- ^ Radon Toxicity: Who is at Risk?, Agency for Toxic Substances and Disease Registry, 2000.
- ^ Proctor, Robert N. The Nazi War on Cancer.
- ^ Edelstein, Michael R., William J. Makofske.
- ^ Samet، J. M. (1992). "Indoor radon and lung cancer. Estimating the risks". The Western Journal of Medicine. ج. 156 ع. 1: 25–9. PMID:1734594.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Yamamoto, M.؛ Sakaguchi، A.؛ Sasaki، K.؛ Hirose، K.؛ Igarashi، Y.؛ Kim، C. (2006). "Radon". Journal of Environmental Radioactivity. ج. 86 ع. 1: 110–31. DOI:10.1016/j.jenvrad.2005.08.001. PMID:16181712.
- ^ ا ب "Radiation Protection: Radon". وكالة حماية البيئة الأمريكية. نوفمبر 2007. مؤرشف من الأصل في 2021-04-08. اطلع عليه بتاريخ 2008-04-17.
- ^ Radon (Rn).
- ^ "Health hazard data" (PDF). The Linde Group. مؤرشف من الأصل (PDF) في 2013-06-25.
- ^ "Le Radon. Un gaz radioactif naturel" (بالفرنسية). Archived from the original on 2021-12-17. Retrieved 2009-07-07.
- ^ ا ب ج Godish, Thad (2001). Indoor Environmental Quality. CRC Press. ISBN:978-1-56670-402-1.
- ^ Harley, J. H. in Richard Edward Stanley؛ A. Alan Moghissi (1975). Noble Gases. U.S. Environmental Protection Agency. ص. 111. مؤرشف من الأصل في 2021-12-26.
- ^ Sperrin, Malcolm؛ Gillmore, Gavin؛ Denman, Tony (2001). "Radon concentration variations in a Mendip cave cluster". Environmental Management and Health. ج. 12 ع. 5: 476. DOI:10.1108/09566160110404881. مؤرشف من الأصل في 2021-02-25.
- ^ ا ب ج Zdrojewicz, Zygmunt؛ Strzelczyk، Jadwiga (Jodi) (2006). "Radon Treatment Controversy, Dose Response". Dose-Response. ج. 4 ع. 2: 106–18. DOI:10.2203/dose-response.05-025.Zdrojewicz. PMID:18648641.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Steck, Daniel J.؛ Field, R. William؛ Lynch, Charles F. (1999). "Exposure to Atmospheric Radon". آفاق الصحة البيئية. ج. 107 ع. 2: 123–127. DOI:10.2307/3434368. JSTOR:3434368. PMID:9924007.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Field, R. William. "Radon Occurrence and Health Risk" (PDF). Department of Occupational and Environmental Health, University of Iowa. مؤرشف من الأصل (PDF) في 2006-03-16. اطلع عليه بتاريخ 2008-02-02.
- ^ "The Clinical Principles Of Balneology & Physical Medicine". مؤرشف من الأصل في 2008-05-08. اطلع عليه بتاريخ 2009-07-07.
- ^ "The Geology of Radon". United States Geological Survey. مؤرشف من الأصل في 2008-05-09. اطلع عليه بتاريخ 2008-06-28.
- ^ "Radon-222 as a tracer in groundwater-surface water interactions". Lancaster University. مؤرشف من الأصل (PDF) في 2021-11-26. اطلع عليه بتاريخ 2008-06-28.
- ^ Lawson، S.؛ Feldman، W.؛ Lawrence، D.؛ Moore، K.؛ Elphic، R.؛ Belian، R. (2005). "Recent outgassing from the lunar surface: the Lunar Prospector alpha particle spectrometer". مجلة البحوث الجيوفيزيائية. ج. 110: 1029. Bibcode:2005JGRE..11009009L. DOI:10.1029/2005JE002433.
- ^ ا ب "Potential for Elevated Radiation Levels In Propane" (PDF). National Energy Board. أبريل 1994. مؤرشف من الأصل (PDF) في 2021-03-12. اطلع عليه بتاريخ 2009-07-07.
- ^ Roaf, Susan؛ Fuentes, Manuel؛ Thomas, Stephanie (2007). Ecohouse: A Design Guide. Elsevier. ص. 159. ISBN:978-0-7506-6903-0.
- ^ Numerous references, see, for instance, Analysis And Modelling Of Indoor Radon Distributions Using Extreme Values Theory or Indoor Radon in Hungary (Lognormal Mysticism) for a discussion. نسخة محفوظة 2018-12-15 على موقع واي باك مشين.
- ^ "Data Collection and Statistical Computations". مؤرشف من الأصل في 2021-12-17. اطلع عليه بتاريخ 2009-07-07.
- ^ "Annex E: Sources to effects assessment for radon in homes and workplaces" (PDF)، Report of the United Nations Scientific Committee on the Effects of Atomic Radiation (2006)، United Nations، ج. 2، ص. 209–210، 2008، مؤرشف من الأصل (PDF) في 2021-12-17، اطلع عليه بتاريخ 2013-08-17
- ^ Price، Phillip N.؛ Nero، A.؛ Revzan، K.؛ Apte، M.؛ Gelman، A.؛ Boscardin، W. John. "Predicted County Median Concentration". Lawrence Berkeley National Laboratory. مؤرشف من الأصل في 2007-12-31. اطلع عليه بتاريخ 2008-02-12.
- ^ Field, R. William. "The Iowa Radon Lung Cancer Study". Department of Occupational and Environmental Health, University of Iowa. مؤرشف من الأصل في 1997-07-11. اطلع عليه بتاريخ 2008-02-22.
- ^ "Record radon levels found at Mallow office". RTE.ie (بالإنجليزية). 20 Sep 2007. Archived from the original on 2021-11-02. Retrieved 2018-09-09.
- ^ Featherstone, Sarah (10 Mar 2021). "Dangers Of Radon Gas - Test & Guide For Landlords 2021" (بالإنجليزية البريطانية). Archived from the original on 2021-05-16. Retrieved 2021-05-16.
- ^ "Radon Production". Rn-radon.info. 24 يوليو 2007. مؤرشف من الأصل في 2008-10-28. اطلع عليه بتاريخ 2009-01-30.
- ^ The Mining Safety and Health Act – 30 CFR 57.0. United States Government. 1977. مؤرشف من الأصل في 2014-08-05. اطلع عليه بتاريخ 2014-07-30.
- ^ ا ب
{{استشهاد بمنشورات مؤتمر}}: استشهاد فارغ! (مساعدة) - ^ Upfal، Mark J.؛ Johnson، Christine (2003). "65 Residential Radon" (PDF). في Greenberg، Michael I.؛ Hamilton، Richard J.؛ Phillips، Scott D.؛ N. N.، Gayla J. (المحررون). Occupational, industrial, and environmental toxicology (ط. 2nd). St. Louis, Missouri: Mosby. ISBN:9780323013406. مؤرشف من الأصل (PDF) في 2013-05-14. اطلع عليه بتاريخ 2012-11-28.
- ^ Toxicological Profile for Radon, Table 4-2 (Keith S., Doyle J. R., Harper C., et al. نسخة محفوظة 2021-12-17 على موقع واي باك مشين.
- ^ The Clinique, Volume 34. Illinois Homeopathic Medical Association. 1913. مؤرشف من الأصل في 2021-12-26. اطلع عليه بتاريخ 2011-06-30.
- ^ ا ب "Radon seeds". مؤرشف من الأصل في 2021-09-13. اطلع عليه بتاريخ 2009-05-05.
- ^ "Radon Health Mines: Boulder and Basin, Montana". Roadside America. مؤرشف من الأصل في 2021-10-27. اطلع عليه بتاريخ 2007-12-04.
- ^ ا ب Neda, T.؛ Szakács، A.؛ Mócsy، I.؛ Cosma، C. (2008). "Radon concentration levels in dry CO2 emanations from Harghita Băi, Romania, used for curative purposes". Journal of Radioanalytical and Nuclear Chemistry. ج. 277 ع. 3: 685. DOI:10.1007/s10967-007-7169-0.
- ^ Salak، Kara؛ Nordeman، Landon (2004). "59631: Mining for Miracles". ناشونال جيوغرافيك. مؤرشف من الأصل في 2021-11-18. اطلع عليه بتاريخ 2008-06-26.
- ^ "Jáchymov". Petros. مؤرشف من الأصل في 2002-01-07. اطلع عليه بتاريخ 2008-06-26.
- ^ Richon, P.؛ Y. Klinger؛ P. Tapponnier؛ C.-X. Li؛ J. Van Der Woerd؛ F. Perrier (2010). "Measuring radon flux across active faults: Relevance of excavating and possibility of satellite discharges" (PDF). Radiat. Meas. ج. 45 ع. 2: 211–218. Bibcode:2010RadM...45..211R. DOI:10.1016/j.radmeas.2010.01.019. مؤرشف من الأصل (PDF) في 2013-06-26. اطلع عليه بتاريخ 2011-08-20.
- ^ Igarashi, G.؛ Wakita, H. (1995). "Geochemical and hydrological observations for earthquake prediction in Japan". Journal of Physics of the Earth. ج. 43 ع. 5: 585–598. DOI:10.4294/jpe1952.43.585. مؤرشف من الأصل في 2021-12-17.
- ^ Wakita, H., (1996).
- ^ ا ب Richon, P.؛ Sabroux, J.-C.؛ Halbwachs, M.؛ Vandemeulebrouck, J.؛ Poussielgue, N.؛ Tabbagh, J.؛ Punongbayan, R. (2003). "Radon anomaly in the soil of Taal volcano, the Philippines: A likely precursor of the M 7.1 Mindoro earthquake (1994)". Geophysical Research Letters. ج. 30 ع. 9: 34. Bibcode:2003GeoRL..30.1481R. DOI:10.1029/2003GL016902.
- ^ Cothern، C.Richard (1987). Environmental Radon. ج. 35. ISBN:978-0-306-42707-7. مؤرشف من الأصل في 2021-10-04.
{{استشهاد بكتاب}}:|عمل=تُجوهل (مساعدة) - ^ "Expert: Earthquakes Hard To Predict". NPR.org. مؤرشف من الأصل في 2021-12-17. اطلع عليه بتاريخ 2009-05-05.
- ^ "EARTH Magazine: Earthquake prediction: Gone and back again". 5 يناير 2012. مؤرشف من الأصل في 2021-10-04.
- ^ "Radon and Naturally Occurring Radioactive Materials (NORM) associated with Hot Rock Geothermal Systems" (PDF). Government of South Australia—Primary Industries and Resources SA. مؤرشف من الأصل (PDF) في 2012-04-02. اطلع عليه بتاريخ 2013-07-16.
- ^ Dawson, J. A. T. (1946). "Radon. Its Properties and Preparation for Industrial Radiography". Journal of Scientific Instruments. ج. 23 ع. 7: 138. Bibcode:1946JScI...23..138D. DOI:10.1088/0950-7671/23/7/301.
- ^ Morrison، A. (1945). "Use of radon for industrial radiography". Canadian Journal of Research. ج. 23f ع. 6: 413–419. DOI:10.1139/cjr45f-044. PMID:21010538.
- ^ "Known and Probable Carcinogens". جمعية السرطان الأمريكية. مؤرشف من الأصل في 2003-12-13. اطلع عليه بتاريخ 2008-06-26.
- ^ Mould, Richard Francis (1993). A Century of X-rays and Radioactivity in Medicine. CRC Press. ISBN:978-0-7503-0224-1.
- ^ "Uranium Miners' Cancer". Time. 26 ديسمبر 1960. ISSN:0040-781X. مؤرشف من الأصل في 2009-01-15. اطلع عليه بتاريخ 2008-06-26.
- ^ Tirmarche M.؛ Laurier D.؛ Mitton N.؛ Gelas J. M. "Lung Cancer Risk Associated with Low Chronic Radon Exposure: Results from the French Uranium Miners Cohort and the European Project" (PDF). مؤرشف من الأصل (PDF) في 2021-12-19. اطلع عليه بتاريخ 2009-07-07.
- ^ Roscoe، R. J.؛ Steenland، K.؛ Halperin، W. E.؛ Beaumont، J. J.؛ Waxweiler، R. J. (4 أغسطس 1989). "Lung cancer mortality among nonsmoking uranium miners exposed to radon daughters". دورية الجمعية الطبية الأمريكية. ج. 262 ع. 5: 629–633. DOI:10.1001/jama.1989.03430050045024. PMID:2746814.
- ^ Woodward، Alistair؛ Roder، David؛ McMichael، Anthony J.؛ Crouch، Philip؛ Mylvaganam، Arul (1 يوليو 1991). "Radon Daughter Exposures at the Radium Hill Uranium Mine and Lung Cancer Rates among Former Workers, 1952–87". Cancer Causes & Control. ج. 2 ع. 4: 213–220. DOI:10.1007/BF00052136. JSTOR:3553403. PMID:1873450.
- ^ "Uranium mine radon gas proves health danger (1952)". The Salt Lake Tribune. 27 سبتمبر 1952. ص. 13. مؤرشف من الأصل في 2021-06-07. اطلع عليه بتاريخ 2015-12-22.
- ^ "Radon gas mine health benefits advertisement (1953)". Greeley Daily Tribune. 27 مارس 1953. ص. 4. مؤرشف من الأصل في 2021-12-17. اطلع عليه بتاريخ 2015-12-22.
- ^ "Clipping from The Montana Standard". Newspapers.com. مؤرشف من الأصل في 2021-12-17. اطلع عليه بتاريخ 2015-12-22.
- ^ "Government bans Boulder mine ads about radon health benefits (1975)". Newspapers.com. مؤرشف من الأصل في 2021-12-17. اطلع عليه بتاريخ 2015-12-22.
- ^ ا ب ج Darby, S.؛ Hill, D.؛ Doll, R. (2005). "Radon: a likely carcinogen at all exposures". Annals of Oncology. ج. 12 ع. 10: 1341–1351. DOI:10.1023/A:1012518223463. PMID:11762803.
- ^ "UNSCEAR 2006 Report Vol. I". United Nations Scientific Committee on the Effects of Atomic Radiation UNSCEAR 2006 Report to the General Assembly, with scientific annexes. مؤرشف من الأصل في 2021-12-17.
- ^ Schläger, M.؛ Murtazaev, K.؛ Rakhmatuloev, B.؛ Zoriy, P.؛ Heuel-Fabianek, B. (2016). "Radon exhalation of the uranium tailings dump Digmai, Tajikistan" (PDF). Radiation and Applications. ج. 1: 222–228. DOI:10.21175/RadJ.2016.03.041. مؤرشف من الأصل (PDF) في 2021-02-26.
- ^ Rericha، V.؛ Kulich، M.؛ Rericha، R.؛ Shore، D. L.؛ Sandler، D. P. (2007). "Incidence of leukemia, lymphoma, and multiple myeloma in Czech uranium miners: a case-cohort study". آفاق الصحة البيئية. ج. 114 ع. 6: 818–822. DOI:10.1289/ehp.8476. PMID:16759978.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ ا ب ج Steck، D. J.؛ Field، R. W.؛ Lynch، C. F. (1999). "Exposure to atmospheric radon". Environmental Health Perspectives. ج. 107 ع. 2: 123–127. DOI:10.1289/ehp.99107123. PMID:9924007.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Žlahtni plin v Sloveniji vsako leto kriv za 120 smrti". www.24ur.com (بالسلوفينية). Archived from the original on 2021-11-05. Retrieved 2021-11-02.
- ^ Reducing Environmental Cancer Risk – What We Can Do Now.
- ^ Fornalski، K. W.؛ Adams, R.؛ Allison, W.؛ Corrice, L. E.؛ Cuttler, J. M.؛ Davey, Ch.؛ Dobrzyński, L.؛ Esposito, V. J.؛ Feinendegen, L. E. (2015). "The assumption of radon-induced cancer risk". Cancer Causes & Control. ج. 10 ع. 26: 1517–18. DOI:10.1007/s10552-015-0638-9. PMID:26223888.
- ^ Becker، K. (2003). "Health Effects of High Radon Environments in Central Europe: Another Test for the LNT Hypothesis?". Nonlinearity in Biology, Toxicology and Medicine. ج. 1 ع. 1: 3–35. DOI:10.1080/15401420390844447. PMID:19330110.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Cohen B. L. (1995). "Test of the linear-no threshold theory of radiation carcinogenesis for inhaled radon decay products" (PDF). Health Physics . ج. 68 ع. 2: 157–74. DOI:10.1097/00004032-199502000-00002. PMID:7814250. مؤرشف من الأصل (PDF) في 2021-10-11.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Thompson، Richard E.؛ Nelson، Donald F.؛ Popkin، Joel H.؛ Popkin، Zenaida (2008). "Case-Control Study of Lung Cancer Risk from Residential Radon Exposure in Worcester County, Massachusetts". Health Physics . ج. 94 ع. 3: 228–41. DOI:10.1097/01.HP.0000288561.53790.5f. PMID:18301096. مؤرشف من الأصل في 2020-04-23.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ "Slideshow: 10 Things You Never Knew Could Cause Lung Cancer". WebMD (بالإنجليزية). Archived from the original on 2021-01-29. Retrieved 2020-12-05.
- ^ Catelinois O.؛ Rogel A.؛ Laurier D.؛ Billon، Solenne؛ Hemon، Denis؛ Verger، Pierre؛ Tirmarche، Margot (2006). "Lung cancer attributable to indoor radon exposure in france: impact of the risk models and uncertainty analysis". آفاق الصحة البيئية. ج. 114 ع. 9: 1361–1366. DOI:10.1289/ehp.9070. PMID:16966089.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Stefanie Gierl, Oliver Meisenberg, Peter Feistenauer, Jochen Tschiersch: Thoron and thoron progeny measurements in German clay houses. نسخة محفوظة 2021-11-12 على موقع واي باك مشين.
- ^ WHO Handbook on Indoor Radon.


 French
French Deutsch
Deutsch



