1,2,4-Butantriol – Wikipedia
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
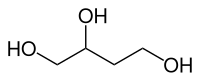 | |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 1,2,4-Butantriol | ||||||||||||||||||
| Andere Namen | 1,2,4-Trihydroxybutan | ||||||||||||||||||
| Summenformel | C4H10O3 | ||||||||||||||||||
| Kurzbeschreibung | gelbe Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 106,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig[1] | ||||||||||||||||||
| Dichte | 1,185 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 190–191 °C bei 24 hPa[1] | ||||||||||||||||||
| Löslichkeit | mischbar mit Wasser[1] | ||||||||||||||||||
| Brechungsindex | 1,473 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
1,2,4-Butantriol ist eine chemische Verbindung aus der Gruppe der Alkohole. Die Verbindung ist chiral mit zwei möglichen Enantiomeren.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]1,2,4-Butantriol kann durch Hydrierung von 1,4-Dihydroxy-2-butanon in Gegenwart eines Molybdänsulfid-Katalysators oder durch Reduktion von Äpfelsäure mit Borandimethylsulfid gewonnen werden.[3][4] Auch Synthesen mit Glycidol, 2-Buten-1,4-diol, 3,4-Dihydroxybutanoat oder -malat als Ausgangsstoffe sind bekannt. Die biotechnologische Herstellung erfolgt durch gentechnisch veränderte Escherichia-coli-Stämme aus Xylose, einem Hauptbestandteil der lignozellulosehaltigen Biomasse.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]1,2,4-Butantriol ist eine feuchtigkeitsempfindliche, sehr schwer entzündbare hygroskopische gelbe Flüssigkeit, die mischbar mit Wasser ist.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]1,2,4-Butantriol wird als Ausgangsstoff zur Synthese einer Reihe von quartären Ammoniumlipiden verwendet. Es wird auch bei der Synthese von (–)-γ-Amino-8-hydroxybuttersäure (GABOB), Antiepileptika und blutdrucksenkenden Arzneistoffen eingesetzt.[2] Außerdem wird es zur Herstellung von 3-Hydroxytetrahydrofuran genutzt.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Eintrag zu CAS-Nr. 3068-00-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2014. (JavaScript erforderlich)
- ↑ a b c Datenblatt (±)-1,2,4-Butanetriol, technical, ≥90% (GC) bei Sigma-Aldrich, abgerufen am 23. Juli 2014 (PDF).
- ↑ Industrial Alcohol Technology Handbook. ASIA PACIFIC BUSINESS PRESS Inc., 2010, ISBN 978-81-7833-143-0, S. 357.
- ↑ Murray Moo-Young: Comprehensive Biotechnology. Elsevier Science, 2011, ISBN 0-08-088504-7, S. 159 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Yujin Cao, Wei Niu, Jiantao Guo, Mo Xian, Huizhou Liu: Biotechnological production of 1,2,4-butanetriol: An efficient process to synthesize energetic material precursor from renewable biomass. In: Scientific Reports. Band 5, Nr. 1, 2015, S. 18149, doi:10.1038/srep18149, PMID 26670289.
- ↑ Vishnu K. Tandon, Albert M. van Leusen, Hans Wynberg: Synthesis of enantiomerically pure (S)-(+)-3-hydroxytetrahydrofuran, and its (R)-enantiomer, from malic or tartaric acid. In: The Journal of Organic Chemistry. Band 48, Nr. 16, 1. August 1983, S. 2767–2769, doi:10.1021/jo00164a027.


 French
French Deutsch
Deutsch