Berylliumnitrid – Wikipedia
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| _ Be2+ _ N3− | |||||||||||||
| Kristallsystem | kubisch | ||||||||||||
| Raumgruppe | Ia3 (Nr. 206) | ||||||||||||
| Gitterparameter | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Berylliumnitrid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Verhältnisformel | Be3N2 | ||||||||||||
| Kurzbeschreibung | weißer bis grauer Feststoff[2] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 55,05 g·mol−1 | ||||||||||||
| Aggregatzustand | fest[2] | ||||||||||||
| Dichte | 2,71 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Berylliumnitrid ist eine anorganische chemische Verbindung des Berylliums aus der Gruppe der Nitride.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Berylliumnitrid kann durch Reaktion von Beryllium mit Ammoniak bei 1100 °C gewonnen werden.[2]
Es kann auch aus den Elementen dargestellt werden bei Temperaturen zwischen 1100 °C und 1500 °C.[5]
Es entsteht auch bei der Verbrennung von Beryllium an Luft neben Berylliumoxid.[6]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Berylliumnitrid ist ein weißer bis grauer Feststoff, der sich in Wasser langsam, in Säuren und Basen schnell unter Ammoniakabgabe zersetzt.[2]
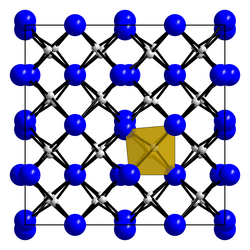
An Luft oxidiert er bei Temperaturen ab 600 °C.[2] Im Vakuum sublimiert er bei Temperaturen ab 2000 °C.[7] Die Verbindung kommt in zwei Modifikationen vor. α-Berylliumnitrid besitzt eine kubische Kristallstruktur vom Defekt-Anti-Bixbyit-Typ (a = 814,518 pm) mit der Raumgruppe Ia3 (Raumgruppen-Nr. 206) und β-Berylliumnitrid mit einer hexagonalen Kristallstruktur und der Raumgruppe P63/mmc (Nr. 194).[5] Die Tieftemperaturform α-Berylliumnitrid wandelt sich bei etwa 1450 °C in die Hochtemperaturform β-Berylliumnitrid um.[8] In α-Berylliumnitrid sind die Be-Atome tetraedrisch von vier N-Atomen umgeben, die N-Atome verzerrt oktaedrisch von sechs Be-Atomen.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Berylliumnitrid wird als feuerfeste Keramik und in Atomreaktoren verwendet.[5] Es wird auch zur nukleartechnischen Herstellung von C14 verwendet, der als Radiotracer oder als Radiopharmakon verwendet wird.[9]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ O. Reckeweg, C. Lind, A. Simon, F. J. DiSalvo: Rietveld Refinement of the crystal structure of alpha-(Be3N2) and the experimental determination of optical band gaps for Mg3N2, Ca3N2 and CaMg2N2. In: Zeitschrift für Naturforschung, B: Chemical Sciences, 2003, 58, S. 159–162.
- ↑ a b c d e f g Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 978-1-4398-1462-8, S. 64 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Berylliumverbindungen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. August 2021. (JavaScript erforderlich)
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Berylliumverbindungen, ausgenommen Beryllium-Tonerdesilikate, und ausgenommen die namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 23. August 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 978-0-444-59553-9, S. 201 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Riccardo Ferro, Adriana Saccone: Intermetallic Chemistry. Elsevier, 2008, ISBN 978-0-08-044099-6, S. 470 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Kenneth A. Walsh: Beryllium Chemistry and Processing. ASM International, 2009, ISBN 978-0-87170-721-5, S. 122 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. A. Wriedt, H. Okamoto: The Be-N (Beryllium-Nitrogen) system. In: Journal of Phase Equilibria. 8, 1987, S. 136–139, doi:10.1007/BF02873199.
- ↑ Graham Lappin, Simon Temple: Radiotracers in Drug Development. CRC Press, Boca Raton / London / New York 2006, ISBN 0-8493-3347-4, S. 33 (eingeschränkte Vorschau in der Google-Buchsuche).


 French
French Deutsch
Deutsch






