Bisoprolol – Wikipedia
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Strukturformel ohne Stereoisomerie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Bisoprolol | |||||||||||||||||||||
| Andere Namen | (RS)-1-[4-(2-Isopropoxyethoxymethyl)phenoxy]-3-isopropylamino-2-propanol (IUPAC) | |||||||||||||||||||||
| Summenformel | C18H31NO4 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | selektive Blockade von β1-Rezeptoren | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 325,45 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | Wasser: 2,24 g·l−1 (25 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Bisoprolol ist ein Arzneistoff aus der Gruppe der selektiven β1-Adrenorezeptorenblocker (kurz Betablocker). Es wird zur Behandlung des Bluthochdrucks, der Angina Pectoris, der chronischen Herzinsuffizienz und bei Tachykardien eingesetzt. Chemisch gesehen handelt es sich um einen Phenolether, siehe Formel.
Klinische Angaben
[Bearbeiten | Quelltext bearbeiten]Anwendungsgebiete (Indikationen)
[Bearbeiten | Quelltext bearbeiten]Bisoprolol wird zur Behandlung der arteriellen Hypertonie, der Angina Pectoris und der chronischen Herzinsuffizienz eingesetzt. Zur Verbesserung der Compliance und zur Vereinfachung der Therapie steht Bisoprolol in einer fixen Kombination mit dem Diuretikum Hydrochlorothiazid sowie dem Calciumantagonisten Amlodipin in ebenfalls abgestuften Wirkstärken zur Verfügung.
Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Das Medikament sollte nicht bei langsamen Herzrhythmusstörungen (Bradykardie), bei Benutzung von MAO-Hemmern, bei Hypotonie, bei schwerer Herzinsuffizienz mit beginnendem kardiogenem Schock und bei Diabetes mellitus eingenommen werden.
Bei Asthma bronchiale oder anderen chronisch obstruktiven Lungenfunktionsstörungen sollte das Medikament nur mit Vorsicht angewendet werden.
Unerwünschte Wirkungen (Nebenwirkungen)
[Bearbeiten | Quelltext bearbeiten]Bisoprolol kann zahlreiche Nebenwirkungen hervorrufen.[4] Mögliche Nebenwirkungen werden anhand ihrer Häufigkeit unterteilt.
- Häufige Nebenwirkungen: Blutdruckabfall, Senkung der Herzfrequenz (Bradykardie), Appetitlosigkeit, Übelkeit, Erbrechen, Durchblutungsstörungen, Müdigkeit, Kopfschmerzen, Verwirrtheit, Schwindel, verstärktes Schwitzen, Stimmungsschwankungen, Halluzinationen und Wahnvorstellungen, Schlafstörungen, Muskelkrämpfe und Bronchospasmus
- Gelegentliche Nebenwirkungen: Sehstörungen, trockene Augen und Bindehautentzündung
- Seltene Nebenwirkungen: Verstärkung einer Schuppenflechte, Störung der Libido und erektile Dysfunktion, Gelenkentzündungen, Haarausfall und Ohrensausen
Pharmakologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bisoprolol ist ein lang wirksamer β-Blocker, der bevorzugt an β1-Adrenorezeptoren bindet. Es wirkt am Herzen frequenzsenkend und negativ inotrop. Wegen seiner Lipophilie besitzt Bisoprolol auch zentralnervöse Wirkung. Wie Carvedilol zeigt es keine intrinsische sympathomimetische Aktivität (ISA).
Nach oraler Gabe wird der β-Blocker rasch bei einer Bioverfügbarkeit von etwa 90 % resorbiert. Die Aufnahme von Dosen im Bereich von 1 bis 10 mg führen nach rund 3 h zur maximalen Plasmakonzentration. Die Halbwertszeit beträgt 10 bis 11 h, wobei die Hälfte der Substanz unverändert renal, der Rest über Abbau in der Leber eliminiert wird.[5] Der Wirkstoff wird als Racemat eingesetzt, wobei die Enantiomeren von Wirkstoffen in der Regel unterschiedliche pharmakologische Eigenschaften und Wirkungen haben.[6]
Marktbedeutung
[Bearbeiten | Quelltext bearbeiten]Mit rund 515 Mio. DDD war Bisoprolol nach Metoprolol im Jahr 2007 der am zweithäufigsten eingesetzte β-Blocker in Deutschland. Insgesamt hat sich die Anzahl der verordneten Dosen (nach DDD) von Betablockern von 1998 bis 2007 fast verdreifacht.[7]
Synthese
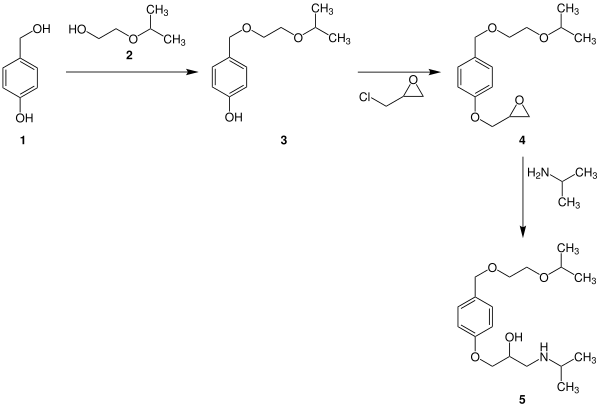
[Bearbeiten | Quelltext bearbeiten]Die Synthese von Bisoprolol kann in einer dreistufigen Reaktion erfolgen.
Im ersten Schritt kondensieren dabei die beiden Alkohole 1 und 2 unter Bildung des Ethers 3. Der zweite Schritt ist eine nucleophile Substitution, durch die das Oxiran 4 entsteht. Dieses reagiert dann im letzten Schritt der Reaktion – der Ringöffnung des Oxirans – mit Isopropylamin zu Bisoprolol (5):[8]
Stereoisomerie
[Bearbeiten | Quelltext bearbeiten]Die Verbindung ist chiral und wird als Racemat, d. h. als 1:1-Mischung der beiden Enantiomere verwendet. Das aktive Stereoisomer (Eutomer) ist die (S)-Form.[9] Die Tabelle zeigt beide Stereoisomere. Hierbei unterscheiden sie sich in der Position des Wasserstoffatoms, welches in dieser Darstellung entweder in die Zeichenebene hineingeht oder aus der Zeichenebene herausragt:
| Stereoisomere von Bisoprolol | |
| (S)-Enantiomer | (R)-Enantiomer |
 |  |
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Bilol (CH), Bisacardiol (A), Bisocor (A), Bisoprolol (B, D), Concor (D, A, CH), Concor COR (D, A), Rivacor (A), zahlreiche Generika (D, A, CH)
In Kombination mit Hydrochlorothiazid: Concor plus (D, CH), Bilol comp (CH), Lodoz (CH), Rivacor plus (A), Generika (D, A, CH);
In Kombination mit Amlodipin: Bisodipin (D)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Bisoprolol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Datenblatt Bisoprolol hemifumarate salt bei Sigma-Aldrich, abgerufen am 13. März 2011 (PDF).
- ↑ Eintrag zu Bisoprolol in der DrugBank der University of Alberta
- ↑ Eintrag zu Bisoprolol von Cora Health, abgerufen am 25. Juni 2018.
- ↑ Beate Blümer-Schwinum, Hermann Hager, Franz von Bruchhausen, E. Nürnberg, Peter Surmann: Hagers Handbuch der pharmazeutischen Praxis, Band 7, Stoffe A–D. 5. Auflage, Birkhäuser/Sprinter, 1995, ISBN 978-3-540-52688-9, S. 497–499.
- ↑ Ariëns, EJ. (1984): Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology. In: European Journal of Clinical Pharmacology. 26(2); 663–668; PMID 6092093.
- ↑ Dieter Paffrath, Ulrich Schwabe: Arzneiverordnungs-report 2008: Aktuelle Daten, Kosten, Trends und Kommentare. Springer, 2008, ISBN 978-3-540-69218-8, S. 439.
- ↑ Axel Kleemann; Jürgen Engel; Bernhard Kutscher; Dietmar Reichert: Pharmaceutical Substances – Syntheses, Patents and Applications of the most relevant APIs., 5. Auflage, Georg Thieme Verlag KG, 2009, ISBN 978-3-13-558405-8, S. 162–163.
- ↑ Joni Agustiana, Azlina Harun Kamaruddina, Subhash Bhatiaa: Single enantiomeric -blockers—The existing technologies, Process Biochemistry 45 (2010) 1587–1604, doi:10.1016/j.procbio.2010.06.022.


 French
French Deutsch
Deutsch