Blüte – Wikipedia


1. Blütenboden (Receptakulum)
2. Kelchblätter (Sepalen)
3. Kronblätter (Petalen)
4. Staubblätter (Stamina)
5. Fruchtblatt (hier: Stempel)
Die Blüte einer Pflanze ist ein nach Eintritt der Blühreife zu beobachtender unverzweigter Kurzspross mit begrenztem Wachstum, dessen Blätter indirekt oder direkt im Dienst der geschlechtlichen Fortpflanzung stehen: indirekt als Schutz- oder Anlockungsorgane (Blütenhülle), direkt durch die Bildung der Fortpflanzungsorgane (Staubblätter und Fruchtblätter).
Häufig wird unter Blüte nur die Blüte der Angiospermen verstanden, denn sie sind die Blütenpflanzen im engeren Sinne. Dennoch haben auch die Gymnospermen Blüten bzw. Blütenstände.
Eine Angiospermen-Blüte besteht aus folgenden Bestandteilen (die jedoch nicht alle vertreten sein müssen): die Blütenachse (Blütenboden), aus der die Blütenorgane entspringen: eine Blütenhülle (Perianth) als Perigon oder getrennt in eine Kelch- und Kronblatthülle, das Androeceum aus Staubblättern und das Gynoeceum aus Fruchtblättern. Die Staubblätter bilden den Pollen, der bei der Bestäubung auf die Narbe der Fruchtblätter gelangt, dort auskeimt und die im Fruchtblatt gelegenen Samenanlagen befruchtet, genauer die in der Samenanlage befindliche Eizelle (Befruchtung). Die befruchtete Eizelle entwickelt sich zum pflanzlichen Embryo, die Samenanlage entwickelt sich zum Samen und die gesamten verbleibenden Teile der Blüte werden zur Frucht.

Blüten, die nur Fruchtblätter enthalten, bezeichnet man umgangssprachlich als „weiblich“, solche, die nur Staubgefäße enthalten, als „männlich“ und Blüten, die sowohl Staubblätter als auch Fruchtblätter haben, als zweigeschlechtliche oder zwittrige Blüten (Siehe unten: Geschlechtigkeit).
Definitionen
[Bearbeiten | Quelltext bearbeiten]In der Antike und im Mittelalter war der Aufbau von Blüten, abgesehen vielleicht von Albertus Magnus, noch nicht näher beschrieben bzw. „durchschaut“ worden.[1][2] Die weit gefasste Definition von Blüte (von mittelhochdeutsch/althochdeutsch bluot mit dem Plural blüete[3]), wie sie häufig in der botanischen Fachliteratur vorkommt, schließt teilweise explizit[4][5] oder implizit[6][7] die Blüten der Nacktsamer mit ein. Nur selten wird durch Nennung der Teile in der Definition diese implizit auf die Angiospermen beschränkt.[8] Im Strasburger – Lehrbuch der Botanik wird in Bezug auf alle Samenpflanzen von deren Blüten gesprochen, wenn auch mit Einschränkungen: „Die Sporophylle stehen bei den Spermatophytina fast immer an Kurzsprossen mit begrenztem Wachstum. Solche […] Strukturen können als Blüten bezeichnet werden, auch wenn dieser Begriff meist nur für die primär zwittrigen Sporophyllstände der Angiospermen und möglicherweise eng verwandter fossiler Samenpflanzen verwendet wird.“[9] Auch das Lexikon der Biologie definiert die Blüte kurz als „ein Kurzsproß mit begrenztem Wachstum, der die Sporophylle trägt“.[10]
- Beispiel für einen weiblichen und einen männlichen Blütenstand eines Palmfarns
- Beispiel für einen weiblichen Blütenstand eines Gymnospermen (hier Legföhre)
- Weiblicher Blütenstand einer Waldkiefer in Vergrößerung
- Beispiel für einen männlichen Blütenstand eines Gymnospermen (hier Waldkiefer)
- Beispiel für eine Blüte der Eudikotyledonen mit Kelchblättern, Kronblättern, Stempel und Staubblättern (hier Wiesen-Storchschnabel)
- Beispiel für eine Blüte der Einkeimblättrigen mit Perigon, Stempel und Staubblättern (hier Feuer-Lilie)
- Beispiel für einen Blütenstand bei den Süßgräsern
Fossile Vertreter außerhalb der Samenpflanzen, die Blüten bildeten, sind die Bennettitales und Caytoniales. Der Definition der Blüte entsprechen zwar auch die Sporophyllstände der Bärlappe und Schachtelhalme,[11][4] diese werden hier aber nicht näher behandelt.
Im englischsprachigen Raum wird Blüte (botanisch: flower) meist enger als Angiospermen-Blüte definiert, z. B.: „verkürzte, zwittrig reproduktive Sprossachse mit begrenztem Wachstum, die aus Megasporangien (Fruchtblättern) und Mikrosporangien (Staubblättern) und einer sterilen Blütenhülle aus zumindest einem sterilen, flächigen Organ besteht.“[Fußnote 1][Fußnote 2]
Morphologie
[Bearbeiten | Quelltext bearbeiten]Die einzelnen Blütenorgane sind bei den Angiospermen innerhalb der Blüte in einer festgelegten Reihenfolge von unten nach oben, beziehungsweise, da die Blütenachse ja gestaucht ist, von außen nach innen angeordnet. In dieser Reihenfolge werden sie auch ontogenetisch (im Laufe der Blütenbildung) angelegt.
Blütenachse
[Bearbeiten | Quelltext bearbeiten]An der Blütenachse (Blütenboden oder Receptaculum) setzen die Blütenblätter an. Sie kann gestaucht, gestreckt und unterschiedlich geformt sein. Es können einzelne oder mehrere Wirtel durch interkalare Meristeme emporgehoben werden: Beispielsweise beim Kapernstrauch wird das Gynoeceum emporgehoben (Gynophor), bei den Passionsblumen stehen Gynoeceum und Androeceum erhaben (Androgynophor), und bei vielen Nelkengewächsen sind die Krone, das Androeceum das Gynoeceum emporgehoben (Anthophor).
Es können auch ringförmige Bereiche um das Zentrum herum emporgehoben werden. Ein Beispiel ist ein Stamen-Corollentubus, wie er bei vielen Korbblütlern typisch ist, oder der Kelch-Kronbecher vieler Kürbisgewächse. Eine verbreiterte Blütenachse heißt Blütenbecher (Hypanthium).
Werden alle Teile außer dem Fruchtknoten emporgehoben, entsteht eine Blütenröhre, welche die Blütenhülle und die Staubblätter trägt. Es entsteht ein perigyner Blütenbecher. Der Fruchtknoten wird dann als mittelständig bezeichnet. Ein oberständiger Fruchtknoten steht frei auf der Blütenachse. Wenn bei einem Blütenbecher die Außenseiten der Fruchtblätter miteinbezogen werden, entsteht ein unterständiger Fruchtknoten, das bedeutet er steht unterhalb der Blütenhülle so beispielsweise bei den Rosen.
Blütenhülle
[Bearbeiten | Quelltext bearbeiten]Die Blütenhülle (Perianth) sind sterile Blätter, die jedoch eindeutig zur Blüte gehören. Eine Blütenhülle wird nur von Gnetopsida und Angiospermen gebildet. Sind alle Blütenhüllblätter einheitlich gestaltet (homoiochlamydeisch), wird die Blütenhülle als Perigon oder einfaches Perianth bezeichnet, die Blätter als Tepalen (etwa bei der Tulpe). Dabei kann das Perigon aus einem Kreis (haplo- oder monochlamydeisch), zwei oder mehr Kreisen oder mehreren Schraubenumläufen bestehen; mehrfaches Perigon. Ein doppeltes Perianth (di-, heterochlamydeische Blüten) besteht aus ungleichartigen Blütenhüllblättern. Die äußeren, meist grünen sind die Kelchblätter (Sepalen) und bilden den Kelch (Calyx), die inneren, häufig auffallend gefärbten Blätter sind die Kronblätter (Petalen) und bilden die Krone (Corolla). Die evolutive Herkunft der Blütenhülle wird je nach Verwandtschaftsgruppe aus Hochblättern oder aus Staubblättern gedeutet.
Mikrosporophylle
[Bearbeiten | Quelltext bearbeiten]

Mikrosporophylle sind sporangientragende Blätter. In den Sporangien (Pollensäcken) werden die männlichen Mikrosporen gebildet. Die Mikrosporophylle sind je nach Samenpflanzengruppe sehr unterschiedlich ausgebildet, und eine Homologie zu den Blättern (φύλλον phýllon „Blatt“) ist nicht gänzlich geklärt. Neutraler könnten sie daher auch Mikrosporangienträger genannt werden. Beim Ginkgo ist das Mikrosporophyll ein Stiel, an dessen Spitze zwei Pollensäcke hängen; die Mikrosporophylle stehen zu vielen schraubig an der Blütenachse. Bei den Koniferen ist die männliche Blüte zapfenartig und besteht aus vielen meist schraubig angeordneten Mikrosporophyllen; an jedem Mikrosporophyll stehen zwei bis 20 Pollensäcke. Bei den Palmfarnen (Cycadeen) sind die Mikrosporophylle schuppenförmig und tragen fünf bis 1000 Pollensäcke; die Mikrosporophylle stehen in der männlichen Blüte schraubig. Bei der Welwitschie tragen die sechs miteinander verwachsenen Mikrosporophylle je drei Pollensäcke. Bei Gnetum trägt das einzige Mikrosporophyll ein oder zwei endständige Pollensäcke. Bei Ephedra ist das Mikrosporophyll häufig gegabelt und trägt zwei bis acht Gruppen von meist zwei verwachsenen Pollensäcken.
Die Mikrosporophylle der Angiospermen werden Staubblätter (Stamina) genannt. Ein Staubblatt ist meist in den Staubfaden (Filament) und den Staubbeutel (Anthere) gegliedert. Letzterer besteht aus zwei durch das Konnektiv verbundenen Theken zu je zwei Pollensäcken. Die Gesamtheit der Staubblätter wird Androeceum genannt. Die Anzahl der Staubblätter pro Blüte beträgt zwischen einem und rund 2000 Stück.
Megasporophylle
[Bearbeiten | Quelltext bearbeiten]


Die Megasporophylle tragen die für Samenpflanzen charakteristischen Samenanlagen, in deren Innerem die eigentlichen weiblichen Fortpflanzungsorgane liegen, welche die pflanzlichen Eizellen enthalten. Auch die Megasporophylle könnten neutraler als Megasporangienträger bezeichnet werden. Nur bei den Angiospermen heißen die Megasporophylle Fruchtblätter.
Bei den Palmfarnen stehen die Samenanlagen eindeutig auf Blättern, sie sind phyllospor. Das schuppen- oder schildförmige Megasporophyll ist deutlich gestielt und trägt am unteren Rand der Spreite zwei Samenanlagen, bei Cycas sind es bis zu acht Samenanlagen entlang der Rhachis. Bei den Koniferen befinden sich ein bis 20 Samenanlagen auf der Oberfläche einer flächig ausgebildeten Samenschuppe. Die Samenschuppe ist ein modifizierter Kurztrieb. Selten stehen die Samenanlagen bei Koniferen endständig an Kurztrieben, wie bei der Eibe (Taxus). Ginkgo bildet an der Spitze eines gegabelten Stieles zwei Samenanlagen. Die Gnetopsida bilden pro Blüte nur eine endständige Samenanlage.
Bei den Angiospermen sind die Samenanlagen in das Fruchtblatt (Karpell) eingeschlossen, daher auch der Name „Bedecktsamer“. Die Gesamtheit der Fruchtblätter bildet das Gynoeceum. Die Anzahl der Fruchtblätter pro Blüte liegt zwischen einem und rund 2000. Meist gliedert sich ein Fruchtblatt in eine Stielzone und eine Schlauchzone, der hohle Bereich, in dem die Samenanlagen liegen (auch Ovar genannt). Die Samenanlagen setzen an Plazenten an. Darüber schließt sich häufig ein Griffel an, an dem sich die Narbe befindet, die Empfängnisfläche für den Pollen. Die Narbe ist durch einen Transmissionskanal oder -gewebe mit den Samenanlagen verbunden. Die Fruchtblätter können frei sein (apokarpes oder chorikarpes Gynoeceum) oder miteinander verwachsen sein (coenokarp). Bei einem verwachsenen Gynoeceum spricht man von einem Stempel (Pistill). Sterile Blüten besitzen höchstens reduzierte Staub- und Fruchtblätter und haben häufig die Funktion eines Schauapparates.
Nektarien
[Bearbeiten | Quelltext bearbeiten]Nektarien sind Drüsen, die Nektar als Lockspeise für die Blütenbestäuber bilden. Dieser besteht meist aus einer Zuckerlösung, die auch Proteine, Aminosäuren und Vitamine enthalten kann. Seltener werden Öle gebildet (etwa beim Gilbweiderich, Lysimachia). Nektarien können von der Blütenhülle, den Staubblättern, dem Fruchtknoten, der Blütenachse, aber auch außerhalb der eigentlichen Blüte (extrafloral) gebildet werden.
Stellung und Anordnung
[Bearbeiten | Quelltext bearbeiten]Die Blütenblätter können je nach Blattstellung (Phyllotaxis) an der Blütenachse schraubig (azyklisch) oder wirtelig (zyklisch) angeordnet sein. Eine schraubige Anordnung wird vielfach als primitives Merkmal angesehen und sie ist häufig mit einer höheren Anzahl an Blütenblättern verbunden. Der Winkel zwischen zwei aufeinanderfolgenden Blättern ist meist nahe dem des Goldenen Schnitts von rund 137,5°.
Häufig ist auch nur ein Teil der Blütenblätter schraubig, während die inneren Blütenblätter wirtelig angeordnet sind. Diese Blüten werden als spirozyklisch oder hemizyklisch bezeichnet. Ein Übergang von schraubig zu wirtelig entsteht dadurch, dass wie bei der Yulan-Magnolie (Magnolia denudata) nach jeweils drei Blättern eine Pause in der Blattbildung eintritt, so dass in Annäherung dreizählige Wirtel entstehen. Auch bei vielen wirteligen Blüten ist in der Entwicklung eine schraubige Reihenfolge der Blattbildung zu erkennen, die Blätter eines Kreises stehen jedoch so eng beisammen, dass ein Wirtel entsteht.
Bei der wirteligen Stellung steht in jedem Wirtel oder Kreis nur eine Art von Blütenblättern. Mit der wirteligen Stellung geht auch eine Reduktion der Anzahl der Blütenblätter einher (oligomere Kreise). Die meisten wirteligen Zwitterblüten besitzen vier (tetrazyklische Blüte) oder fünf (pentazyklisch) Wirtel: ein Kelchblatt-, ein Kronblatt-, ein oder zwei Staubblatt- und ein Fruchtblatt-Wirtel. Bei den meisten Angiospermen ist auch die Zahl der Blätter pro Wirtel fixiert, man spricht dann dementsprechend von zwei-, drei-, vier- oder fünfzähligen Blüten. Besitzen alle Kreise die gleiche Anzahl an Gliedern, ist die Blüte isomer (etwa bei der Tulpe), ist dies nicht der Fall, ist die Blüte heteromer.
Die Blätter übereinander stehender Wirtel stehen meist auf Lücke (Alternanzprinzip), das heißt die Glieder des nächstinneren Wirtels stehen in der Lücke zwischen zwei Gliedern des vorhergehenden Wirtels. Bei pentazyklischen Blüten tritt häufig der Fall auf, dass der innere Staubblattkreis durch den Fruchtknoten nach außen gedrängt wird und so scheinbar zum äußeren wird. Dieses Phänomen heißt Obdiplostemonie. Alle Blütenblätter können mit ihresgleichen oder auch mit anderen mehr oder weniger verwachsen sein.
Können durch eine Blüte mehr als drei Symmetrieebenen gelegt werden, so ist sie radiärsymmetrisch (wie die Tulpe). Bei zwei Symmetrieebenen ist sie disymmetrisch, etwa bei Dicentra. Eine Symmetrieebene haben zygomorphe (dorsiventrale) Blüten. Meist liegt diese Symmetrieebene in der Medianebene der Blüte (verläuft also durch Tragblatt und Sprossachse des Tragblattes), wie bei den Lippenblütlern, seltener senkrecht zur Medianebene, etwa beim Lerchensporn. Asymmetrische Blüten besitzen keine Symmetrieebene. Streng genommen zählen auch schraubige Blüten hierzu, die jedoch meist als radiärsymmetrisch angesehen werden.
Die Verhältnisse der Blütenteile zueinander können in Blütendiagrammen grafisch oder in Blütenformeln dargestellt werden.
Häufig sind mehrere oder viele Einzelblüten zu Blütenständen vereinigt.
Geschlechtigkeit
[Bearbeiten | Quelltext bearbeiten]Die für die Angiospermen ursprüngliche Form sind zwittrige Blüten. Daneben gibt es eingeschlechtige Blüten („getrenntgeschlechtig“), die Organe des anderen Geschlechts sind als Rudimente meist ebenfalls vorhanden: Es gibt staminate („männliche“) und pistillate („weibliche“) Blüten. Pflanzen und Sippen mit eingeschlechtigen Blüten können einhäusig (monözisch, männliche und weibliche Blüten an einer Pflanze) oder zweihäusig (diözisch, männliche und weibliche Blüten an verschiedenen Pflanzen) sein. Polygame Pflanzen besitzen sowohl zwittrige als auch eingeschlechtige Blüten.
Blüteninduktion
[Bearbeiten | Quelltext bearbeiten]Die Blüteninduktion ist die Umsteuerung der Pflanze bzw. des Meristems vom vegetativen Wachstum zur Blütenbildung. Auslöser können innere (endogene) oder äußere (exogene) Faktoren sein. Die Induktion ist irreversibel, kann also nicht rückgängig gemacht oder gestoppt werden. Es gibt vier wichtige Signalwege:
- Endogene oder autonome Auslöser sind vorhanden, aber ihrer Natur nach nicht näher bekannt. Bei vielen Arten ist jedoch ein bestimmtes Alter oder eine bestimmte Größe nötig, bevor sie blühen, etwa bei vielen Bäumen. Bei der Erbse ist der Blühzeitpunkt je nach Sorte genetisch fixiert. Spätblühende Ökotypen der Acker-Schmalwand (Arabidopsis thaliana) bilden ab einem bestimmten Alter autonom Blüten, wenn zuvor keine Induktion durch Umweltfaktoren erfolgte. Die Umschaltung auf Blütenbildung erfolgt durch eine Aktivierung von Heterochronie-Genen wie FCA (Flowering Control Arabidopsis).
- Bei den meisten Pflanzen wird der Blühzeitpunkt durch äußere Faktoren festgelegt. Die wichtigsten Faktoren sind dabei die Tageslänge und Kälteperioden (Vernalisation). Bei der Tageslänge werden Kurztagpflanzen und Langtagpflanzen unterschieden, die für die Blühinduktion bestimmte Tageslängen benötigen. Eine Rolle als Rezeptor spielt dabei das Phytochrom-System der Blätter, ebenso das Cryptochrom. Auch das Protein FKF1 dient als Photorezeptor und misst die Tageslänge. Diese Systeme beeinflussen das Constans-Gen (CO), dessen Exprimierung alleine schon ausreicht, die Blüteninduktion auszulösen. Als Signal von den Blättern an die Blüten wurde lange ein Blütenhormon Florigen postuliert, dessen Identität jedoch lange unbekannt blieb. Das Gen FT (siehe unten) ist ein Kandidat dafür, da es zwar in den Blättern transkribiert wird, aber in den Blütenmeristemen wirkt.[12][13]
- Besonders monokarpe Pflanzen (die nur einmal blühen) benötigen eine Vernalisation, eine längere Kälteperiode, um blühen zu können. Bekannte Gene, die bei Kälte aktiviert werden, sind Frigida (FRI) bei Arabidopsis und VRN1 und VRN2 im Winterweizen. Deren Genprodukte hemmen das Gen FLC, das seinerseits die Blütenbildung unterdrückt. In Summe wird also durch FRI oder VRN die Blütenbildung ermöglicht, wenn auch nicht ausgelöst. Es sind meist noch weitere Faktoren zur Auslösung nötig.
- Bestimmte Pflanzenhormone, wie etwa die Gibberelline, sind wichtig in der Blüh-Stimulation in der Abwesenheit von Langtagbedingungen, der Wirkmechanismus ist jedoch noch unbekannt.
Blütenbildung
[Bearbeiten | Quelltext bearbeiten]Nachdem durch die Heterochroniegene ein Meristem vom vegetativen in ein generatives Meristem umgewandelt wurde, erfolgt durch eine Vielzahl von interagierenden Regulator-Genen die eigentliche Blütenbildung.
Symmetriegene
[Bearbeiten | Quelltext bearbeiten]Sogenannte Symmetrie- oder Katastergene legen die Struktur der Blüte und ihre Symmetrieebenen fest sowie die Anzahl der Blüten und Blütenorgane. Mutationen dieser Gene verändern die Architektur der Blüte, die Gene werden vielfach nach den durch solche Mutationen veränderten Phänotypen benannt: Mutationen der Gene Cycloidea (CYC) oder Dichotoma (DICH) beim Löwenmäulchen erzeugen radiärsymmetrische Blüten anstelle der üblichen zygomorphen. Diese Mutationen treten auch natürlich auf und werden Pelorie genannt. Die Mutation des Gens Cauliflower (CAL) bei Arabidopsis und beim Brokkoli erzeugt viele Verzweigungen im Blütenstand ohne funktionsfähige Blüten. CAL hemmt das Gen TFL1, das die Verzweigung im Blütenstand fördert und ein Spross-Identitäts-Gen ist. tfl1-Mutanten bilden dementsprechend wenig- bis einblütige Blütenstände in Arabidopsis.
Blüten-Identitäts-Gene
[Bearbeiten | Quelltext bearbeiten]
Innerhalb des entstehenden, sich verzweigenden Blütenstandes werden Meristeme zu Blütenmeristemen, wenn die Gene Leafy (LFY) und Apetala1 (AP1) exprimiert werden. Beide codieren für Transkriptionsfaktoren und gehören zu einer Gruppe von Genen, die die Blühsignale integrieren. Die Funktionsweise dieser und der meisten anderen Gene wurde an Arabidopsis, dem Löwenmäulchen und Petunien-Hybriden gewonnen. Die wichtigsten Integrationsgene sind:
- FLC (Flowering Locus C) integriert die Signale der Vernalisation und die autonomen Signale. FLC ist ein Transkriptionsfaktor, seine Ausschaltung führt zu frühem Blühen. Die Menge an FLC-Protein/mRNA korreliert mit dem Blühzeitpunkt. FLC reprimiert den Blüh-Aktivator SOC1.
- SOC1 (Suppressor of Overexpression of Constans) wird durch Gibberelline und über CO durch Langtag aktiviert sowie durch FLC reprimiert. Aufhebung der Repression durch FLC reicht nicht für eine Aktivierung von SOC1 aus: Es muss eine Aktivierung durch CO oder Gibberelline erfolgen.
- LFY wird wie SOC1 durch Gibberelline sowie durch Langtag aktiviert. Letzteres geschieht über SOC1 oder über Agamous-Like24 (AGL24).
- FT (Flowering Locus T) wird durch Langtag über CO aktiviert, durch FLC unterdrückt. FT aktiviert wiederum AP1.
Die beiden letzten Gene in der Reihenfolge sind LFY und AP1, die sogenannten Blütenmeristem-Identitäts-Gene, die jedoch miteinander interagieren: AP1 wird durch LFY aktiviert; jedoch wird auch in Abwesenheit von LFY eine Blüte gebildet, allerdings nicht mit den richtigen Organen. Das bereits erwähnte TFL1 auf der einen und LFY und AP1 auf der anderen Seite reprimieren sich gegenseitig. TFL1 dient dazu, ein verfrühtes Blühen zu verhindern.
Festlegung der Blütenorgane
[Bearbeiten | Quelltext bearbeiten]
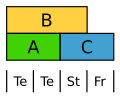
Ke Kelch, Kr Krone, St Staubblätter, Fr Fruchtknoten
Die Blütenorgane werden nach dem ABC-Modell festgelegt. Dies sind drei Genklassen, die durch die Interaktion die Identität der Blütenorgane definieren (Organidentitätsgene):
- A führt zu Kelchblättern
- A und B führt zu Kronblättern
- B und C führt zu Staubblättern
- C führt zu Fruchtblättern
A und C unterdrücken sich gegenseitig, sodass es zu keiner Überschneidung kommt. Bei Abwesenheit des einen wird die andere Klasse in der gesamten Blüte ausgebildet. Das ABC-Modell wurde 1991 von E. Coen und E. Meyerowitz[14] aufgestellt, wurde inzwischen vielfach bestätigt und erweitert.
In Arabidopsis sind bis jetzt folgende Gene bekannt:
- Klasse A: AP1 und AP2
- Klasse B: AP3 und Pistillata (PI)
- Klasse C: Agamous (AG)
Diese Gene werden in den Organen ständig exprimiert, die sie definieren, nicht nur am Beginn. AP1 ist also nicht nur ein Blütenmeristem-Gen, sondern auch ein Organidentitäts-Gen. In der frühen Phase der Blütenbildung wird es im ganzen Meristem gebildet, späterhin jedoch nur mehr in den Kreisen der Blütenhülle. Mutationen führen zum Wechsel der Organidentität. Bei Ausfall von A entwickeln sich statt Kelchblättern Fruchtblätter und statt Kronblättern Staubblätter (da jetzt C ausgebildet wird). Dreifachmutanten bilden nur normale Blätter. C-Mutanten besitzen kein begrenztes Wachstum, das Meristem wächst unbegrenzt weiter.
In Ergänzung wurde eine vierte Klasse entdeckt, E, die in Arabidopsis aus den vier Genen Sepallata1 bis 4 (SEP) besteht. Sie werden in Kron-, Staub- und Fruchtblättern exprimiert und sind sowohl für die Organidentität notwendig. Triple-Mutanten (sep1 bis 3) bilden nur Kelchblätter, Vierfach-Mutanten nur Laubblätter.[15]
Eine fünfte Klasse, D, besteht aus Genen, die für die Identität der Samenanlagen zuständig sind. In Petunia sind dies die Gene Floral Binding Protein (FBP) 7 und 11. Doppelmutanten bilden Fruchtblatt-ähnliche Strukturen anstelle der Samenanlagen. In Arabidopsis sind die entsprechenden Gene Seedstick (STK), Shatterproof1 (SHP1) und SHP2.
Der überwiegende Teil der Blütenorgan-Gene gehört zur Familie der MADS-Box-Gene. In Pflanzen haben MADS-Box-Gene eine beachtliche Verbreitung. Sie sind unter anderem in pflanzlichen homöotischen Genen zu finden (wie AGAMOUS und DEFICIENS), welche an der Herausbildung der pflanzlichen Organidentität beteiligt sind. Ein Beispiel hierfür ist die Festlegung der Blütenorgane. Die ABCE-Gene sind notwendig, aber auch hinreichend zu Ausbildung von Blütenorganen auch in vegetativen Organen. Dies konnte mit Hilfe ektopischer Expression der Gene gezeigt werden.
Wie die Blütenidentitätsgene, die ja im ganzen Blütenmeristem exprimiert werden, die Organidentitätsgene steuern, ist erst in Ansätzen aufgeklärt. Als erstes scheint das B-Klasse-Gen AP3 durch die Kombination von LFY, AP1 und dem Gen Unusual Flower Organs (UFO), exprimiert zu werden. LFY aktiviert mit einem weiteren Coaktivator, Wuschel (WUS), die Exprimierung von AG, dem C-Klasse-Gen. Nach der Aktivierung reprimiert AG wiederum WUS. Damit wird das Wachstum der Blütenachse begrenzt.
Einen weiteren Schritt im Verständnis hat das Quartett-Modell von Theißen 2001 gebracht. Es besagt, dass die Blütenorganisations-Proteine in Tetrameren (daher Quartett) wirken. Für jedes Organ gibt es demnach mindestens ein spezifisches Tetramer. Zumindest in Hefen konnte bereits gezeigt werden, dass die Proteine tatsächlich Tetramere bilden. Das Modell dient bereits vielen Arbeiten als Modellgrundlage.[15]
Vielfalt des ABC-Modells
[Bearbeiten | Quelltext bearbeiten]
Vergleichende Untersuchungen bei einer Reihe von Pflanzenarten haben ergeben, dass das ABC-Modell in der oben beschriebenen Form nur für die Eudikotylen gelten dürfte. Besonders bei den basalen Gruppen der Angiospermen gibt es verschiedene Ausprägungen. Bei Teichrosen (Nuphar) gibt es keine scharfen Grenzen der Genexpression (“fading borders”), sodass es eine Übergangsreihe von kelchähnlichen Tepalen über kronblattähnliche Tepalen zu Staminodien zu Staubblättern zu Fruchtblättern gibt.[15]
Die Tulpe bildet eine einheitliche Blütenhülle in zwei Kreisen aus. Hier werden in beiden Kreisen B-Klasse-Gene exprimiert.[15]
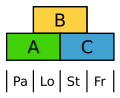
Die Blüten der Süßgräser sind sehr stark abgeleitet. Dennoch zeigen sie das ABC-Modell, wobei hier die Vorspelze (Palea) durch A und die Schwellkörper (Lodiculae) durch A und B gekennzeichnet sind, also homolog zu Kelch und Krone.[15]
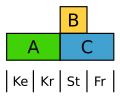
Der Ampfer (Rumex) bildet eine einheitliche, aber reduzierte und unauffällige Blütenhülle. Hier ist die B-Klasse auf die Staubblätter beschränkt, sodass beide Blütenhüllkreise nur durch A definiert werden.[15]
- Abgewandeltes ABC-Modell der Tulpe. Te Tepalen
- ABC-Modell beim Reis. Pa Vorspelze, Lo Schwellkörper
- Abgewandeltes ABC-Modell beim Ampfer
Inzwischen wird jedoch die Allgemeingültigkeit der A-Klasse als Blütenorganidentitätsgene angezweifelt. A-Klasse-Gene spielen, wie oben ausgeführt, auch eine Rolle bei der Festlegung der Blüten-Meristem-Identität. Nachgewiesen werden konnten sie in der Bildung der Blütenorgane bis jetzt nur bei Arabidopsis und sie dürften nur in der näheren Verwandtschaft von Bedeutung sein. Bei Antirrhinum reichen die BC-Gene zur Blütenbildung. Inwiefern dies für andere Angiospermen-Gruppen gilt, ist offen.[16]
Anthese
[Bearbeiten | Quelltext bearbeiten]Der Vorgang des Blühens wird als Anthese (von griechisch anthēsis „Blüte“) bezeichnet. Es ist der Entwicklungsabschnitt der Blütenorgane vom Ende des Knospenzustandes bzw. Beginn der Knospenentfaltung bis zum Beginn des Verblühens.
Blütenöffnung
[Bearbeiten | Quelltext bearbeiten]Vor dem Öffnen bildet die Blüte eine Knospe ähnlich den Überwinterungsknospen. Dabei dienen die Kelchblätter als Schutz. Die Blütenöffnung[17] gehört zu den Pflanzenbewegungen. Sie wurde etwa von Gabriel von Lebenstein in seinem im 14. Jahrhundert entstandenen Traktat Von den gebrannten Wässern erwähnt: „Das plumlein hat die tugent, wan die sund des morgens auf get, so thut es sich auf, und wen die sund unter get, so thut es sich czu.“[18][19] Die Öffnung der Blütenknospe kann durch verschiedene Mechanismen erfolgen:
- Reversible Akkumulation von Ionen. Dies wurde bis jetzt nur bei dem Kochschen Enzian (Gentiana acaulis) eindeutig nachgewiesen.
- Programmierter Zelltod in definierten Bereichen der Blütenblätter.
- Wasserverlust am Tag und Wiederauffüllen während der Nacht. Dies tritt etwa bei Silene saxifraga auf, die nachtblühend ist und deren Kronblätter sich am Tag infolge Wasserverlustes einrollen.
- Differenzielles Wachstum der Außen- und Innenseite der Blütenblätter. Bei der Tulpe hat die Innenseite der Blütenblätter ein um 10 °C niedrigeres Wachstumsoptimum als die Außenseite, was zu einem Öffnen am Morgen und dem Schließen am Abend führt.
Ein wichtiger Faktor für das Ausbreiten der Kronblätter ist die Erhöhung des Turgors, der meist durch eine Erhöhung der Zuckerkonzentration infolge Abbaus hochmolekularer Kohlenhydrate erfolgt (Stärke etwa bei Rosen, Fructane etwa bei Taglilien). Damit einher geht eine Expansion der Zellwand. Die Angaben über die Rolle von Pflanzenhormonen sind in der Literatur widersprüchlich.[Fußnote 3]
Das Öffnen der Blüten wird durch externe Faktoren ausgelöst. Bei nachtblühenden Arten ist häufig die erhöhte Luftfeuchtigkeit am Abend der Auslöser. Auf Temperaturerhöhung reagieren besonders Vorfrühlingsblüher, zum Beispiel das Schneeglöckchen (Galanthus nivalis) oder Krokusse (Crocus spp.). Eine dritte Gruppe reagiert auf Licht, wie das Gänseblümchen (Bellis perennis). Das Öffnen und Schließen langlebiger Blüten bei Tag beziehungsweise Nacht geschieht durch die gleichen Mechanismen und unterliegt einer endogenen Rhythmik. Die zellphysiologischen und besonders die genetischen Hintergründe der Blütenöffnung und -schließung sind bis jetzt kaum bekannt.
Das Schließen der Blüten kann durch differenzielles Wachstum oder durch reversible Turgoränderungen geschehen. In diesen Fällen ist ein wiederholtes Öffnen und Schließen möglich. Turgorverlust durch Seneszenz führt zur permanenten Schließung der Blüte.[Fußnote 4]
Bestäubung
[Bearbeiten | Quelltext bearbeiten]
Die Bestäubung ist das Übertragen des männlichen Pollens auf die weiblichen Empfängnisorgane: die Mikropyle bei den Gymnospermen, die Narben bei den Angiospermen. Die Bestäubung ist daher nicht mit der Befruchtung identisch. Die Bestäubung kann dabei mit dem Pollen desselben Individuums geschehen (Selbstbestäubung, Autogamie) oder mit dem Pollen eines anderen Individuums (Fremdbestäubung, Allogamie).
Selbstbestäubung reduziert jedoch die genetische Variabilität. Es gibt in Pflanzen verschiedene Anpassungen, um Selbstbestäubung oder Selbstbefruchtung zu vermeiden:
- Herkogamie ist die räumliche Trennung von Staubbeuteln und Narben, sodass eine Selbstbestäubung nicht möglich ist. Beim Kapernstrauch (Capparis spinosa) ist der ganze Stempel mittels Gynophor emporgehoben, sodass die Narbe über den Staubbeuteln in der Anflugbahn der bestäubenden Insekten steht.
- Dichogamie ist die zeitliche Trennung der Reife von Staubgefäßen bzw. Fruchtknoten. Dementsprechend gibt es vormännliche (Proterandrie) und vorweibliche Blüten (Proterogynie). Die gleichzeitige Reife nennt man Homogamie.
Dichogamie und Herkogamie können zwar die Bestäubung innerhalb einer Blüte verhindern, nicht jedoch von einer Blüte auf eine zweite derselben Pflanze (Geitonogamie). Daher haben viele Arten weitere Vermeidungsmechanismen entwickelt:


- Selbstinkompatibilität: Hierbei wird durch genetische Faktoren eine Selbstbefruchtung verhindert. Häufig sind solche Inkompatibilitätssysteme auch morphologisch erkennbar (Heteromorphie): Ein bekanntes Beispiel ist die Heterostylie der Primeln (Primula).
Es gibt je nach Art des Bestäubers drei große Anpassungs-Syndrome: Bestäubung durch Wind (Anemophilie), Wasser (Hydrophilie) und Tiere (Zoophilie). Die Gymnospermen sind primäre Windbestäuber, während die ersten Angiospermen wahrscheinlich primär tierbestäubt waren. Erst sekundär haben sich innerhalb der Angiospermen mehrfach Wind- und Wasserbestäubung entwickelt. Die wichtigsten Merkmale der einzelnen Syndrome sind:
- Anemophilie: unscheinbare Blüten; reduzierte Organzahl; Monözie oder Diözie häufig; dichte, oft hängende Infloreszenzen; wenig oder kein Pollenkitt; glatte Pollenoberfläche; Narben mit großer Oberfläche; eine oder wenige Samenanlagen pro Blüte; kein Nektar.
- Hydrophilie: unscheinbare Blüten; Monözie oder Diözie häufig; Auftreten von Luftgeweben; unbenetzbare Pollenwände; fadenförmige Pollenkörner; Narben mit großer Oberfläche; eine oder wenige Samenanlagen pro Blüte.
- Zoophilie: Bei den tierbestäubten Pflanzen steht nicht die Blüte als morphologische Einheit im Vordergrund, sondern die Blume (= Anthium) als funktionelle Einheit. Dabei entspricht oft die Blüte einer Blume (Tulpe), häufig sind jedoch viele Blüten zu einer Blume vereinigt, die dann Pseudanthium genannt wird. Beispiele sind alle Korbblütler (wie das Gänseblümchen) und die Doldenblütler (Karotte). Seltener ist der Fall, dass eine Blüte mehrere Blumen bildet (Meranthium), wie bei der Iris. Die wichtigsten Merkmale zoophiler Blumen sind: zwittrige Blüten oder Pseudanthien; Angiospermie; auffällige Farbe; starker Duft; Pollen oder Nektar als Nahrungsangebot, oder Täuscheinrichtungen; stark skulptierte Pollenoberfläche und viel Pollenkitt.
Befruchtung
[Bearbeiten | Quelltext bearbeiten]Bei den Nacktsamern gelangen die Pollenkörner auf die Mikropyle der Samenanlagen. Meist werden sie durch Eintrocknen des Bestäubungstropfens in die Pollenkammer gezogen. In der Pollenkammer werden je nach Sippe die Spermatozoiden freigegeben oder die Pollenschläuche keimen aus. Zwischen Bestäubung und Befruchtung können bis zu sechs Monate vergehen (einige Cycadeen).

Bei den Angiospermen gelangt das Pollenkorn auf die Narbe des Stempels. In einem speziellen Pollenschlauchleitgewebe durchwächst der Pollenschlauch den Griffel und gelangt so von der Narbe bis zu den Samenanlagen im Fruchtknoten. Gibt es im Griffel nur ein einheitliches Gewebe, sodass Pollenschläuche von der Narbe eines Fruchtblattes zu den Samenanlagen eines anderen Fruchtblattes gelangen können, nennt man die Gesamtheit des Leitgewebes Compitum.
Sind die Pollenschläuche bzw. Spermatozoiden bei den Eizellen angelangt, kommt es zur eigentlichen Befruchtung. Bei den Angiospermen, bei Gnetum und Ephedra gibt es eine doppelte Befruchtung: Bei den Angiospermen verschmilzt einer der beiden Spermakerne mit der Eizelle und bildet die Zygote. Der zweite verschmilzt mit dem bereits diploiden Embryosackkern zum triploiden Endospermkern, aus dem das Nährgewebe (Endosperm) der Samen entsteht. Bei Ephedra verschmilzt der zweite Spermakern mit der Bauchkanalzelle des Archegoniums, bei Gnetum verschmelzen die beiden Spermazellen mit zwei Gametophytenzellen. Von den jeweils entstehenden zwei Zygoten entwickelt sich meist nur eine.
Nach der Befruchtung entwickelt sich die Zygote zum Embryo, die Samenanlage zum Samen und die Blüte zur Frucht.
Seneszenz
[Bearbeiten | Quelltext bearbeiten]Die Blüten werden als Sexualorgane in den Pflanzen stets neu gebildet, im Gegensatz zu denen der Tiere. Die Lebensdauer ist genau abgemessen, da Blüten große Ressourcen verbrauchen und die Narbe auch ein wesentlicher Eintrittspunkt für Krankheitserreger ist. Bereits bestäubte Blüten würden auch unnötigerweise mit nicht bestäubten um Bestäuber konkurrieren.
Ein wichtiger Auslöser für Seneszenz (Alterung) ist die Bestäubung mit Pollen. Diese verkürzt in den meisten Arten die Lebensdauer der Blüte beträchtlich. In etlichen Pflanzen löst die Bestäubung die Bildung des Pflanzenhormons Ethylen aus, welches wiederum die Seneszenz der Kronblätter auslöst. Andere Arten sind jedoch unempfindlich gegen Ethylen, ihr Seneszenz-Mechanismus ist unbekannt. Auf Organ-Ebene sterben nach der Bestäubung Krone, Staubgefäße und der Griffel ab, während sich der Fruchtknoten zur Frucht weiterentwickelt. Das Absterben geht mit einer Remobilisierung der Inhaltsstoffe einher, ähnlich der Seneszenz der Blätter.[20]
Evolution
[Bearbeiten | Quelltext bearbeiten]Die Evolution der Angiospermen-Blüte ist nicht geklärt, da es kaum fossile Vorstufen der „modernen“ Angiospermenblüte gibt. Auch sind die Verwandtschaftsverhältnisse der Angiospermen zu den anderen Samenpflanzen noch unklar. Es gibt zwei unterschiedliche Hypothesen zu Entstehung der Blüten. Als Ursache für die Ausbildung der zwittrigen Angiospermenblüte nimmt man die Anpassung an die Bestäubung durch Insekten (Käfer) an, die Verlagerung der Samenanlagen in geschlossene Fruchtblätter wäre somit ein Schutz vor den Beißwerkzeugen der Käfer.
Die Euanthientheorie von Arber und Parkin (1907)[21] geht davon aus, dass die Vorfahren der Angiospermen bereits zwittrige Blüten hatten und daher die Angiospermenblüte ein einachsiges System mit seitlichen Mikro- und Megasporophyllen ist. Die Staub- und Fruchtblätter sind demnach den Blättern homolog. Diese Theorie beruht auf Analysen der fossilen Gattung Caytonia, die als möglicher Vorfahre der Angiospermen gilt. Caytonia hatte gefiederte Mikro- und Megasporophylle, die vielleicht in zwittrigen Blüten standen. Im Megasporophyll saßen Cupulae mit jeweils mehreren Samenanlagen seitlich an einer Rhachis. Auch die Mikrosporophylle waren gefiedert, jede Fieder trug mehrere Gruppen von verwachsenen Pollensäcken. Das Fruchtblatt der Angiospermen könnte durch ein Flächigwerden der Rhachis entstanden sein, das Staubblatt durch Reduktion auf einen Stiel mit zwei Synangien zu je zwei Pollensäcken.
Die Pseudanthientheorie von Richard Wettstein[22] nimmt an, dass die Angiospermenblüte aus einem Blütenstand eingeschlechtiger Blüten entstanden ist. Somit wären die Staubblätter und Karpelle Seitensprosse und nicht Blätter. Grundlage für diese Theorie ist die Annahme, dass die Angiospermen von den Gnetopsida abstammen. Das Karpell entstand demnach aus dem Tragblatt der Blüte, das zweite Integument der Samenanlage aus einer Braktee unterhalb der Blüte. Diese Theorie wird durch molekulare und morphologische Analysen kaum gestützt.
Obwohl die meisten Autoren inzwischen zur Euanthientheorie tendieren, ist die Entstehung von Staubblatt, Fruchtblatt und dem zweiten Integument der Samenanlagen weiterhin unklar.
Molekularbiologisch begründete Theorien
[Bearbeiten | Quelltext bearbeiten]Die ältesten Angiospermenblüten waren zwittrig und hatten ein undifferenziertes Perianth in Spiralstellung oder mehr als zwei Wirteln.[15]
Außerhalb der Samenpflanzen gibt es keine Blütenorgan-Identitätsgene oder Orthologe davon. In den Gymnospermen, die nur eingeschlechtige Blüten bilden, gibt es die Orthologe der Klasse B und C. Ihre Expression gleicht der in Angiospermen: C wird in allen reproduktiven Organen ausgebildet, B in den männlichen Blüten. Basierend auf diesen Erkenntnissen, wurden mehrere Hypothesen zur Entstehung der zwittrigen Angiospermen-Blüte aufgestellt:
- Nach der “out of male”-Hypothese von Theissen et al. 2002 bildeten die männlichen Blütenzapfen durch eine Reduktion der B-Klassen-Expression im oberen Zapfenbereich weibliche Organe. Nach der “out of female” Hypothese bildeten sich die männlichen Organe am unteren Ende der weiblichen Zapfen. Eine Blütenhülle entstand nach diesen beiden Modellen erst nach der Zwittrigkeit.[15]
- Ebenfalls von männlichen Blüten geht die “mostly male” Hypothese aus, zuerst vorgeschlagen von Frohlich und Parker 2000.[23] Sie entdeckten, dass es in Gymnospermen das Leafy-Gen in zwei Kopien vorkommt (Paraloge). Leafy spezifiziert männliche, Needly weibliche Blüten. Needly kommt in allen Gymnospermen außer Gnetum vor, aber nicht in Angiospermen. Die Theorie besagt nun, dass durch Deaktivierung des Needly-Gens die männlichen Zapfen zwittrig wurden.[24][15]
Die Evolution der Angiospermen-Blüte fand in vier Schlüsselereignissen statt:[24]
- Evolution der zwittrigen Blütenachse
- Evolution der gestauchten Blütenachse und die Begrenzung des Wachstums: Dies geschah durch C-Klasse-Gene, die Wuschel, das Meristem-Erhaltungsgen, unterdrücken.
- Evolution einer petaloiden Blütenhülle
- Evolution des klassischen zweikreisigen, zweiteiligen Perianths der Eudikotylen aus Kelch und Krone.
Soltis et al. (2007) diskutieren die Hypothese, dass an der Basis der Angiospermen nicht das ABC-Modell wie in Arabidopsis stand, sondern ein System mit unscharfen Grenzen wie bei der Teichrose. Von diesem Grundmodell können dann einfach durch verschiedene Grenzschärfungen das ABC-Modell wie auch die abgewandelte Formen wie bei der Tulpe entstanden sein.[16]
Nutzung durch den Menschen
[Bearbeiten | Quelltext bearbeiten]

Im Gegensatz zu den aus den Blüten hervorgehenden Früchten spielen Blüten als Nahrungspflanzen für den Menschen eine untergeordnete Rolle. Die Blütenstände von Blumenkohl und Artischocke dienen als Gemüse, die von Cannabis sativa subsp. indica als Rauschmittel. Einige Blüten bzw. Blütenstände werden als Salat bzw. dessen Dekoration verwendet (Veilchen, Gänseblümchen, Kapuzinerkresse). Blüten, Knospen, Blütenteile oder Blütenstände liefern Gewürze: Beifuß (Artemisia vulgaris subsp. vulgaris), Lavendel (Lavandula angustifolia), Gewürznelke (Syzygium aromaticum), Safran (Crocus sativus) und Hopfen (Humulus lupulus).[25] Viele Blüten werden zur Herstellung von Duftölen verwendet wie beispielsweise Lavendelöl und Rosenöl.
Eine wesentlich größere Rolle spielen Blüten jedoch als Schmuck in der Form von Zierpflanzen und Schnittblumen. Deutschland hat als weltgrößter Importeur von Schnittblumen im Jahr 2004 Waren im Großhandelswert von 1,1 Milliarden Euro importiert.[26] Der Weltmarkt für Schnittblumen und Topfpflanzen lag 2000 bei 6,8 Milliarden Euro.[27]
Die Göttin der Morgenröte (Aurora/Eos) streut Blumen als Sinnbild für die Lichtstrahlen des neuen Tages. Blumen sind auch das Attribut der Göttin Flora. Bei den vier Jahreszeiten werden die Blumen dem Frühling zugeordnet, bei den fünf Sinnen dem Geruchssinn. Blumen sind seit der Antike ein Zeichen der Vergänglichkeit von Schönheit und Leben. In den Stillleben erscheinen immer auch eine welke Blüte oder abgefallene Blütenblätter als Vanitas-Motiv. Allegorien der Logik wie der Hoffnung werden gelegentlich mit Blumen im Arm abgebildet, als Sinnbild, da aus der Blume sich bald eine Frucht entwickeln wird.[28] Einzelne Arten haben ihre eigenen symbolischen Bedeutungen, die sich jedoch im Lauf der Jahrhunderte ändern können, war und ist doch die Rose das Attribut von Venus, Dionysos und Maria, das Symbol für göttliche und irdische Liebe, für Jungfrauen aber auch für Prostitution.[29]
In der Bildenden Kunst sind Blüten und Blumen als florales Motiv ein häufig dargestelltes Thema, um vorrangig Frische und Freude auszudrücken.
Fußnoten
[Bearbeiten | Quelltext bearbeiten]- ↑ “a flower as a determinate, compressed, bisexual reproductive axis composed of megasporangia (carpels), microsporangia (stamens) and a sterile perianth composed of at least one sterile laminar organ”. G. Theißen, R. Melzer: Molecular Mechanisms Underlying Origin and Diversification of the Angiosperm Flower. In: Annals of Botany. Band 100, 2007, S. 603–619.
- ↑ sehr ähnlich auch die auf einem Literaturüberblick beruhende Definition in: Richard M. Bateman, Jason Hilton, Paula J. Rudall: Morphological and molecular phylogenetic context of the angiosperms: contrasting the 'top-down' and 'bottom-up' approaches used to infer the likely characteristics of the first flowers. In: Journal of Experimental Botany. Band 57, 2006, S. 3471–3503, doi:10.1093/jxb/erl128.
- ↑ siehe Review von Wouter G. van Doorn, Uulke van Meeteren: Flower opening and closure: a review. 2003.
- ↑ Der Abschnitt beruht auf: Wouter G. van Doorn, Uulke van Meeteren: Flower opening and closure: a review. 2003.
Quellen
[Bearbeiten | Quelltext bearbeiten]Der Artikel beruht hauptsächlich auf folgenden Quellen:
- Peter Leins, Claudia Erbar: Blüte und Frucht. Aspekte der Morphologie, Entwicklungsgeschichte, Phylogenie, Funktion und Ökologie. Schweizerbart, Stuttgart 2000, ISBN 3-510-65194-4.
- Peter Sitte, Elmar Weiler, Joachim W. Kadereit, Andreas Bresinsky, Christian Körner: Lehrbuch der Botanik für Hochschulen. Begründet von Eduard Strasburger. 35. Auflage. Spektrum Akademischer Verlag, Heidelberg 2002, ISBN 3-8274-1010-X.
Die Abschnitte Blüteninduktion und Blütenbildung beruhen auf:
- Peter Schopfer, Axel Brennicke: Pflanzenphysiologie. Begründet von Hans Mohr. 6. Auflage. Elsevier, Spektrum, München / Heidelberg 2006, ISBN 3-8274-1561-6, S. 501–523 (eingeschränkte Vorschau in der Google-Buchsuche).
- Thomas Jack: Molecular and Genetic Mechanisms of Floral Control. In: The Plant Cell. Band 16, Supplement 1, 2004, S. S1–S17, doi:10.1105/tpc.017038.
- Paul K. Boss, Ruth M. Bastow, Joshua S. Mylne, Caroline Dean: Multiple Pathways in the Decision to Flower: Enabling, Promoting, and Resetting. In: The Plant Cell. Band 16, Supplement 1, 2004, S. S18–S31, doi:10.1105/tpc.015958.
Weitere wichtige Literatur:
- Günter Theißen, Rainer Melzer: Molecular Mechanisms Underlying Origin and Diversification of the Angiosperm Flower. In: Annals of Botany. Band 100, Nr. 3, 2007, S. 603–619, doi:10.1093/aob/mcm143.
- Wouter G. van Doorn, Uulke van Meeteren: Flower opening and closure: a review. In: Journal of Experimental Botany. Band 54, Nr. 389, 2003, S. 1801–1812, doi:10.1093/jxb/erg213 (Abschnitt Blütenöffnung).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ O. Schonewille: Die Bedeutung von Goethes Versuch über die Metamorphose der Pflanzen für den Fortgang der botanischen Morphologie. In: Botanisches Archiv. Band 42, 1941, S. 421–460, hier: S. 436, 440 und öfter.
- ↑ Otto Beßler: Prinzipien der Drogenkunde im Mittelalter. Aussage und Inhalt des Circa instans und Mainzer Gart. Mathematisch-naturwissenschaftliche Habilitationsschrift, Halle an der Saale 1959, S. 58–61.
- ↑ Friedrich Kluge, Alfred Götze: Etymologisches Wörterbuch der deutschen Sprache. 20. Auflage. Hrsg. von Walther Mitzka. De Gruyter, Berlin/New York 1967; Neudruck („21. unveränderte Auflage“) ebenda 1975, ISBN 3-11-005709-3, S. 87.
- ↑ a b Gerhard Wagenitz: Wörterbuch der Botanik. Die Termini in ihrem historischen Zusammenhang. 2., erweiterte Auflage. Spektrum Akademischer Verlag, Heidelberg/Berlin 2003, ISBN 3-8274-1398-2, S. 47 f.
- ↑ Peter Schütt, Hans Joachim Schuck, Bernd Stimm (Hrsg.): Lexikon der Baum- und Straucharten. Das Standardwerk der Forstbotanik. Morphologie, Pathologie, Ökologie und Systematik wichtiger Baum- und Straucharten. Nikol, Hamburg 2002, ISBN 3-933203-53-8, S. 83 (Nachdruck von 1992).
- ↑ Manfred A. Fischer, Wolfgang Adler, Karl Oswald: Exkursionsflora für Österreich, Liechtenstein und Südtirol. 2., verbesserte und erweiterte Auflage. Land Oberösterreich, Biologiezentrum der Oberösterreichischen Landesmuseen, Linz 2005, ISBN 3-85474-140-5, S. 90.
- ↑ Rudolf Schubert, Klaus Werner, Hermann Meusel (Hrsg.): Exkursionsflora für die Gebiete der DDR und der BRD. Begründet von Werner Rothmaler. 13. Auflage. Band 2: Gefäßpflanzen. Volk und Wissen, Berlin (DDR) 1987, ISBN 3-06-012539-2, S. 24.
- ↑ Siegmund Seybold (Hrsg.): Schmeil-Fitschen interaktiv. CD-ROM, Version 1.1. Quelle & Meyer, Wiebelsheim 2002, ISBN 3-494-01327-6.
- ↑ Peter Sitte, Elmar Weiler, Joachim W. Kadereit, Andreas Bresinsky, Christian Körner: Lehrbuch der Botanik für Hochschulen. Begründet von Eduard Strasburger. 35. Auflage. Spektrum Akademischer Verlag, Heidelberg 2002, ISBN 3-8274-1010-X, S. 750.
- ↑ Herder-Lexikon der Biologie. CD-ROM. Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3-8274-0354-5, Stichwort „Blüte“.
- ↑ Peter Sitte, Elmar Weiler, Joachim W. Kadereit, Andreas Bresinsky, Christian Körner: Lehrbuch der Botanik für Hochschulen. Begründet von Eduard Strasburger. 35. Auflage. Spektrum Akademischer Verlag, Heidelberg 2002, ISBN 3-8274-1010-X, S. 720, 723.
- ↑ Katja E. Jaeger, Alexander Graf, Philip A. Wigge: The control of flowering in time and space. In: Journal of Experimental Botany. Band 57, Nr. 13, 2006, S. 3415–3418, doi:10.1093/jxb/erl159.
- ↑ Laurent Corbesier, George Coupland: The quest for florigen: a review of recent progress. In: Journal of Experimental Botany. Band 57, Nr. 13, 2006, S. 3395–3403, doi:10.1093/jxb/erl095.
- ↑ Enrico S. Coen, Elliott M. Meyerowitz: The war of the whorls: genetic interactions controlling flower development. In: Nature. Band 353, 1991, S. 31–37, doi:10.1038/353031a0.
- ↑ a b c d e f g h i Günter Theißen, Rainer Melzer: Molecular Mechanisms Underlying Origin and Diversification of the Angiosperm Flower. In: Annals of Botany. Band 100, Nr. 3, 2007, S. 603–619, doi:10.1093/aob/mcm143.
- ↑ a b Douglas E. Soltis, André S. Chanderbali, Sangtae Kim, Matyas Buzgo, Pamela S. Soltis: The ABC Model and its Applicability to Basal Angiosperms. In: Annals of Botany. Band 100, Nr. 2, 2007, S. 155–163, doi:10.1093/aob/mcm117.
- ↑ Video von sich öffnenden Blüten auf YouTube.
- ↑ Gerhard Eis (Hrsg.): Gabriel von Lebensteins Traktat „Von den gebrannten Wässern“. In: Sudhoffs Archiv. Band 35, 1942, S. 141–159, hier: S. 150.
- ↑ Otto Beßler: Prinzipien der Drogenkunde im Mittelalter. Aussage und Inhalt des Circa instans und Mainzer Gart. Mathematisch-naturwissenschaftliche Habilitationsschrift, Halle an der Saale 1959, S. 60 (zu Pflanzenbewegungen), Anm. 1.
- ↑ Hilary J. Rogers: Programmed Cell Death in Floral Organs: How and Why do Flowers Die? In: Annals of Botany. Band 97, Nr. 3, 2006, S. 309–315, doi:10.1093/aob/mcj051.
- ↑ E. A. Newell Arber, John Parkin: On the origin of the angiosperms. In: Journal of the Linnean Society of London, Botany. Band 38, Nr. 1, 1907, S. 29–80, doi:10.1111/j.1095-8339.1907.tb01074.x (Digitalisat).
- ↑ Richard Wettstein: Handbuch der Systematischen Botanik. Band 2, F. Deuticke, Wien 1907.
- ↑ Michael W. Frohlich, David S. Parker: The mostly male theory of flower evolutionary origins: from genes to fossils. In: Systematic Botany. Band 25, Nr. 2, 2000, S. 155–170, doi:10.2307/2666635 (PDF-Datei).
- ↑ a b Richard M. Bateman, Jason Hilton, Paula J. Rudall: Morphological and molecular phylogenetic context of the angiosperms: contrasting the 'top-down' and 'bottom-up' approaches used to infer the likely characteristics of the first flowers. In: Journal of Experimental Botany. Band 57, Nr. 13, 2006, S. 3471–3503, doi:10.1093/jxb/erl128.
- ↑ Wolfgang Franke: Nutzpflanzenkunde. Nutzbare Gewächse der gemäßigten Breiten, Subtropen und Tropen. 4., neubearbeitete und erweiterte Auflage. Thieme, Stuttgart / New York 1989, ISBN 3-13-530404-3.
- ↑ florist.de ( vom 5. November 2007 im Internet Archive)
- ↑ ianywhere.com, Mit mobiler Technologie erfolgreich im Blumenmarkt, abgerufen am 12. Dezember 2007 ( des vom 11. Dezember 2004 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Lucia Impelluso: Die Natur und ihre Symbole. Pflanzen, Tiere und Fabelwesen. Parthas Verlag, Berlin 2005, ISBN 3-936324-03-4.
- ↑ Marianne Beuchert: Symbolik der Pflanzen. Insel Verlag, Frankfurt / Leipzig 2004, ISBN 3-458-34694-5, S. 279.
Weiterführende Literatur
[Bearbeiten | Quelltext bearbeiten]- Dieter Heß: Die Blüte. Struktur, Funktion, Ökologie, Evolution. 3. Auflage. Eugen Ulmer, Stuttgart (Hohenheim) 2019, ISBN 978-3-8186-0064-8 (allgemeinverständliche Einführung auch für den Laien).
- Special Issue: Major Themes in Flowering Research. In: Journal of Experimental Botany. Band 57, Nr. 13, 2006 (jxb.oxfordjournals.org).
- Douglas E. Soltis, James H. Leebens-Mack, Pamela S. Soltis (Hrsg.): Developmental Genetics of the Flower (= Advances in Botanical Research. Band 44). Academic Press, San Diego u. a. 2006, ISBN 0-12-005944-4 (englisch, sciencedirect.com).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Blütenbiologie ( vom 19. Juli 2011 im Internet Archive; PDF; 532 kB)
- Blüten-Bilder aus dem Bildarchiv der Universität Basel
- Blüten- und Fruchtbiologie. uni-hohenheim.de
- Physiologie des Knospenaustriebs und der Blütenbildung. botanikvortrag.de


 French
French Deutsch
Deutsch