Cabazitaxel – Wikipedia
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Cabazitaxel | |||||||||||||||||||||
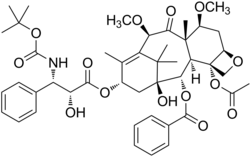
| Andere Namen | (1S,2S,3R,4S,7R,9S,10S,12R,15S)-4-(Acetyloxy)-15-{[(2R,3S)-3-{[(tert-butoxy)carbonyl]amino}-2-hydroxy-3-phenylpropanoyl]oxy}-1-hydroxy-9,12-dimethoxy-10,14,17,17-tetramethyl-11-oxo-6-oxatetracyclo[11.3.1.03,10.04,7]heptadec-13-en-2-ylbenzoat | |||||||||||||||||||||
| Summenformel | C45H57NO14 | |||||||||||||||||||||
| Kurzbeschreibung | weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 835,93 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Cabazitaxel (Handelsname Jevtana®, Hersteller: Sanofi-Aventis) ist halbsynthetisch gewonnenes Zytostatikum aus der Gruppe der Taxane zur Behandlung von fortgeschrittenem Prostatakrebs nach erfolgter Behandlung mit einer anderen Chemotherapie; es bietet sich bei kastrationsresistentem Krebs als zusätzliche Therapielinie an. Cabazitaxel zählt zu den Mikrotubuli-Inhibitoren. Es hemmt in der Zellteilungsphase die Ausbildung des Spindelapparats (Mitosehemmer; zytotoxische Wirkung).
Synthese
[Bearbeiten | Quelltext bearbeiten]Cabazitaxel wird halbsynthetisch aus dem Naturstoff 10-Deacetylbaccatin III hergestellt, der durch Extraktion aus Eibennadeln (Taxus sp.) gewonnen wird.[2]
Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Cabazitaxel wird als Zweitlinientherapie nach Docetaxel bei kastrationsresistentem Prostatakarzinom eingesetzt.[5] Alle drei Wochen wird Cabazitaxel in einer Dosierung von 25 mg/m² KOF als einstündige Infusion in Kombination mit 10 mg Prednison täglich verabreicht. Der Patient muss mindestens 1500 neutrophile Granulozyten pro Kubikmillimeter (µl) Blut aufweisen, da es sonst zu schweren Infektionen kommen kann.
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Allergische Reaktionen gegen Cabazitaxel sind möglich.[6] Zu weiteren Nebenwirkungen zählen (febrile) Neutropenie, Thrombozytopenie und Durchfall, ferner unter anderem Abdominalschmerzen, Rückenschmerzen, Ermüdung und Fieber.[7][8][9]
Frühe Nutzenbewertung (§ 35a SGB V)
[Bearbeiten | Quelltext bearbeiten]Der Gemeinsame Bundesausschuss (G-BA) fasste 2012 einen Beschluss hinsichtlich des Zusatznutzens von Cabazitaxel aufgrund § 35a SGB V (AMNOG) (frühe Nutzenbewertung). Für Patienten mit hormonrefraktärem metastasiertem Prostatakarzinom, die während oder nach einer Docetaxel-haltigen Chemotherapie progredient sind und für die eine erneute Behandlung mit Docetaxel nicht mehr infrage kommt, wurde Cabazitaxel mit Best Supportive Care verglichen. Für Patienten, die nach einer Docetaxel-haltigen Chemotherapie progredient sind, grundsätzlich aber noch für eine adäquate Docetaxel-haltige Chemotherapie infrage kommen, war die zweckmäßige Vergleichstherapie Docetaxel in Kombination mit Prednison oder Prednisolon.[10] Laut G-BA-Beschluss gibt es, wenn eine erneute Docetaxel-Therapie nicht infrage kommt, einen Hinweis auf einen geringen Zusatznutzen; für die übrigen Patienten ist ein Zusatznutzen nicht belegt.[11]
Literatur
[Bearbeiten | Quelltext bearbeiten]- A. O. Sartor: Cabazitaxel or mitoxantrone with prednisone in patients with metatstatic castration-resistant prostate cancer (mCRPC) previously treated with docetaxel: Final results of a multinational phaseIII trial (TROPIC). ASCO, 2010
- Informationen der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) für Ärzte über neu zugelassene Arzneimittel / neu zugelassene Indikationen in der Europäischen Union (EU).[12]
- Matthew D. Galsky, Argyris Dritselis, Peter Kirkpatrick, William K. Oh: Cabazitaxel. In: Nature Reviews Drug Discovery. Band 9, Nr. 9, 2010, S. 677–678, doi:10.1038/nrd3254.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Öffentlicher Beurteilungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) zu: Cabazitaxel
- Cabazitaxel. cancer.gov, NCI Drug Dictionary
- Cabazitaxel: neueste Phase-3-Ergebnisse bei ASCO vorgestellt. haematologie-onkologie.universimed.com
- Cabazitaxel Injection. MedlinePlus
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Cabazitaxel. Medkoo.
- ↑ a b Eintrag zu Cabazitaxel in der DrugBank der University of Alberta, abgerufen am 6. Februar 2017.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 7,10-dimethyl-docetaxel im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 6. Februar 2017.
- ↑ Datenblatt Cabazitaxel bei Sigma-Aldrich, abgerufen am 4. September 2024 (PDF).
- ↑ Michel Bolla, Hendrik van Poppel (Hrsg.): Management of Prostate Cancer: A Multidisciplinary Approach. 2. Auflage. Springer, Cham 2017, ISBN 978-3-319-42769-0, S. 334 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Prostatakrebs: Neuer Mitosehemmer in USA zugelassen. Pharmazeutische Zeitung, 22. Juni 2010.
- ↑ Johann Sebastian de Bono, Stephane Oudard, Mustafa Ozguroglu, Steinbjørn Hansen, Jean-Pascal Machiels, Ivo Kocak, Gwenaëlle Gravis, Istvan Bodrogi, Mary J Mackenzie, Liji Shen, Martin Roessner, Sunil Gupta, A Oliver Sartor: Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. In: The Lancet. Band 376, Nr. 9747, 2010, S. 1147–1154, doi:10.1016/S0140-6736(10)61389-X.
- ↑ Deutsche Zusammenfassung von: J.S. de Bono et al.: Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. In: The Lancet, 2. Oktober 2010; wissenschaft-online.de
- ↑ Kastrationsresistentes Prostatakarzinom: Überwindung der Therapielücke mit neuem Taxan. 46. ASCO-Jahrestagung Bericht.
- ↑ A11-24 Cabazitaxel – Nutzenbewertung gemäß § 35a SGB V (Dossierbewertung). iqwig.de; abgerufen am 26. März 2020.
- ↑ Nutzenbewertungsverfahren zum Wirkstoff Cabazitaxel (Prostatakarzinom, Docetaxel-Vorbehandlung, Kombination mit Prednison oder Prednisolon). g-ba.de; abgerufen am 26. März 2020.
- ↑ Jevtana® (Cabazitaxel). (PDF; 122 kB) Neue Arzneimittel Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).


 French
French Deutsch
Deutsch