Carbonsäurehalogenide – Wikipedia

Carbonsäurehalogenide, auch Alkanoylhalogenide genannt, sind in der Chemie Verbindungen einer Stoffgruppe, die sich von den Carbonsäuren ableiten und als reaktive Carbonsäurederivate bezeichnet werden können. Bei ihnen ist die Hydroxygruppe der Carbonsäure durch ein Halogen-Atom ersetzt, so dass eine Halogencarbonylgruppe resultiert. Die am häufigsten verwendeten Carbonsäurehalogenide sind die Carbonsäurechloride.[1]
Nomenklatur
[Bearbeiten | Quelltext bearbeiten]Die Benennung kann entweder als Säurehalogenid, ausgehend vom Acylrest, oder als Halogencarbonyl erfolgen. Beispiele:
- Essigsäurefluorid oder Acetylfluorid oder Fluorcarbonylmethan
- Benzoesäurechlorid oder Benzoylchlorid oder Chlorcarbonylbenzol
- Ameisensäurechlorid oder Formylchlorid oder Chlorcarbonyl ist eine nur hypothetisch bzw. unter hohem Druck und sehr tiefen Temperaturen existierende Substanz. Bei Normalbedingungen zerfällt es in HCl und CO. Wesentlich beständiger ist Formylfluorid H-COF.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Methoden zur Darstellung der Carbonsäurechloride aus Carbonsäuren sind unter dem Stichwort Carbonsäurechloride beschrieben.[2]
Die dort dargestellten Synthesereaktionen funktionieren auch für die entsprechenden Fluor- und Bromanaloga. Carbonsäurefluoride erhält man außerdem aus Carbonsäurechloriden und Kaliumhydrogendifluorid unter Abspaltung von Kaliumchlorid und Chlorwasserstoff:[3]
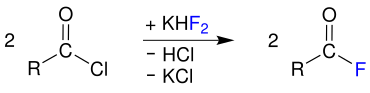
Carbonsäureiodide werden aus Carbonsäurechloriden durch Umsetzung mit Iodwasserstoff und unter Abspaltung von Chlorwasserstoff dargestellt:[3]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die meisten niedermolekularen Carbonsäurehalogenide sind farblose, stechend riechende Flüssigkeiten, die an feuchter Luft wegen der Hydrolyse zu Carbonsäuren und Halogenwasserstoffsäuren rauchen. Im Vergleich zur jeweiligen Carbonsäure liegen Schmelz- und Siedepunkte niedriger, da sich keine Wasserstoffbrückenbindungen ausbilden können. Alle Carbonsäurehalogenide sind brennbar. Durch den −I-Effekt des Halogenatoms ist das Kohlenstoffatom der Carbonylgruppe stärker positiv geladen und dadurch deutlich reaktiver als das der entsprechenden Carbonsäure. Alle Carbonsäurehalogenide zählen zu den besonders reaktiven Carbonsäurederivaten.
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Hydrolyse
[Bearbeiten | Quelltext bearbeiten]Mit Wasser reagieren Carbonsäurehalogenide unter stürmischer, stark exothermer Reaktion zur jeweiligen Carbonsäure und dem entsprechenden Halogenwasserstoff:

Zum genauen Mechanismus siehe auch: Additions-Eliminierungs-Mechanismus.
Amidbildung
[Bearbeiten | Quelltext bearbeiten]Durch Reaktion mit Ammoniak lassen sich die entsprechenden Carbonsäureamide herstellen:

Dabei wird ebenfalls ein Halogenwasserstoff abgespalten.
Esterbildung
[Bearbeiten | Quelltext bearbeiten]Durch Reaktion mit Alkoholen lassen sich die entsprechenden Carbonsäureester darstellen:[4][5]

Diese Reaktion ist im Gegensatz zu derjenigen von Carbonsäuren und Alkoholen irreversibel.
Friedel-Crafts-Acylierung
[Bearbeiten | Quelltext bearbeiten]Durch Reaktion mit Aromaten, hier Benzol, bilden sich durch eine Friedel-Crafts-Acylierung aromatische Ketone:[6]

Die Carbonsäurehalogenide müssen zuvor mit einer Lewis-Säure, hier Aluminiumtrichlorid, aktiviert werden.
Für weitere Reaktionen siehe: Carbonsäurechloride.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Carbonsäurehalogenide sind die Carbonylverbindungen mit der größten Reaktivität. Deshalb laufen viele Reaktionen, die ausgehend von der reinen Carbonsäure nur unter besonderen Bedingungen möglich sind, wesentlich leichter ab. Beispiele für die Verwendung sind Darstellung der Carbonsäureester oder Friedel-Crafts-Acylierungen.
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Da die Carbonsäurehalogenide sehr leicht und unter Hitzeentwicklung hydrolysieren, müssen diese möglichst trocken gelagert werden. Entweichende Halogenwasserstoffsäuren reizen Schleimhäute, Augen und Haut. Die Reaktion mit niedrigen Alkoholen verläuft meist ähnlich stürmisch unter Bildung des Esters und der Halogenwasserstoffsäure. Alle Carbonylhalogenide sind außerdem brennbar.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 238–240, ISBN 3-7776-0406-2.
- ↑ Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1236.
- ↑ a b Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 414, ISBN 3-342-00280-8.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 319, ISBN 3-342-00280-8.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 245, ISBN 3-7776-0406-2.
- ↑ Organikum, Wiley-VCH Verlag GmbH, 23. Auflage, 2009, S. 381–384, ISBN 978-3-527-32292-3.


 French
French Deutsch
Deutsch