Disubstituierte Benzole – Wikipedia
| Disubstituierte Benzole | ||||
| Name | ortho | meta | para | Isomerengemisch |
| gleiche Substituenten |  |  |  |  |
| verschiedene Substituenten |  |  |  |  |
Die disubstituierten Benzole bilden eine große Stoffgruppe aromatischer Verbindungen. Die Struktur besteht aus einem Benzolring mit zwei angefügten Substituenten, die sowohl gleich als auch verschieden sein können. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere mit gleicher Summenformel. Je nach relativer Anordnung unterscheidet man ortho-, meta- und para-Isomer.
Namensgebung
[Bearbeiten | Quelltext bearbeiten]Stammverbindungen
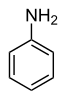
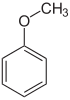
[Bearbeiten | Quelltext bearbeiten]In den meisten Fällen bilden die einfach substituierten Benzole neue Stammverbindungsnamen: mit –OH das Phenol, mit –NH2 das Anilin, mit –OCH3 das Anisol, mit –CH3 das Toluol. Mit der Nitrogruppe bzw. Halogensubstituenten entstehen dagegen keine neuen Stammverbindungsnamen.
Historische Namensgebung
[Bearbeiten | Quelltext bearbeiten]Betrachtet man die Substituentenkombinationen an Aromaten am Beispiel der Methylgruppe (–CH3) und der Hydroxygruppe (–OH), so kann man schon sehr unterschiedliche Namenskombinationen und Entstehungsformen feststellen. In allen Fällen tragen die Verbindungen Trivialnamen.
- Die drei Dimethylbenzole besitzen einen gemeinsamen Stammnamen, nämlich Xylol. Die Unterscheidung erfolgt lediglich durch die Angabe der Substituentenstellung, z. B. durch Kennzeichnung mit ortho-, meta- oder para-.
- Die drei Dihydroxybenzole besitzen hingegen keinen gemeinsamen Stammnamen. Die drei Isomere besitzen drei völlig eigenständige und unterschiedliche Namen – Brenzcatechin, Resorcin und Hydrochinon –, die sich auf deren Herkunft und Entdeckung beziehen.
- Im dritten Fall der Kombination beider Substituenten kann man die Verbindungen als Methylphenole oder Hydroxytoluole ansehen. In diesem Fall besitzen diese Verbindungen einen neuen Trivialnamen – Kresol –, der wiederum auf deren Herkunft und Entdeckung zurückgeht. Die Unterscheidung erfolgt z. B. wieder durch Kennzeichnung mit ortho-, meta- oder para-.
| Benzol (–H) | Toluol (–CH3) | Phenol (–OH) |
| Toluol (–CH3) | Dimethylbenzole Xylole 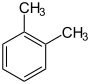  | Methylphenole, Hydroxytoluole Kresole 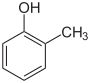  |
| Phenol (–OH) | Dihydroxybenzole 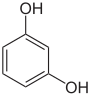 o: Brenzcatechin, m: Resorcin, p: Hydrochinon |
Systematische Namensgebung
[Bearbeiten | Quelltext bearbeiten]Bei einer mehr systematischen Namensgebung ist folgende Rangfolge der Stammverbindungen festzustellen: Benzoesäure, Benzaldehyd, Benzylalkohol, Phenol, Anilin, Anisol, Toluol, Nitrobenzol, Halogenbenzole. Beim Zusammentreffen zweier Stammverbindungen mit eigenem Namen entsteht z. B. aus Benzaldehyd und Anisol die Stoffgruppe der Methoxybenzaldehyde, das para-Isomer besitzt zusätzlich den Trivialnamen Anisaldehyd.
Sind jedoch Nitrogruppen bzw. Halogensubstituenten beteiligt, ändert sich der Name der Stammverbindungen nicht. Aus Toluol werden dann z. B. die Nitrotoluole, aus Benzaldehyd die Brombenzaldehyde.
Die Tabelle beinhaltet eine Zusammenstellung aller Kombinationen sehr gängiger Substituenten:
Weitere Verbindungen
[Bearbeiten | Quelltext bearbeiten]- Ethylmethylbenzole – Diethylbenzole – Divinylbenzole – Xylylbromide – Methylstyrole
- Phenetidine – Ethylphenole – n-Propylphenole – Isopropylbenzaldehyde
- Sulfobenzoesäuren
- Benzoldicarbonsäuren (o: Phthalsäure, m: Isophthalsäure, p: Terephthalsäure)
- Benzoldicarbaldehyde (o: Phthalaldehyd, m: Isophthalaldehyd, p: Terephthalaldehyd)
- Benzoldicarbonitrile (o: Phthalodinitril, m: Isophthalodinitril, p: Terephthalodinitril)
- Nitrobenzoylchloride – Nitrobenzonitrile – Nitrobenzylchloride
- Chlorbenzotrifluoride – Chlorbenzotrichloride
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Darstellung gelingt durch Einführung z. B. einer Nitrogruppe oder Halogengruppe, oder durch Umwandlung eines schon bestehenden Zweitsubstituenten, z. B. durch Methylierung einer Phenolgruppe zur Methoxygruppe.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Schmelz- und Siedepunkte
[Bearbeiten | Quelltext bearbeiten]Die Siedepunkte der drei Isomere liegen häufig nah beieinander, während ihre Schmelzpunkte sich deutlich unterscheiden. Das para-Isomer, das die höchste Symmetrie aufweist, besitzt zumeist den höchsten Schmelzpunkt.
Acidität und Basizität
[Bearbeiten | Quelltext bearbeiten]Die Acidität und Basizität der Stammverbindungen wie Phenol, Anilin und Benzoesäure werden von ihren Zweitsubstituenten und ihrer Stellung beeinflusst. 2- und 4-Nitrophenol besitzen gegenüber dem 3-Nitrophenol einen niedrigeren pKs-Wert; damit sind deren Aciditäten größer. Bei der ortho- und para-Form kann das Phenolat-Ion eine Doppelbindung auf die elektronenziehende Nitrogruppe (−M-Effekt) verschieben. Das zweite O kann dort einen negativen Ladungsschwerpunkt ausbilden. Bei der meta-Form ist das nicht möglich. Die Nitroaniline besitzen gegenüber dem Anilin (4,603[1]) deutlich niedrigere pKs-Werte; die elektronenziehende Nitrogruppe (−M-Effekt) setzt die Basizität herab. Ein Proton kann daher deutlich schlechter aufgenommen werden.
Intramolekulare Wasserstoffbrücken
[Bearbeiten | Quelltext bearbeiten]Können sich intramolekulare Wasserstoffbrücken ausbilden, so hat dies u. a. Auswirkungen auf die Schmelzpunkte und die Löslichkeit in Wasser.
intramolekulare Wasserstoffbrücke 






2-Nitrophenol 2-Nitroanilin 2-Nitrobenzaldehyd 2-Aminobenzaldehyd Anthranilsäure Salicylaldehyd Salicylsäure
2-Nitrophenol bzw. 2-Nitroanilin besitzen den niedrigsten Schmelzpunkt, da sie eine intramolekulare Wasserstoffbrücke ausbilden können. Die beiden anderen Isomere bilden im Gegensatz dazu intermolekulare Wasserstoffbrücken aus. Bei 2-Nitrophenol bzw. 2-Nitroanilin ist Energie zum Aufbrechen dieser Brücken nicht erforderlich.
Die Nitrophenole sind in Wasser schwerlöslich, die Werte unterscheiden sich aber innerhalb dieser Gruppe. Die deutlich schlechtere Löslichkeit des 2-Nitrophenols in Wasser lässt sich ebenfalls mit der intramolekularen Wasserstoffbrücke gut erklären. Das Molekül ist dadurch nach außen hin deutlich unpolarer. Dagegen sind die Löslichkeiten des 3- und 4-Nitrophenols etwa gleich und im Vergleich deutlich besser. Hier bilden sich nun zwischen der phenolischen Hydroxygruppe und Wasser eher intermolekulare Wasserstoffbrücken.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.


 French
French Deutsch
Deutsch