Gram-Färbung – Wikipedia


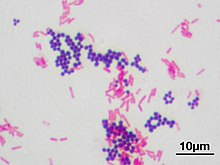
Die Gram-Färbung (oder Gramfärbung) ist eine vom dänischen Bakteriologen Hans Christian Gram entwickelte und 1884 eingeführte Methode zur differenzierenden Färbung von Bakterien für die mikroskopische Untersuchung. Sie ermöglicht es, Bakterien in zwei große Gruppen einzuteilen, die sich im Aufbau ihrer Zellwände unterscheiden. Es werden grampositive und gramnegative Bakterien unterschieden. Allerdings können nicht alle Bakterienarten durch diese Technik klassifiziert werden, so gibt es auch gramvariable und gramunbestimmte Arten.
Bedeutung
[Bearbeiten | Quelltext bearbeiten]Die Gram-Färbung ist ein wertvolles Diagnostik-Werkzeug in der naturwissenschaftlichen und der medizinischen Mikrobiologie: Mit ihrer Hilfe können auf einfache Weise Bakterien nach dem Aufbau ihrer Zellwand unterschieden werden, da die unterschiedliche Färbbarkeit der Bakterien auf deren chemischen und physikalischen Eigenschaften basiert. Der Unterschied des Aufbaus der Zellwand ist bei Bakterien ein wichtiges systematisches Unterscheidungsmerkmal, somit dient die Differenzierbarkeit mittels Gram-Färbung als taxonomisches Merkmal.
Wichtig ist die Gram-Färbung bei der Diagnostik von Infektionskrankheiten. Grampositive und gramnegative Bakterien können oft nur mit unterschiedlichen Antibiotika bekämpft werden. Nach Trocknung (je nach Materialart etwa 5–15 Minuten) und Fixierung (in der Regel Hitzefixierung durch dreimaliges kurzes Ziehen über eine starke Flamme (Bunsenbrenner)) des Bakterienausstrichs wird in etwa fünf Minuten das „Gramverhalten“ bestimmt. Damit kann der Arzt sofort mit der antibiotischen Therapie beginnen, bevor das Ergebnis der mindestens 24 Stunden dauernden kulturellen Erregeranzucht mit nachfolgender Bestimmung vorliegt.
Färbemethode
[Bearbeiten | Quelltext bearbeiten]Bei der Gram-Färbung wird nach Anfärbung der Bakterien mit einem basischen Anilinfarbstoff (in der Regel Kristallviolett) durch Nachbehandlung mit Lugolscher Lösung (enthält einen Iod-Kaliumiodid-Komplex) ein Farbstoff-Iod-Komplex in den Bakterien gebildet. Dieser Farbkomplex ist im Gegensatz zum primären Farbstoff wasserunlöslich. In Ethanol hingegen ist er löslich und wird deshalb aus gramnegativen Bakterien durch Behandlung mit Ethanol extrahiert. Wegen der dickeren Mureinschicht wird er dagegen aus grampositiven Bakterien unter den Bedingungen der Gramfärbung durch Ethanol nicht extrahiert.
Der Färbevorgang besteht aus drei Schritten:
- Färben: Im ersten Schritt färbt man mit einer Lösung von Kristallviolett (Gentianaviolett), der 15 g/l Phenol (Karbolsäure) zugesetzt ist, dem sogenannten „Karbol-Gentianaviolett“. Hierbei werden alle Bakterien, grampositive, wie gramnegative, gefärbt. Bei der nachfolgenden Behandlung mit Lugolscher Lösung werden größere Farbstoff-Komplexe gebildet, alle Bakterien erscheinen dunkelblau.
- Entfärben („Differenzieren“): Im zweiten Schritt folgt eine Behandlung mit 96%igem Ethanol. Dabei verhalten sich grampositive und gramnegative Bakterien verschieden: gramnegative Bakterien werden schnell wieder entfärbt, während die blauen Farbstoffkomplexe aus grampositiven Bakterien erst nach deutlich längerem Behandeln mit Ethanol ausgewaschen werden können.
- Gegenfärben: Zur Darstellung der gramnegativen Bakterien können diese abschließend mit verdünnter Fuchsinlösung (eine Lösung von Fuchsin mit Phenol in etwa 1/10 der üblichen Konzentrationen von „Karbolfuchsin“) oder Safraninlösung gegengefärbt werden, worauf sie rot beziehungsweise rotorange erscheinen.
Die Behandlungen mit Lugolscher Lösung und mit Alkohol sind die entscheidenden Schritte bei der Gramfärbung.[1]
Ursachen des unterschiedlichen Färbungsverhaltens
[Bearbeiten | Quelltext bearbeiten]Der Unterschied in der Färbung nach Gram ist auf den Aufbau der Zellwand zurückzuführen:

1. grampositive Zellwand
2. gramnegative Zellwand
3. Peptidoglycan (Murein)
4. Plasmamembran
5. Zytoplasma
6. Periplasmatischer Raum, bei grampos. Bakterien die inner wall zone (IWZ)[2]
7. äußere Membran
- Grampositive Bakterien besitzen eine der Membran aufgelagerte dicke mehrschichtige „Mureinhülle“ (bestehend aus Peptidoglycanen bzw. „Murein“). Diese kann bis zu 50 % der Hüllentrockenmasse ausmachen. Zusätzlich enthält die Zellwand zwischen 20 % und 40 % Lipoteichonsäuren. In den Zwischenräumen der Mureinhülle sammelt sich die Lugolsche Lösung an. Hier wirkt der Alkohol dehydratisierend und verringert den Abstand zwischen den Molekülen, so dass die Farbstoff-Komplexe nicht vom Alkohol ausgewaschen werden können. Somit bleibt die dunkelblaue Färbung erhalten.
Beispiele für grampositive Bakterien sind alle Arten des Stammes Actinobacteria, wie beispielsweise die der Gattungen Actinomyces und Streptomyces, und fast alle Arten des Stammes Firmicutes, wie beispielsweise die der Gattungen Streptococcus, Enterococcus, Staphylococcus, Listeria, Bacillus, Clostridium, Lactobacillus, und die Art Erysipelothrix rhusiopathiae.
- Gramnegative Bakterien hingegen besitzen nur eine dünne, einschichtige Mureinhülle. Diese macht nur etwa 10 % der Trockenmasse der Bakterienhülle aus und enthält keine Teichonsäuren.[3] Zudem ist ihr zusätzlich eine zweite Lipid-Membran aufgelagert. Der Alkohol wirkt lipidlösend, so dass die aufgelagerte Lipidmembran aufgelöst und die dünne Mureinhülle freigelegt wird. Die Farbstoff-Komplexe werden vom Alkohol ausgewaschen – das Bakterium wird wieder entfärbt. Durch Gegenfärbung mit Fuchsin werden die gramnegativen Bakterien dann rot angefärbt.
Beispiele für gramnegative Bakterien sind alle Arten der Abteilung Proteobacteria, so die Enterobakterien (Escherichia coli, Salmonella, Shigella, Klebsiella, Proteus, Enterobacter) sowie die Gattungen Pseudomonas, Legionella, Neisseria, Rickettsia und die Art Pasteurella multocida; Vertreter anderer Abteilungen, so Streptobacillus moniliformis (eine Art des Stammes Fusobacteria), Meningococcus, Chlamydophila, Chlamydia, die Spirochäten, alle Arten des Stammes Bacteroidetes und die Cyanobakterien. Zudem sind die Arten der Gattung Veillonella der Familie Acidaminococcaceae (Stamm Firmicutes) gramnegativ, obwohl alle anderen Arten des Stammes Firmicutes grampositiv sind.
Alternativen zur Gram-Färbung
[Bearbeiten | Quelltext bearbeiten]Mit folgenden Kurztests können Bakterien anhand derselben Zellwandmerkmale unterschieden werden wie bei der Gram-Färbung:
KOH-Test
[Bearbeiten | Quelltext bearbeiten]Eine kleine Menge Bakterienmasse (von einer Agar-Kultur) wird in einem Tropfen 3%iger Kaliumhydroxid-Lösung suspendiert. Bei grampositiven ist diese Lauge zu schwach, um die Zellwand zu lysieren. Zieht man eine Nadel oder einen Zahnstocher durch das Gemisch, verhält es sich wie eine Flüssigkeit mit einer Viskosität wie Wasser (keine Fadenbildung zu erkennen). Die Zellwand von gramnegativen Bakterien dagegen ist wesentlich dünner und wird durch die Kalilauge lysiert. Die Zellen brechen auf und die DNA wird freigesetzt. Wird die Nadel durch diese Lösung gezogen, kann aufgrund der erhöhten Viskosität durch die freigesetzte DNA eine Fadenbildung beobachtet werden. Es sei betont, dass es sich hier um einen Schnelltest handelt, der nur bedingt zuverlässig ist. Für Anfänger ist es oft schwer, eine Fadenbildung zu erkennen. Eine Fehlerquelle hierbei kann des Weiteren auch die Verwendung einer falschen Laugenkonzentration darstellen. Ist diese zu stark, kommt es auch zur Lyse von grampositiven Bakterien. Ist sie hingegen zu schwach, werden auch gramnegative Bakterien nicht lysiert.
Aminopeptidasetest
[Bearbeiten | Quelltext bearbeiten]
Der Aminopeptidasetest beruht darauf, dass das Enzym L-Alanin-Aminopeptidase, von wenigen Ausnahmen abgesehen, nur bei gramnegativen Bakterien nachgewiesen werden kann[4]. Eine kleine Menge der zu untersuchenden Bakterien wird in einem Reagenzglas oder Mikroreaktionsgefäß in etwas sterilem, destilliertem Wasser suspendiert. Zum Nachweis wird L-Alanin-4-nitroanilid verwendet, welches durch das Enzym unter Spaltung einer Amidbindung in L-Alanin und das gelb gefärbte 4-Nitroanilin gespalten wird. Somit zeigt eine Gelbfärbung der Suspension das Vorliegen eines gramnegativen Bakteriums an. Für diese Reaktion sind industriell hergestellte Teststreifen erhältlich. Es ist ratsam hierbei, immer eine Negativkontrolle mit anzusetzen, um einen Vergleich zu haben. Außerdem ist der Test nur bei Bakterienkolonien ohne starke Eigenfärbung anwendbar.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Der dänische Mediziner Hans Christian Gram entwickelte die Färbemethode als Mitarbeiter bei Carl Friedländer in Berlin. Er suchte nach einer Färbemethode, mit der Bakterien in tierischen Geweben dargestellt werden können, also kontrastierend zu den Gewebezellen gefärbt wurden. Die gefundene Färbemethode, veröffentlicht 1884, hatte jedoch nur bei einigen Bakterien, den grampositiven, Erfolg. Émile Roux wendete die Methode zur färberischen Differenzierung von grampositiven und gramnegativen Bakterien an, insbesondere zur Bestimmung von Gonokokken (gramnegativ im Gegensatz zu vielen anderen Kokken) (Veröffentlichung 1886).
Weiterentwicklung
[Bearbeiten | Quelltext bearbeiten]Wissenschaftler an der Harvard University in Boston (USA) haben die Gram-Färbung zu einem magnetischen Detektionsverfahren weiterentwickelt. Nach der Färbung mit modifiziertem Kristallviolett werden magnetische Nanopartikel an den Farbstoff angehängt. Die Bakterien können anschließend über NMR-Geräte detektiert und magnetisch getrennt werden. Vorteil der magnetischen Detektion ist ihre hohe Empfindlichkeit. Mithilfe miniaturisierter Mikro-NMR-Geräte ist eine rasche und empfindliche Vor-Ort-Diagnose denkbar.[5]
Literatur
[Bearbeiten | Quelltext bearbeiten]- C. Gram: Über die isolirte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten. In: Fortschritte der Medicin. Vol. 2, 1884, S. 185–189.
- Steve K. Alexander, Dennis Strete: Mikrobiologisches Grundpraktikum – ein Farbatlas. Pearson, München 2006, ISBN 978-3-8273-7201-7.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Carl Roth GmbH + Co. KG: Gram Färbe Anleitung. Abgerufen am 15. April 2020 (deutsch).
- ↑ Benoît Zuber et al.: Granular Layer in the Periplasmic Space of Gram-Positive Bacteria and Fine Structures of Enterococcus gallinarum and Streptococcus gordonii Septa Revealed by Cryo-Electron Microscopy of Vitreous Sections In: J Bacteriol 2006, 188(18): 6652–6660. PMC 1595480 (freier Volltext).
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Murein im Lexikon der Biologie, abgerufen am 22. November 2008.
- ↑ J. M. Hernández Molina, A. Martínez, M. C. Parra, M. I. Ortega: Utilidad de la prueba de la L-alanina-aminopeptidasa para diferenciar la estructura de la pared celular de las bacterias [Utility of the L-alanine-aminopeptidase test for differentiating the cell wall structure of bacteria]. In: Enferm Infecc Microbiol Clin. Dezember 1991, PMID 1726575.
- ↑ Ghyslain Budin, Hyun Jung Chung, Hakho Lee, Ralph Weissleder: A Magnetic Gram Stain for Bacterial Detection. In: Angewandte Chemie. Band 124, Nr. 24, 2012, doi:10.1002/ange.201202982.


 French
French Deutsch
Deutsch