Hydrazone – Wikipedia

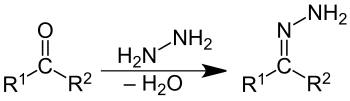
Hydrazone sind Derivate von Aldehyden oder Ketonen. Sie entstehen in Analogie zu den Iminen in einer Kondensationsreaktion durch Reaktion der Carbonylverbindungen mit Hydrazin oder mit dessen Abkömmlingen (z. B. Phenylhydrazin, 2,4-Dinitrophenylhydrazin etc.). Das Schema zeigt die Reaktion von einem Äquivalent der Carbonylverbindung mit Hydrazin, die zum Hydrazon führt. Wenn zwei Äquivalente der Carbonylverbindung mit Hydrazin umgesetzt werden, bildet sich zuerst ebenfalls das Hydrazon, das dann in einem zweiten Schritt zu einem Azin weiterreagieren kann.
R1 und R2 können unterschiedliche oder gleiche organische Reste sein, auch Wasserstoffatome.
Bedeutung
[Bearbeiten | Quelltext bearbeiten]Besondere analytische Bedeutung besaßen die 2,4-Dinitrophenylhydrazone, die als gut kristallisierende Carbonylderivate die Identifikation von Carbonylverbindungen (im Speziellen von Aldehyden und Ketonen) über den Schmelzpunkt des jeweiligen 2,4-Dinitrophenylhydrazons ermöglichen.[1][2]
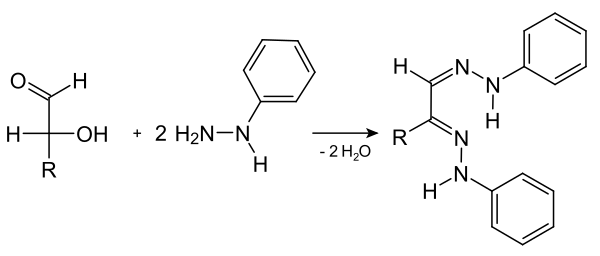
Geschichte Bildung von Osazonen
[Bearbeiten | Quelltext bearbeiten]Von historischer Bedeutung sind die Phenylhydrazone von Zuckern, die man auch als Osazone bezeichnet. Bei Arbeiten über die Diazotierung von Anilin entdeckte Emil Fischer 1874 das Phenylhydrazin. Es diente später zur Charakterisierung von Zuckern. Aldosen sowie Ketosen, deren Ketogruppe sich an C-2 befindet, bilden mit drei Äquivalenten Phenylhydrazin zweifache Hydrazone am - und -Atom. Die Bildung der Osazone ist mit einer Redoxreaktion verbunden; ein Mol Phenylhydrazin wird zu Anilin und Ammoniak reduziert, eine Hydroxygruppe des Monosaccharids wird zu einer Carbonylgruppe oxidiert.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bei geeignetem Substitutionsmuster unterliegen Hydrazone der Azo-Hydrazon-Tautomerie.
Synthesen
[Bearbeiten | Quelltext bearbeiten]Präparative Bedeutung besitzen die Hydrazone in der Wolff-Kishner-Reaktion. Sie spalten bei Deprotonierung Stickstoff (N2) ab und erlauben so die selektive Reduktion von Ketonen und Aldehyden zu Alkanen.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 2: Cm–G. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1981, ISBN 3-440-04512-9, S. 973.
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 1984, S. 203, ISBN 3-7776-0406-2.
- ↑ Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, S. 129, ISBN 3-211-81060-9.


 French
French Deutsch
Deutsch