Komplexbildungsreaktion – Wikipedia
Eine Komplexbildungsreaktion ist eine chemische Reaktion (Stoffumwandlung und Teil der Komplexreaktionen) aus dem Bereich der Komplexchemie, bei der ein Metall-Kation mit Molekülen oder Ionen reagiert, die als Lewis-Basen ihre freien Elektronenpaare zur Bildung einer koordinativen Bindung mit dem Kation zur Verfügung stellen. Das Molekül oder Ion wird dabei als Ligand bezeichnet. Komplexbildungsreaktionen sind oft durch Farbumschläge gekennzeichnet. In der Summenformel sowie im Reaktionsschema wird der Komplex durch eckige Klammern angedeutet, in denen vorne das Zentralatom wie z. B. ein Kupferkation und in runden Innenklammern die Liganden stehen (Beispiel: [Cu(NH3)4]2+).
Beispiele für Komplexbildungsreaktionen
[Bearbeiten | Quelltext bearbeiten]
Bildung des Hexaaquakupfer-Komplexes
[Bearbeiten | Quelltext bearbeiten]Wasserfreies, weißes Kupfersulfat färbt sich bei Zugabe von Wasser hellblau – eine Nachweisreaktion für Wasser. Es entsteht ein Aqua-Komplex des Kupfers, bei dem sechs Wassermoleküle als Liganden des Zentralions auftreten, wobei die beiden axial gelegenen Liganden deutlich weiter vom Zentralion entfernt sind (Jahn-Teller-Effekt):
Bildung des Tetraamminkupfer-Komplexes
[Bearbeiten | Quelltext bearbeiten]Kupfer-II-salze ergeben auch mit Ammoniaklösung bei pH-Werten über 8 tiefblaue Komplexsalz-Lösungen (Kupfertetraamminkomplex [Cu(NH3)4]2+ – auch als Tetraamminkupfer(II) bezeichnet, vgl. Abbildung dieser Nachweisreaktion):
Der Kupfertetraammin-Komplex ist wie der Kupferhexaaquakomplex zweifach positiv geladen, da sich 4 neutrale Moleküle an das Zentralatom binden (streng genommen 4 + 2 Moleküle, nämlich 4 NH3 und 2 H2O; Jahn-Teller-Effekt). Wenn sich jedoch Anionen wie z. B. Chlorid-Anionen an das Zentralatom binden, so kann der Komplex auch negativ geladen sein (z. B. ist der grüne Tetrachlorocuprat-II-Komplex zweifach negativ geladen):
Anionische Komplexe werden andersartig benannt (Metall-Name mit Endung -at am Namensende) und sind von großer Bedeutung auch in der Biochemie.
Bildung des Nickel-Dimethylglyoxim-Komplexes
[Bearbeiten | Quelltext bearbeiten]Nickelsalzlösung bildet mit einer alkoholischen Dimethylglyoxim-Lösung (DMG) Komplexe. In ammoniakalischer Lösung fällt das himbeerrote Nickel-dimethylglyoxim als Komplex aus:
Dieser Komplex ist im Unterschied zum Kupfertetraammin- oder Kupfertetraaquo-Komplex neutral und in Wasser unlöslich.
Komplexbildung als Gleichgewicht
[Bearbeiten | Quelltext bearbeiten]Derlei Lewis-Säure-Base-Reaktionen zur Komplexbildung sind Gleichgewichtsreaktionen, für die das Massenwirkungsgesetz aufgestellt werden kann. Die resultierende Gleichgewichts-Konstante nennt man Komplexbildungskonstante. Sie gibt auch an wie stabil der Komplex ist bzw. ob er zur Dissoziation neigt. Ihr reziproker Wert wird als Komplexdissoziationskonstante KD bezeichnet, also KA−1 = KD.
Einordnung und Bedeutung von Komplexbildungsreaktionen
[Bearbeiten | Quelltext bearbeiten]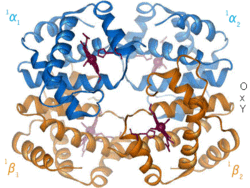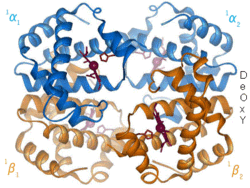
Neben der Komplexbildungsreaktion gibt es in der Komplexchemie auch Ligandenaustausch- und Dissoziationsreaktionen, bei denen Komplexe erzeugt oder wieder abgebaut werden. Viele Komplexbildungsreaktionen sind in Bereichen wie der Katalyse, der Biochemie, der Farbstoffchemie, der Analytischen Chemie mit ihren Nachweisreaktionen insbesondere für Kationen im Kationentrenngang sowie der Chemischen Technologie von großer Bedeutung.
Viele farbige Komplexe dienen ferner der Erforschung von Atom- und Molekülstrukturen (so z. B. der Chrom-Hexamin-Komplex, Abbildung, oder die neuartigen Sandwichkomplexe), von Stoffwechselvorgängen (Hämoglobin bei der Atmung, Chlorophyll bei der Photosynthese, Komplexe mit Eisensulfid-Mineralien bei der chemischen Evolution und der Entstehung des Lebens („Eisen-Schwefel-Welt“, vgl. unter chemische Evolution), viele Enzyme, einige Vitamine), Licht-Materie-Wechselwirkungen (Pigmente und Farbstoffe) und von katalytischen Vorgängen.


 French
French Deutsch
Deutsch![{\displaystyle \mathrm {CuSO_{4}+6\ H_{2}O\longrightarrow [Cu(H_{2}O)_{6}]^{2+}+SO_{4}^{2-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/fec1a75e061a77a88df2e3e6becd39affc8cc852)
![{\displaystyle \mathrm {Cu^{2+}+4\ NH_{3}\longrightarrow [Cu(NH_{3})_{4}]^{2+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d37f99210a906f5833072eb5d2ba02dd91bb36b)
![{\displaystyle \mathrm {Cu^{2+}+4\ Cl^{-}\longrightarrow [Cu(Cl)_{4}]^{2-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/68e32ef65467cf0c29d036fd7e7191c84f6b96f7)

![{\displaystyle \mathrm {[Ni(C_{4}H_{7}N_{2}O_{2})_{2}]+2\ H^{+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/830f7b97e6beeeedd65d385f2942bdd372563bae)