Linopirdin – Wikipedia
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
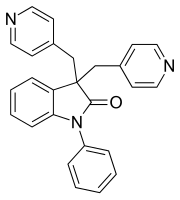 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Linopirdin | |||||||||||||||
| Andere Namen | 1-Phenyl-3,3-bis(pyridin-4-ylmethyl)-1,3-dihydro-2H-indol-2-on | |||||||||||||||
| Summenformel | C26H21N3O | |||||||||||||||
| Kurzbeschreibung | weißlicher Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 391,46 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[1] | |||||||||||||||
| Schmelzpunkt | 184–186 °C[1] | |||||||||||||||
| Löslichkeit | 240 mg/mL in Ethanol | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Linopirdin (DuP996) ist ein vom amerikanischen Konzern DuPont entwickeltes und 1990 vorgestelltes Molekül.[3][4] Es verstärkt die Ausschüttung von Neurotransmittern und blockiert direkt spannungsabhängige Kaliumkanäle.[5] Es ist ein Vertreter der Nootropika, einer Klasse Wirkstoffe, die vorteilhaft auf das Zentralnervensystem wirken, und wurde – allerdings ergebnislos – als möglicher Wirkstoff gegen die Alzheimer-Krankheit untersucht.
Wirkung
[Bearbeiten | Quelltext bearbeiten]Linopirdin blockiert konzentrationsabhängig verschiedene Ionenkanäle in Nervenzellen, erhöht die Dauer des Aktionspotentials und erhöht synaptisch die Ausschüttung von Neurotransmittern, insbesondere von Acetylcholin und Glutamat. In vivo verbessert es Lernen und Erinnerungsvermögen in Ratten.[6][7] Es wird außerdem spekuliert, dass Linopirdin die altersbezogene Abschwächung der Dopaminausschüttung in Ratten kompensieren kann.[8]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Unter dem Namen Aviva wurde Linopirdin bis in Phase III[9] zur Behandlung der Alzheimer-Krankheit getestet, jedoch hat sich die Wirkung der Substanz in Doppeltblindstudien nicht erhärtet.[10] Auch eine Verbesserung des Gedächtnisses beim Menschen konnte nicht beobachtet werden.[11] Strukturell ähnliche Moleküle, wie beispielsweise XE991, könnten als Wirkstoff Verwendung finden.[12] Aktuell wird Linopirdin als Wirkstoff zur Behandlung von Tinnitus untersucht.[13] In der Grundlagenforschung wird Linopirdin als selektiver Kaliumkanalblocker genutzt.
Synthese und Struktur
[Bearbeiten | Quelltext bearbeiten]Eine Methode zur Synthese geht von Diphenylamin (1) aus, das mit Oxalylchlorid zu einem Amid (2) reagiert. Durch Ringschluss wird daraus N-Phenylisatin (3) gebildet, das dann mit 4-Picolin zur Reaktion gebracht wird (4). Die Hydroxygruppe wird mit Essigsäureanhydrid verestert. Es entsteht dabei ein Essigsäureester, aus dem durch Eliminierung von Essigsäure erst ein Alken und anschließend nach Hydrierung (5) entsteht. Bei diesem Produkt ist die 3-Position zwar sterisch gehindert, gleichzeitig ist sie aber durch die benachbarte C=O-Gruppe und den Benzolring aktiviert, sodass es trotzdem zu einer selektiven Alkylierung an dieser Position mit 4-Chlormethylpyridin zum Linopirdin kommt. Das Endprodukt kann durch Umkristallisation aus 2-Propanol aufgereinigt werden.[14][15]

Linopirdin und andere Nootropika
[Bearbeiten | Quelltext bearbeiten]Eine Modulation synaptischer Verbindungen ist ein generisches Merkmal einiger Nootropika. So sind Donepezil, Rivastigmin und Galantamin Acetylcholinesterasehemmer und Memantin ist ein NMDA-Antagonist. Der Wirkmechanismus von Modafinil ist noch nicht vollständig geklärt. Viele diese Substanzen werden zur symptomatischen Behandlung der Demenz eingesetzt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Linopirdin bei Sigma-Aldrich, abgerufen am 18. Oktober 2016 (PDF).
- ↑ Tocris: Linopirdin, abgerufen am 26. November 2015.
- ↑ V. S. Tam, M. Myers, L. Cook: Dup 996 (3,3-bis(pyrindinylmethyl)-1-phenyl-2-one) enhances the stimulus-induced release of acetylcholine from rat brain in vitro and in vivo. In: Drug Development Research Band 19, Nummer 3, 1990, S. 285–300. doi:10.1002/ddr.430190307
- ↑ S. P. Aiken, R. Zaczek, B. S. Brown: Pharmacology of the neurotransmitter release enhancer linopirdine (DuP 996), and insights into its mechanism of action. In: Advances in pharmacology (San Diego, Calif.). Band 35, 1996, S. 349–384, PMID 8920211 (Review).
- ↑ M. E. Schnee, B. S. Brown: Selectivity of linopirdine (DuP 996), a neurotransmitter release enhancer, in blocking voltage-dependent and calcium-activated potassium currents in hippocampal neurons. In: The Journal of pharmacology and experimental therapeutics. Band 286, Nummer 2, August 1998, S. 709–717, PMID 9694925.
- ↑ D. J. Fontana, G. T. Inouye, R. M. Johnson: Linopirdine (DuP 996) improves performance in several tests of learning and memory by modulation of cholinergic neurotransmission. In: Pharmacology, biochemistry, and behavior. Band 49, Nummer 4, Dezember 1994, S. 1075–1082, PMID 7886078.
- ↑ G. W. Dent, B. L. Rule, S. W. Tam, E. B. De Souza: Effects of the memory enhancer linopirdine (Dup 996) on cerebral glucose metabolism in naive and hypoxia-exposed rats. In: Brain research. Band 620, Nummer 1, August 1993, S. 7–15, PMID 8402201.
- ↑ G. W. Dent, B. L. Rule, Y. Zhan, R. Grzanna: The acetylcholine release enhancer linopirdine induces Fos in neocortex of aged rats. In: Neurobiology of aging. Band 22, Nummer 3, 2001 May-Jun, S. 485–494, PMID 11378256.
- ↑ S. W. Tam, R. Zaczek: Linopirdine. A depolarization-activated releaser of transmitters for treatment of dementia. In: Advances in Experimental Medicine and Biology. Band 363, 1995, S. 47–56, PMID 7618529.
- ↑ K. Rockwood, B. L. Beattie, M. R. Eastwood, H. Feldman, E. Mohr, W. Pryse-Phillips, S. Gauthier: A randomized, controlled trial of linopirdine in the treatment of Alzheimer's disease. In: The Canadian journal of neurological sciences. Le journal canadien des sciences neurologiques. Band 24, Nummer 2, Mai 1997, S. 140–145, PMID 9164692.
- ↑ A. Börjesson, T. Karlsson, R. Adolfsson, M. Rönnlund, L. Nilsson: Linopirdine (DUP 996): cholinergic treatment of older adults using successive and non-successive tests. In: Neuropsychobiology. Band 40, Nummer 2, 1999, S. 78–85, PMID 10474062.
- ↑ R. Zaczek, R. J. Chorvat, J. A. Saye, M. E. Pierdomenico, C. M. Maciag, A. R. Logue, B. N. Fisher, D. H. Rominger, R. A. Earl: Two new potent neurotransmitter release enhancers, 10,10-bis(4-pyridinylmethyl)-9(10H)-anthracenone and 10,10-bis(2-fluoro-4-pyridinylmethyl)-9(10H)-anthracenone: comparison to linopirdine. In: The Journal of pharmacology and experimental therapeutics. Band 285, Nummer 2, Mai 1998, S. 724–730, PMID 9580619.
- ↑ C. Wu, K. Gopal, G. W. Gross, T. J. Lukas, E. J. Moore: An in vitro model for testing drugs to treat tinnitus. In: European journal of pharmacology. Band 667, Nummer 1–3, September 2011, S. 188–194, doi:10.1016/j.ejphar.2011.05.070, PMID 21718695.
- ↑ W. M. Bryant, G. F. Huhn, J. H. Jensen, M. E. Pierce, C. Stammbach: A Large Scale Preparation of the Cognitive Enhancer Linopirdine. In: Synthetic Communications. Band 23, Nummer 11, 1993, S. 1617–1615, doi:10.1080/00397919308011258
- ↑ Lily C. Tang, Stephen J. Tang: Neurochemistry in Clinical Application. Springer Science & Business Media, 2012, ISBN 978-1-4615-1857-0, S. 48– (google.com).


 French
French Deutsch
Deutsch