Nitroaniline – Wikipedia
Die Nitroaniline (selten: Nitraniline, Aminonitrobenzole) sind aromatische Verbindungen, die sich sowohl vom Anilin als auch vom Nitrobenzol ableiten. Durch unterschiedliche Anordnung (ortho, meta oder para) der Substituenten ergeben sich drei Konstitutionsisomere mit der Summenformel C6H6N2O2.
Vertreter
[Bearbeiten | Quelltext bearbeiten]| Nitroaniline | |||||
| Name | 2-Nitroanilin | 3-Nitroanilin | 4-Nitroanilin | ||
| Andere Namen | o-Nitroanilin, 1-Amino-2-nitrobenzol | m-Nitroanilin, 1-Amino-3-nitrobenzol, C.I. 37030 | p-Nitroanilin, 1-Amino-4-nitrobenzol | ||
| Strukturformel |  |  | |||
| CAS-Nummer | 88-74-4 | 99-09-2 | 100-01-6 | ||
| PubChem | 6946 | 7423 | 7475 | ||
| Summenformel | C6H6N2O2 | ||||
| Molare Masse | 138,13 g·mol−1 | ||||
| Aggregatzustand | fest | ||||
| Kurzbeschreibung | gelbe bzw. orange, fast geruchlose, kristalline Pulver | ||||
| Schmelzpunkt | 71 °C[1] | 114 °C[2] | 147 °C[3] | ||
| Siedepunkt | 284 °C[1] | Zers.[2] | 336 °C[3] | ||
| Dampfdruck[4] | 0,26 Pa (30 °C) | 0,15 Pa (30 °C) | 0,02 Pa (30 °C) | ||
| 1,89 Pa (50 °C) | 0,31 Pa (50 °C) | 0,05 Pa (50 °C) | |||
| pKS-Wert[5] der konjugierten Säure BH+ | −0,26 | 2,466 | 1,00 | ||
| Löslichkeit | 1,1 g/l (20 °C)[1] | 1,2 g/l (24 °C)[2] | 0,5 g/l (20 °C)[3] | ||
| schwerlöslich in Wasser, löslich in Ethanol, Ether und Chloroform | |||||
| GHS- Kennzeichnung |
| ||||
| H- und P-Sätze | 301+311+331‐373‐412 | ||||
| keine EUH-Sätze | |||||
| 273‐280‐301+310 302+352+312‐304+340+311‐314 | 273‐280‐301+310+330 302+352+312‐304+340+311‐314 | 273‐280‐304+340 302+352‐308+310 | |||
Darstellung
[Bearbeiten | Quelltext bearbeiten]3-Nitroanilin kann gewonnen werden durch:
- Reduktion von 1,3-Dinitrobenzol mit Natriumsulfid in wässriger Lösung
2-Nitroanilin kann zusammen mit 4-Nitroanilin gewonnen werden durch:[6]
- Nitrierung und Hydrolyse von Acetanilid (eine Schutzgruppe ist erforderlich, da sonst neben der Nitrierung auch Oxidationen eintreten)
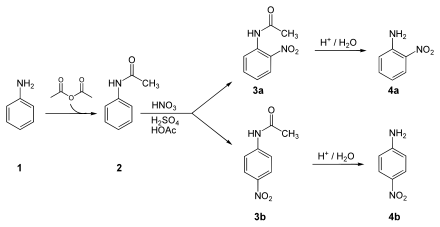
Synthese von 2-Nitroanilin bzw. 4-Nitroanilin:
Die NH2-Gruppe des Anilins (1) wird mittels Essigsäureanhydrid geschützt, dabei entsteht Acetanilid (2). Dieses wird unter Einwirken von Schwefelsäure, Salpetersäure sowie Essigsäure zu 2-Nitroacetanilid (3a) bzw. 4-Nitroacetanilid (3b) nitriert. Schließlich erfolgt die säurekatalysierte Abspaltung der Schutzgruppe, so dass man 2-Nitroanilin (4a) bzw. 4-Nitroanilin (4b) erhält.
- Erhitzen von 2- bzw. 4-Chlornitrobenzol mit alkoholischem Ammoniak
- Sulfonierung, Nitrierung und Hydrolyse von Oxanilid und Acetanilid[7]
Die weltweite Produktion beträgt etwa 20.000 bis 25.000 Tonnen pro Jahr.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Die Nitroaniline bilden gelbe bzw. orange kristalline Pulver. Sie sind schwerlöslich in Wasser, löslich in Ethanol, Ether und Chloroform.

Basizität
[Bearbeiten | Quelltext bearbeiten]Die Nitroaniline sind im Vergleich zum Anilin deutlich weniger basisch, was sich in den in der Tabelle angegebenen kleineren pKS-Werte der konjugierten Säuren BH+ ausdrückt. Der Grund hierfür ist die elektronenziehende Wirkung der Nitrogruppe (−M- und −I-Effekt), die die Elektronendichte am Stickstoff der Aminogruppe reduziert und so die Aufnahme eines Protons erschwert.
Schmelzpunkte
[Bearbeiten | Quelltext bearbeiten]Die Schmelzpunkte zeigen deutliche Unterschiede. Das 2-Nitroanilin besitzt den niedrigsten Schmelzpunkt, da es eine intramolekulare Wasserstoffbrücke ausbilden kann. Die beiden anderen Isomere bilden im Gegensatz dazu intermolekulare Wasserstoffbrücken aus. Das 4-Nitroanilin besitzt aufgrund seiner Symmetrie den höchsten Schmelzpunkt.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Nitroaniline werden fast ausschließlich als Zwischenprodukte zur Herstellung anderer organischer Verbindungen eingesetzt. So entstehen z. B. durch Hydrierung der Nitrogruppe die Phenylendiamine und durch Diazotierung Nitrobenzonitrile.
4-Nitroanilin ist z. B. Ausgangspunkt zur Synthese des Azofarbstoffs Pararot:[8]

Synthese von Pararot ausgehend von 4-Nitroanilin (1). Dieses reagiert nach Einwirken von Schwefelsäure und Natriumnitrit zu einem Diazoniumsalz (2), welches mit 2-Naphthol zum Pararot (3) gekuppelt wird.
4-Nitroanilin wurde als Echtrot GG Base und 2-Nitroanilin als Echtorange GR Base mit Naphthol AS für Entwicklungsfarbstoffe verwendet[9] und die entsprechenden stabilisierten Diazoniumsalze als Echtrot GG Salz[10], bzw. Echtorange GR Salz[11] vermarktet.
Derivate
[Bearbeiten | Quelltext bearbeiten]Einige Derivate des 3-Nitroanilins schmecken sehr süß. Das 1-Propoxy-2-amino-4-nitrobenzol hat eine Süßkraft von 4.100 in Bezug auf Saccharose und wurde einige Zeit unter dem Namen Ultrasüß P-4000 als Süßstoff verwendet, hat aber aus toxikologischen Gründen keine Bedeutung mehr.[12]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Nitroaniline sind giftig. Bei Kontakt von Nitroanilinen mit organischen Stoffen und Einwirkung von Feuchtigkeit kann eine spontane Entzündung erfolgen.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu o-Nitroanilin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Januar 2024. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu m-Nitroanilin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Januar 2024. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu p-Nitroanilin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 28. Januar 2024. (JavaScript erforderlich)
- ↑ H: Félix-Rivera, M.L. Ramírez-Cedeño, R.A. Sánchez-Cuprill, S.P. Hernández-Rivera: Triacetone triperoxide thermogravimetric study of vapor pressure and enthalpy of sublimation in 303–338 K temperature range, in: Thermochim. Acta, 514, 2011. S. 37–43 (doi:10.1016/j.tca.2010.11.034).
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Beyer/Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 533, 535–536.
- ↑ Louis Ehrenfeld, Milton Puterbaugh: o-Nitroaniline In: Organic Syntheses. 9, 1929, S. 64, doi:10.15227/orgsyn.009.0064; Coll. Vol. 1, 1941, S. 388 (PDF).
- ↑ J. R. Mohrig, T. C. Morrill, C. N. Hammond, D. C. Neckers: Synthesis 5: Synthesis of the Dye Para Red from Aniline ( vom 15. September 2020 im Internet Archive); in: Experimental Organic Chemistry Freeman: New York, NY, 1997; S. 456–467.
- ↑ M. Satake, Y. Mido: Chemistry of Colour. Discovery Publishing House, New Delhi 1995, ISBN 81-7141-276-9, S. 69 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Datenblatt 4-Nitrobenzenediazonium tetrafluoroborate bei Alfa Aesar, abgerufen am 29. Januar 2019 (Seite nicht mehr abrufbar).
- ↑ Datenblatt Fast Orange GR Salt bei Sigma-Aldrich, abgerufen am 29. Januar 2019 (PDF).
- ↑ H.-D. Belitz et al.: Lehrbuch der Lebensmittelchemie, 5. Aufl., Springer, Berlin u. a., 2001. S. 432.


 French
French Deutsch
Deutsch


