Mesomerer Effekt – Wikipedia
In der Chemie bezeichnet der mesomere Effekt (kurz: M-Effekt) eine elektronenschiebende Wirkung von funktionellen Gruppen in chemischen Verbindungen. Der M-Effekt wirkt durch konjugierte Systeme und beeinflusst Reaktionsgeschwindigkeiten, Ionengleichgewichte und die Stelle, an der ein Molekül reagiert (dirigierender Effekt).
Substituenten können nur dann einen mesomeren Effekt ausüben, wenn sie mit einem konjugierten System (ungesättigte Bindungen oder Atome mit freien Elektronenpaaren) verbunden sind. Dadurch wird das konjugierte System (auch: mesomere System) vergrößert. In diesem Fall hat der Erstsubstituent einen M-Effekt. Wenn der Substituent ein freies Elektronenpaar besitzt, das er für die Mesomerie zur Verfügung stellen kann, fügt er dem konjugierten System Elektronendichte hinzu, man spricht von einem +M-Effekt. Besitzt der Substituent hingegen eine Doppel- oder Dreifachbindung, so wird dem mesomeren System Elektronendichte entzogen; man spricht von einem −M-Effekt.
Der M-Effekt wirkt auf Reaktionsgeschwindigkeiten und Ionengleichgewichte, da die p-Orbitale (oder π-Bindungen) eines Substituenten mit dem Rest des Moleküls überlappen. Es kommt zur Delokalisierung oder deren Erweiterung.[1] Daneben gibt es den induktiven Effekt (+I-Effekt und −I-Effekt).
+M-Effekt
[Bearbeiten | Quelltext bearbeiten]
Der Substituent hat ein freies Elektronenpaar, das er für die Mesomerie zur Verfügung stellen kann. Bei +M-Effekten erhöht sich die Elektronendichte des mesomeren Systems. Eine eventuelle elektrophile Zweitsubstitution wird dadurch begünstigt, der +M-Effekt wirkt somit aktivierend in Bezug auf Reaktivität. Bei Halogenen als Erstsubstituenten an aromatischen Systemen ist die Substitutionsgeschwindigkeit allerdings aufgrund des −I-Effektes insgesamt herabgesetzt, dennoch wird durch den +M-Effekt weiter in ortho/para-Stellung dirigiert (siehe Substitutionsmuster).
Beispiel: Reaktion von Brom und Benzol: Benzol enthält ein mesomeres System und Brom hat drei freie Elektronenpaare. Nach der Substitution ist Brom mit einer Einfachbindung an ein Kohlenstoffatom des Benzols gebunden. Ein freies Elektronenpaar des Broms kann in die Mesomerie einbezogen werden, wodurch sich neue mesomere Grenzstrukturen ergeben.
Substituenten mit +M-Effekt
[Bearbeiten | Quelltext bearbeiten]−M-Effekt
[Bearbeiten | Quelltext bearbeiten]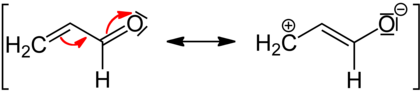
Bei −M-Effekten wird dem mesomeren System Elektronendichte entzogen, da der Substituent eine Doppel- oder Dreifachbindung besitzt. Das erschwert weitere Substitutionen bzw. setzt die Aktivierungsenergie, die dazu nötig ist, herauf. Der −M-Effekt wirkt also aus reaktionskinetischer Sicht deaktivierend. Außerdem wirken die folgenden Gruppen bei aromatischen Systemen für einen elektrophilen Angriff meta-dirigierend (siehe Substitutionsmuster). Dort befindet sich die größte Elektronendichte, da durch den Elektronenentzug aus dem aromatischen System die ortho- und para-Position eine positive Ladung trägt.
Substituenten mit −M-Effekt
[Bearbeiten | Quelltext bearbeiten]Säurestärke
[Bearbeiten | Quelltext bearbeiten]Substituenten mit −M-Effekt bewirken eine Erhöhung der Säurestärke von aromatischen, aciden Verbindungen, da der Substituent dem konjugierten System Elektronendichte entzieht. Beispielsweise sind Nitrophenole im Vergleich zu Phenol (pKs = 9,99) stärkere Säuren. Trinitrophenol erreicht einen pKs-Wert von 0,29. Das liegt daran, dass alle drei Nitro-Gruppen (–NO2) wie oben aufgelistet, einen −M-Effekt haben. Durch Mesomerie werden dem Benzolring Elektronen entzogen, sodass dieser in ortho-/para-Stellung positiv geladen ist. Da die Hydroxygruppe ihrerseits diesen Elektronenmangel durch ihr ungebundenes Elektronenpaar ausgleichen kann, überträgt sich diese positive Ladung auf den Sauerstoff. Diese instabile Situation strebt danach das Wasserstoffion abzuspalten, damit der Sauerstoff die Bindungselektronen für sich einbehalten kann und nicht mehr positiv geladen ist. Im Weiteren wirkt der doppelt an den Benzolring gebundene Sauerstoff ebenfalls einen −M-Effekt aus, sodass das resultierende Anion mesomeriestabilisiert ist. Das heißt, es ist nicht eindeutig, an welchen Sauerstoffatomen sich die negative Ladung befindet.
Basenstärke
[Bearbeiten | Quelltext bearbeiten]Bei einem aromatischen Ring, an dem sich eine Aminogruppe befindet, werden aufgrund des +M-Effektes Elektronen in den Ring gedrückt. So wird die funktionelle Gruppe positiver, der pKb-Wert steigt insgesamt für diese Verbindung. Das heißt, die „Basenstärke“ nimmt ab.
Dirigierender Effekt
[Bearbeiten | Quelltext bearbeiten]Mesomere Effekte beeinflussen auch, an welcher Position – also an welchem Atom – eine weitere Reaktion wahrscheinlich ablaufen wird. Bei der elektrophilen Zweitsubstitution am Benzolring „dirigieren“ (= „bestimmen“) die Erstsubstituenten die Position der weiteren. Im Allgemeinen kann man sagen, dass Erstsubstituenten, die einen +M-Effekt haben in ortho/para-Stellung dirigieren, solche mit −M-Effekt in meta-Stellung. Dies kann durch die Stabilität der während der Substitution auftretenden Übergangszustände erklärt werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu mesomeric effect. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.M03844 – Version: 2.1.5.


 French
French Deutsch
Deutsch