Metallorganische Gerüstverbindung – Wikipedia

Metallorganische Gerüste bzw. metallorganische Gerüstverbindungen (englisch metal-organic frameworks, MOFs) sind mikroporöse Materialien, die aus anorganischen Baueinheiten, den sogenannten Inorganic building units (IBUs, englisch für „anorganische Baueinheiten“) und organischen Molekülen als Verbindungselementen (englisch linkers) zwischen den anorganischen Baueinheiten aufgebaut sind.[1] Metall-organische Gerüste sind oft, aber nicht notwendigerweise, kristallin.[2] MOFs sind sogenannte Koordinationspolymere (genauer: Koordinationsnetzwerke[2]) mit einem offenen Gerüst, welches mögliche Poren enthält.[2][3][4] MOFs basieren üblicherweise auf Werner-Komplexen. Die Poren der dreidimensionalen Strukturen sind nach der Synthese meist mit Gastmolekülen (z. B. Lösungsmittel oder nicht umgesetzte Linker) gefüllt. Durch die Entfernung der Gastmoleküle (z. B. durch Ausheizen, im Vakuum oder durch Kombination von beidem) können die Poren unter Umständen zugänglich gemacht werden. Potentielle Anwendungsgebiete finden sich in Gasspeicherung (z. B. Wasserstoff, Methan), Stofftrennung, Sensorik und Katalyse.
Darstellung
[Bearbeiten | Quelltext bearbeiten]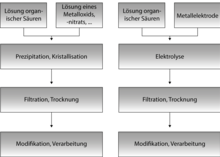
Solvothermalsynthesen
[Bearbeiten | Quelltext bearbeiten]Etwa 85 % der bekannten MOFs wurden mittels Solvothermalsynthesen dargestellt.[5] Solvothermalsynthesen finden in abgeschlossenen Reaktionsgefäßen, bei Temperaturen oberhalb des Siedepunktes des Lösungsmittels und hohen Drücken statt. Durch diese Bedingungen wird die Lösefähigkeit des Lösungsmittels erhöht, so dass auch schwer lösliche Stoffe für die Synthese verwendet werden können. In der Solvothermalsynthese können molekulare Baueinheiten verwendet werden und komplexe, metastabile Produkte wie MOFs erzeugt werden.
Hochdurchsatz-Methoden
[Bearbeiten | Quelltext bearbeiten]Hochdurchsatz-Methoden (HD-Methoden) sind ein Teilbereich der kombinatorischen Chemie und ein Werkzeug zur Effizienzsteigerung. Grundsätzlich gibt es zwei Synthesestrategien innerhalb der HD-Methoden: Zum einen den kombinatorischen Ansatz, hier laufen alle Reaktionen in einem Gefäß ab, was zu Produktgemischen führt und zum anderen die Parallelsynthese, hier laufen die Reaktionen in verschiedenen Gefäßen ab. Weiterhin wird zwischen dünnen Filmen und lösungsmittelbasierten Verfahren unterschieden.[6]
Dünne Filme werden durch verschiedenen Bedampfungsmethoden, wie z. B. Elektronenstrahl- und thermische Verdampfung oder chemische Transportreaktionen hergestellt. Klassische HD-Untersuchungen innerhalb der lösungsmittelbasierten Verfahren sind Solvothermal- und Sol-Gel-Synthesen.[6]

Solvothermalsynthesen können klassisch im Teflonreaktor in einem Umluftofen oder auch in Glasreaktoren in einem Mikrowellenofen (Hochdurchsatz-Mikrowellenofen, HDMW) durchgeführt werden. Die Verwendung eines Mikrowellenofens verändert die Reaktionsparameter, die notwendig sind, um zum gewünschten Produkt zu gelangen, zum Teil dramatisch.[7]
Hochdurchsatz-Solvothermalsynthesen im Teflonreaktor
[Bearbeiten | Quelltext bearbeiten]
Bei Hochdurchsatz-Solvothermalsynthesen wird ein Solvothermalreaktor mit (z. B.) 24 Hohlräumen für Teflonreaktoren verwendet (vgl. Abbildung rechts). Ein solcher Reaktor wird gelegentlich auch als Multiclav bezeichnet. Der Reaktorblock bzw. Reaktoreinsatz besteht aus rostfreiem Stahl und enthält 24 Reaktionskammern, die in vier Reihen angeordnet sind. Mit den miniaturisierten Teflonreaktoren können Volumina von bis zu 2 mL verwendet werden. Der Reaktorblock wird in einem Edelstahlautoklaven verschlossen; dazu wird der befüllte Reaktoreinsatz in die Reaktorunterseite eingesetzt, die Teflonreaktoren mit zwei Teflonfolien versiegelt und die Reaktoroberseite aufgesetzt. Der Autoklav wird dann in einer Hydraulikpresse verschlossen. Der versiegelte Solvothermalreaktor kann dann einem Temperatur-Zeit-Programm unterworfen werden. Die Mehrweg-Teflonfolie dient dazu der mechanische Beanspruchung zu widerstehen, während die Einweg-Teflonfolie die Teflonreaktoren abdichtet. Die alleinige Verwendung von Einweg-Teflonfolie führt dazu, dass sie unter der mechanischen Beanspruchung reißt und die Teflonreaktoren trockenlaufen, die gewünschte Reaktion kann so nicht ablaufen. Nach der Reaktion können die Produkte in einer Vakuumfiltervorrichtung parallel isoliert und gewaschen werden. Auf dem Filterpapier liegen die Produkte dann getrennt in einer sogenannten Probenbibliothek vor und können im Anschluss durch automatisierte Röntgenpulverbeugung charakterisiert werden. Die gewonnenen Informationen werden dann zur Planung weiterer Synthesen verwendet.[6][8]
Hochdurchsatz-Solvothermalsynthesen im Mikrowellenofen
[Bearbeiten | Quelltext bearbeiten]Mit der Reaktionslösung und einem Rührfisch befüllt wird ein kleiner Glasreaktor (z. B. mit 2 mL Volumen) mit einer Teflonkappe und einem Schraubdeckel verschlossen. Die Gefäße werden in einen Reaktionsblock aus Siliciumcarbid eingesetzt, welcher unter anderem eine gleichmäßige Wärmeverteilung ermöglicht. Abgedeckt mit einem Spritz- bzw. Explosionsschutz wird der Reaktionsblock im Mikrowellenofen positioniert, dann kann ein Temperatur-Zeit-Programm eingestellt werden. Die Isolierung der Produkte erfolgt wie beim Arbeitsablauf mit einem Teflonreaktor.
Epitaktisch wachsende MOFs – SURMOFs
[Bearbeiten | Quelltext bearbeiten]Ein neues Verfahren zur Herstellung metallorganischer Gerüste (MOFs) haben Forscher des Instituts für Funktionelle Grenzflächen (IFG) des KIT, der Jacobs University Bremen und weiterer Einrichtungen entwickelt. Hierbei wachsen die MOF-Strukturen epitaktisch, das heißt schichtweise, auf der Oberfläche von Substraten (SURMOFs, Surface Mounted Metal Organic Frameworks). So lassen sich Größe und Form der Poren ebenso wie deren chemische Funktionalität für die jeweilige Anwendung maßschneidern. Eine spezielle Methode, die Flüssigphasenepitaxie (LPE) gestattet es, auch Gerüststrukturen herzustellen, die sich mit den normalen nasschemischen Methoden nicht erzeugen lassen. Zur Herstellung dieser neuartigen, als SURMOFs 2 bezeichneten Serie von MOFs synthetisierten die Wissenschaftler verschiedene organische Moleküle unterschiedlicher Länge. Die Porengröße der neuen metallorganischen Gerüstverbindungen beträgt bis zu drei mal drei Nanometer. Die Forscher arbeiten daran, die Länge der organischen Streben noch weiter zu vergrößern, um noch größere Proteine und im nächsten Schritt sogar metallische Nanopartikel in die Gerüststrukturen einzubetten, was interessante Anwendungen in der Optik und Photonik ermöglichen würde.[9]
Postsynthetische Modifikation
[Bearbeiten | Quelltext bearbeiten]Einige MOFs können nicht synthetisiert werden, da sie in den möglichen Reaktionsbedingungen instabil sind. Eine Möglichkeit diese MOFs dennoch darzustellen sind postsynthetische Modifikationen, bei denen Linker und Metallionen nach der eigentlichen Synthese ausgetauscht werden. Der postsynthetische Austausch von Linkern und Metallionen ist ein wachsendes Forschungsgebiet und eröffnet daher die Möglichkeiten für komplexere Strukturen und erhöhte Funktionalität.[10]
Kristallinität und Kristallisationsprozess
[Bearbeiten | Quelltext bearbeiten]Hohe Temperaturen und ein hoher Druck innerhalb des Reaktionsgefäßes liefern generell gute Bedingungen für das Kristallwachstum, da Kristalldefekte (zu welchen MOFs neigen) wieder gelöst werden können.[11] Die Kristallisation kann heute durch Echtzeit-REM beobachtet werden.[12]
Modulatoren und Additive
[Bearbeiten | Quelltext bearbeiten]Modulatoren und Additive sind Stoffe, welche die Bildung des MOFs unterstützen sollen. Im Allgemeinen können Modulatoren entweder den Nukleationsprozess erleichtern oder in das Partikelwachstum eingreifen. Modulatoren, die bei der Herstellung von MOFs verwendet werden, können in zwei Hauptgruppen eingeteilt werden, nämlich in deprotonierende und koordinierende Modulatoren. Die Erstgenannten erleichtern die Bindung von Linkern an die metallischen Cluster durch Deprotonierung von Linker-Molekülen und beschleunigt entsprechend die MOF-Bildung, während Letztere in Konkurrenz zu den Linkern stehen und die Bildungsgeschwindigkeit verringern.[11] Koordinierende Modulationsmittel sind typischerweise Monocarboxylatmoleküle, die mit den Polycarboxylat-Gerüstbildungs-Linkern konkurrieren und zu Unterschieden in der Kristallgröße und -morphologie führen.[11] So führt beispielsweise der Einsatz von Ameisensäure in der Synthese von MIL-88A zu größeren Partikeln mit einer gleichmäßigeren Größenverteilung bei gleichzeitigem Verlust der Morphologie (diamantförmige Kristalle werden sphärisch).[11]
Typen
[Bearbeiten | Quelltext bearbeiten]Eine sinnvolle Einteilung von MOFs kann unter anderem anhand der verwendeten Linkermoleküle erfolgen.
Metallcarboxylate
[Bearbeiten | Quelltext bearbeiten]Metallcarboxylate sind metallorganische Gerüstverbindungen, die durch Koordination von Carboxylatliganden an Metallionen aufgebaut sind. Die Verfügbarkeit, Verbreitung und Vielfalt von Linkermolekülen mit deprotonierbaren Säuregruppen hat zu einer großen Vielfalt von metallorganischen Gerüstverbindungen geführt.[7]
Synthese
[Bearbeiten | Quelltext bearbeiten]Die Synthese wird üblicherweise unter hydrothermalen oder solvothermalen Bedingungen mit Reaktionszeiten im Bereich von wenigen Stunden bis zu mehreren Tagen durchgeführt. Wie bei MOFs üblich, umfasst die Entdeckung neuer Verbindungen das Screening diverser Reaktionsparameter wie pH-Wert, Temperatur, Konzentration, der Menge und Art an Mineralisatoren oder Kristallisationsmodulatoren (siehe dazu oben „Darstellung“).[7]

Linkermoleküle
[Bearbeiten | Quelltext bearbeiten]Als Anionen ihrer Säuren können carboxylatgruppenhaltige Moleküle als Liganden von Metallkationen eingesetzt werden, besonders häufig Anwendung finden Moleküle mit zwei oder mehr Carboxylat-Gruppen.
Dicarboxylat-Linker
[Bearbeiten | Quelltext bearbeiten]Als Dicarboxylat-Linker können unter anderem folgende Moleküle genutzt werden:[13]
- Terephthalsäure (z. B. in MOF-5, MIL-53[14], UiO-66 oder CAU-10)[7][15]
- 4,4′-Sulfonyldibenzoesäure (z. B. in IITKGP-6 oder CAU-11)
MOF-5 gilt als einer der am besten untersuchten MOFs, seine vereinfachte Summenformel ist Zn4O(BDC)3.[16] Die anorganische Baueinheit besteht aus einem Zn4O-Tetraeder. An jede Kante des Tetraeders bindet ein organischer Ligand (1,4-Benzoldicarboxyl, kurz BDC), das ergibt sechs BDC-Moleküle an jeder Zn4O-SBU. Mit den anderen Enden binden die BDC-Moleküle an weitere Zn4O-Cluster. Dadurch kommt ein regelmäßiges, kubisches Gitter zustande, bei dem die Zn4O-Cluster die Eckpunkte eines Würfels und die BDC-Moleküle die Kanten bilden. In den Hohlräumen im Inneren der Würfel bleiben Moleküle des Lösungsmittels, das zur Synthese verwendet wird, zurück. Das Lösungsmittel wird durch Erhitzen entfernt.[7][16]
Metallphosphonate
[Bearbeiten | Quelltext bearbeiten]Neben Carbonsäuren bieten sich auch Phosphonsäuren zum Aufbau von dreidimensionalen Gerüststrukturen an. Metallphosphonate (MPs) sind metallorganische Gerüstverbindungen, die durch Koordination von Phosphonatliganden an Metallionen aufgebaut werden. Durch die höhere Zahl an Ligandatomen und die stärkere Ladung im Vergleich zu Carboxylaten ist eine höhere chemische Stabilität zu erwarten. Durch die stärkere C-P-Bindung, im Vergleich zur C-C-Bindung, ist auch eine erhöhte thermische Stabilität zu erwarten. Dies sind aber auch die Gründe, warum Metallphosphonate dazu tendieren, dichte Ketten oder Schichtstrukturen zu bilden. Sie weisen daher auch eine geringe Löslichkeit in vielen Lösungsmitteln auf.[17][18]
Metallphosphonate zeichnen sich durch eine sehr flexible und komplexe Strukturchemie aus.[18]
Metallphosphonat-basierte Hybridmaterialien können ebenfalls Anwendung in verschiedensten Bereichen finden – beispielsweise für die Gasspeicherung und -trennung[19][20], als Katalysator[21] oder als Ionentauscher, in der Interkalationschemie und der Protonenleitung.[17]
Synthese
[Bearbeiten | Quelltext bearbeiten]Die Synthese von MPs ist MOF-typisch ein zeitaufwendiger Prozess. Es gilt zu beachten, dass jedes Phosphonat-System einzigartig reagiert und das Verhalten der Reaktionsmischung bisher nicht vorhersehbar ist.[17]
Linkermoleküle
[Bearbeiten | Quelltext bearbeiten]Als Phosphonat-Linker können unter anderem die Anionen folgender Moleküle eingesetzt werden:[17]
- N, N-Piperazindiphosphonsäure (z. B. bei MIL-91(Al) und MIL-91(Ti))
- Phenylphosphonsäure () (z. B. bei )
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Forschung an Metallphosphonaten wurde 1978 durch Alberti und Costantino et al. begründet. Sie stellten drei Zirkoniumphosphonate her: Zirkoniumphenylphosphonat, ; Zirkoniumhydroxymethylphosphonat, und Zirkoniumethylphosphat, .[17]
Gemischtfunktionelle Liganden
[Bearbeiten | Quelltext bearbeiten]Moleküle mit mehr als einer Art funktioneller Gruppe, welche das Metallzentrum koordinieren kann, werden gerne eingesetzt, um so die Eigenschaften des MOFs zu beeinflussen. Beispiele sind unter anderem:
- Funktionalisierte Porphyrin-Derivate (sog. Porphyrin basierte MOFs, kurz PMOFs)[22]
- 2,2′-Bipyridin-5,5′-Dicarbonsäure (z. B. der MOF Ga(OH)(bpydc), bekannt als COMOC-4 weist eine MOF-253-Topologie auf und besitzt lumineszente Eigenschaften)[23]
CD-MOFs
[Bearbeiten | Quelltext bearbeiten]CD-MOFs sind MOFs, die als Linker Cyclodextrine besitzen; als Konnektoren werden Alkalimetallkationen verwendet. Das wesentliche positive Merkmal von CD-MOFs ist in ihrer Ungiftigkeit, die sie für Anwendungen in der Medizin interessant macht, zum Beispiel als „Drug-Carrier“, d. h. zur Kapselung medizinischer Wirkstoffe bei der Verabreichung von Medikamenten.[24]
Zweidimensionale MOFs
[Bearbeiten | Quelltext bearbeiten]Seit der Entdeckung von Graphen im Jahr 2004 wurden mehrere zweidimensionale MOFs synthetisiert, die oft nur wenige Atomschichten dick sind. Dank der organisch-anorganischen Natur der Materialien sind zweidimensionale MOFs für verschiedene elektronische Anwendungen, insbesondere als Halbleiter, geeignet.[25]
Struktur
[Bearbeiten | Quelltext bearbeiten]
Die Struktur klassisch-anorganischer Festkörper, wie z. B. die ionischen Verbindung Natriumchlorid oder das Metall Kupfer, kann in der Regel mit zwei konkurrierenden, aber ansonsten komplementierenden Konzepten beschrieben werden. Das eine Modell basiert auf verbundenen Koordinationspolyedern, das andere auf (dichteste) Kugelpackungen. Diese Modelle sind allerdings nicht mehr anwendbar, sobald z. B. der Grad an Unregelmäßigkeiten oder die Porosität zunimmt. So werden bereits Zeolithe durch Ringe unterschiedlicher Größe charakterisiert, die im dreidimensionalen Kanäle und Käfige bilden. Die Art, wie diese Ringe räumlich verbunden sind, ist entscheidend für die Beschreibung wichtiger Eigenschaften, wie dem Absorptionsverhalten. Die Beschreibung der räumlichen Verbindung der Ringe erfolgt in der Netzwerktopologie (engl. network topology).[7]
Da MOFs aus SBUs und Linkern aufgebaut sind ergeben sich Myriaden von Möglichkeiten, ihre Beschreibung durch Typen verschiedener Netze (innerhalb der Netzwerktopologie) ist daher sinnvoll.[7]
Netzwerktopologie
[Bearbeiten | Quelltext bearbeiten]Die Beschreibung von MOFs erfolgt durch Netze. Ein Netz besteht aus den sogenannten Knotenpunkten bzw. Konnektoren, welche über die Linker verbunden sind. Die Knotenpunkte sind die anorganischen Baueinheiten in Form isolierter Metallatome oder Metall-Sauerstoff-Cluster. Ein leicht zugängliches Beispiel ist ein Bienenwabenmuster, welches ein 63-Netz darstellt: Jeder Knotenpunkt eines Sechsrings verbindet drei weitere Sechsringe.[1]
Heutzutage gibt es eine Vielzahl an verwendeten Methoden, um die Netze zu beschreiben, dies hat zu einer großen Verwirrung innerhalb der Forschung geführt.[13]
Verwendet werden unter anderem:[13]
- Schläfli-Symbole, inkl. langer Schläfli-Symbole
- Kristallographische Punktgruppen
- Vertex-Symbole
- Delaney-Symbole
- Der drei-Buchstaben Code der RCSR-Datenbank
Struktur der anorganischen Baueinheiten
[Bearbeiten | Quelltext bearbeiten]Die anorganischen Baueinheiten können aus isolierten Metallatomen, Metall-Sauerstoff-Cluster, -Ketten oder -Schichten bestehen.[1] Strukturelle Besonderheiten können hier zum Beispiel verbrückende Hydroxidgruppen (μ-OH) sein.
Strukturelle Dimensionen
[Bearbeiten | Quelltext bearbeiten]In der Literatur findet man zur strukturellen Beschreibung von MOFs häufig Ausdrücke wie „0D-Struktur“, „unendliche 1D-Strukturen (Ketten)“ oder „unendliche 2D-Strukturen (Schichten)“.[26] Diese Bezeichnungen sind allerdings falsch, da eine „niedrigdimensionale“ Struktur per Definition eine Struktur ist, die in einen niedrigdimensionalen Raum eingebettet werden kann.[26] Die am häufigsten beschriebenen Ketten und Schichten sind keineswegs ein- bzw. zweidimensional, da sie eine endliche Breite ungleich Null haben und nicht in einen ein- oder zweidimensionalen Raum eingebettet werden können.[26] Es handelt sich um dreidimensionale Objekte, denen jedoch die Periodizität entlang zweier bzw. einer Richtung des Raums fehlt.[26] Dementsprechend wird ihre Symmetrie durch eine subperiodische Gruppe, nämlich eine Ketten- bzw. Schichtgruppe, beschrieben.[26] Die korrekten Bezeichnungen sind „nichtperiodisch“ (0P), „monoperiodisch“ (1P) und „diperiodisch“ (2P).[26]
Breathing effect
[Bearbeiten | Quelltext bearbeiten]Beim sog. „breathing effect“ (deutsch Atmungseffekt, Atmung) handelt es sich um das Phänomen, dass sich in einzelnen MOFs die kristallographischen Zellparameter in Abhängigkeit äußerer Parameter verändern.[1] Diese strukturelle Flexibilität stellt eine intensiv erforschte Eigenschaft von MOFs dar.[27] Äußere Parameter, die das Atmen auslösen können, sind Temperatur- oder Druckänderung und die Anwesenheit oder Abwesenheit von adsorbierten Gastmolekülen. Dabei bricht die Atmung keine kovalenten Bindungen, auch bleibt die Gesamttopologie des MOFs erhalten, alle strukturellen Änderungen sind reversibel. Innere Parameter, die das Atmen auslösen sind allgemein abhängig von:[12]
- Der Art des Metallkations in den Ketten
- Der chemischen Natur der verschiedenen Gastmoleküle;
- Der Stärke der Wirt-Gast-Wechselwirkungen innerhalb der Poren
Im Speziellen kann es nur dann zum breathing effect kommen, wenn Schwachstellen im Gerüst vorhanden sind. Drei Arten von Schwachstellen sind möglich:[27]
- Isomerisierung des Linkers (z. B. bei CAU-10-H oder CAU-13).
- Rotation des Liganden um die O-O-Achse der Carboxylatgruppen (englisch kneecap mechanism, deutsch Kniescheibenmechanismus, unter anderem zu beobachten bei MIL-53).
- Verschiebung miteinander verwobener Netze (vgl. Katenation).
Ändert sich lediglich das Zellvolumen, nicht aber die anderen kristallographischen Zellparameter wird eher von „flexiblen Strukturen“ als vom „Atmen“ gesprochen.
Katenation
[Bearbeiten | Quelltext bearbeiten]Die Katenation (von lateinisch catena ‚Kette‘) beschreibt das sich gegenseitig Durchdringen von zwei oder mehr Netzwerken, dabei nimmt die Porosität der Verbindung in der Regel ab. Kommt es zwischen den Netzen allerdings zu starken Wechselwirkungen, so verringern sie ihren Abstand zueinander, was zu einer Stabilisierung der Verbindung bei gleichzeitig kaum verringerter Porosität führt.[1]
Nomenklatur
[Bearbeiten | Quelltext bearbeiten]
Für Materialien, die der Klasse der porösen Metall-organischen Gerüstverbindungen angehören hat sich etabliert, statt der wenig aussagekräftigen Summenformeln Akronyme zu verwenden. Neben dem Akronym MOF gibt es noch eine große Vielfalt an anderen Kurzbezeichnungen, die oft aus der Bezeichnung der Forschungseinrichtung, der Orte derselben, Firmennamen oder der Ligandengruppen bestehen. So steht z. B. MIL für Matériaux de l'Institut Lavoisier,[28] ZIF (= Zeolitic Imidazolate Frameworks),[29] IRMOF (= IsoReticular Metal-Organic Framework),[30] HKUST (= Hong Kong University of Science & Technology),[31] COF (= Covalent Organic Frameworks),[32] BAF (= BergAkademie Freiberg Framework)[33] MFU (= Metal–Organic Framework Ulm University)[34] TOF (= Thorium Organic Framework)[35] oder CAU (= Christian-Albrechts-Universität). Nicht jeder MOF muss also auch „MOF“ heißen. Einige bekannte MOF-Strukturen sind MOF-5, MOF-177, HKUST-1, MIL-53, BAF-4 und MFU-1.
Unterscheidung von Zeolithen
[Bearbeiten | Quelltext bearbeiten]Im Gegensatz zu Zeolithen, also anorganischen Kristallen mit Poren ähnlicher Größe, sind MOFs weniger temperaturbeständig. Allerdings wird erwartet, dass die vielfältigen Möglichkeiten der organischen Chemie zu einer größeren Vielfalt von Materialien als bei Zeolithen führen wird, und auch die geringere Massendichte ist für manche Anwendungen von Vorteil. Ferner sind die meisten MOFs elektrisch neutral, während Zeolithe negativ geladen sind. Dies führt unter anderem zu einer erleichterten Aktivierung der Materialien.[36]
Zeolithe mit Porengrößen von mehr als 1 nm sind selten, enantiomerenreine Zeolithe existieren bis heute nicht.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Für mögliche Anwendungen als Katalysatoren ist die große innere Oberfläche (bis über 4500 m²/g beim MOF-177) von Bedeutung. Die Porengröße kann über die Größe der organischen Liganden exakt festgelegt werden, so dass nur Reaktanten einer bestimmten Größe hinein passen. Dadurch kann eine hohe Selektivität erwartet werden.
Einige MOFs weisen sehr gute Adsorptionseigenschaften auf, diese machen sie interessant für den Einsatz in Adsorptionskältemaschinen. In einer Adsorptionskältemaschine wird Wärme, bzw. Kälte durch Adsorption bzw. Verdampfen eines Lösungsmittels erzeugt. Dazu wird das System in zwei Teilsysteme geteilt, in dem einen befindet sich ein Lösungsmittel (z. B. Wasser) und in dem anderen der MOF. Beide Teilsysteme sind durch ein Verbindungsrohr mit Ventil verbunden, wird das Ventil geöffnet, so kann Lösungsmittel verdampfen und entzieht der Umgebung Wärme (Verdampfungsenthalpie), während bei der Adsorption des Lösungsmittels am MOF Wärme frei wird (Adsorptionsenthalpie).[37]
Wasserstoffspeicher
[Bearbeiten | Quelltext bearbeiten]Wasserstoff weist unter den Kraftstoffen die höchste massebezogene Energiedichte auf. Auf das Volumen bezogen ist jedoch die Energiedichte unkomprimierten, gasförmigen Wasserstoffs sehr gering. Für die Wasserstoffspeicherung und den Transport sind deshalb energieintensive Kompressions- und Verflüssigungsprozesse erforderlich.[38][39]
Daher ist die Entwicklung neuer Wasserstoffspeichermethoden, die den erforderlichen Speicherdruck verringern, ein aktives Forschungsgebiet.
MOFs fallen als Materialien für die adsorptive Wasserstoffspeicherung aufgrund ihrer hohen spezifischen Oberfläche und ihres Verhältnisses von Oberfläche zu Volumen sowie ihrer modifizierbaren Strukturen auf.[40]

Im Vergleich zu einer leeren Gasflasche kann eine mit MOF gefüllte Gasflasche bei einem bestimmten Druck mehr Wasserstoff speichern, da Wasserstoffmoleküle an der Oberfläche von MOFs adsorbieren, darüber hinaus sind MOFs frei von Totvolumen. Da die Wasserstoffadsorption hauptsächlich auf der Physisorption beruht, weisen viele MOFs ein vollständig reversibles Aufnahme- und Freisetzungsverhalten auf. Bei der Freisetzung des adsorbierten Wasserstoffs sind keine großen Aktivierungsbarrieren erforderlich. Die Wasserstoff-Speicherkapazität eines MOF ist durch die Flüssigphasendichte von Wasserstoff begrenzt, da die Vorteile von MOFs nur dann erzielt werden können, wenn sich der Wasserstoff in seinem gasförmigen Zustand befindet.[41]
Inwieweit ein Gas an der Oberfläche eines MOF adsorbieren kann, hängt von der Temperatur und dem Druck des Gases ab. Im Allgemeinen nimmt die Adsorption mit abnehmender Temperatur und zunehmendem Druck zu (bis ein Maximum bei (typischerweise) 20 bis 30 Bar erreicht ist, wonach die Adsorptionskapazität wieder abnimmt).[41]
Das US-Energieministerium (Department of Energy, DOE) hat eine Liste der jährlichen technischen Systemziele für die Speicherung von Wasserstoff in leichten Brennstoffzellenfahrzeugen veröffentlicht, die die Forscher auf diesem Gebiet anleitet (2017: 5,5 Gew.-% pro 40 g/L).[42] Ein Benchmark-Material ist MOF-177, in dem 7,5 Gew.-% Wasserstoff mit einem Fassungsvermögen von 32 g/L bei 77 K und 70 Bar gespeichert werden können. MOF-177 besteht aus [Zn4O]6+-Clustern und weist eine gemessene BET-Oberfläche von 4630 m2/g auf.[43]
Design-Prinzipien
[Bearbeiten | Quelltext bearbeiten]Die praktische Anwendung von MOFs zur Wasserstoffspeicherung ist mit mehreren Herausforderungen verbunden. Für eine Wasserstoffadsorption nahe Raumtemperatur müsste beispielsweise die Adsorptionsenergie erheblich erhöht werden.[38]
MOFs mit Carboxylatlinkern haben in der Forschung bei weitem die meiste Aufmerksamkeit erhalten, weil:[38]
- sie einfach zu synthetisieren und
- in situ leicht zu deprotonieren sind,
- die Metall-Carboxylat-Bindungsbildung reversibel ist, was die Bildung von gut geordneten kristallinen MOFs erleichtert und
- die Fähigkeit zur verbrückenden zweizähnigen Koordination einen hohen Ordnungsgrad begünstigt.
Die häufigsten Übergangsmetallionen, die in carboxylatbasierten MOFs verwendet werden, sind Cu2+ und Zn2+.[38]
Be12(OH)12(BTB)4 ist der erste erfolgreich synthetisierte und strukturell charakterisierte MOF, der aus einem leichten Hauptgruppenmetallion besteht und eine hohe Wasserstoffspeicherkapazität aufweist. Die Verbindung ist jedoch zu toxisch, um praktisch eingesetzt zu werden.[44] Aufgrund vielversprechender Eigenschaften werden jedoch erhebliche Anstrengungen unternommen, um MOFs zu entwickeln, die aus anderen leichten Hauptgruppenmetallionen bestehen.[44]
Katalyse
[Bearbeiten | Quelltext bearbeiten]MOFs können als heterogene Katalysatoren genutzt werden, verantwortlich dafür sind ihre große Oberfläche, die einstellbare Porosität und die Mannigfaltigkeit der chemischen Zusammensetzung.
Zeolithe sind in der Katalyse bereits außerordentlich nützlich und in kommerziellen Anwendungen realisiert, allerdings ist die strukturelle Vielfalt der Zeolithe durch die geringe Variabilität in der Koordinierung begrenzt (es sind weniger als 200 Zeolithe bekannt). Im Gegensatz dazu weisen MOFs eine große strukturelle Vielfalt durch vielfältigere Koordinationsgeometrien, polytope Linker und Hilfsliganden (unter anderem F−, OH− und H2O) auf. Des Weiteren ist es schwierig, Zeolithe mit Porengrößen von mehr als 1 nm zu erhalten, das beschränkt die katalytischen Anwendungen von Zeolithen auf relativ kleine organische Moleküle (typischerweise nicht größer als Xylole); darüber hinaus können Zeolithe immer noch nicht in enantiomerenreiner Form erhalten werden, was ihre Anwendung in der katalytischen asymmetrischen Synthese, z. B. für die pharmazeutische, agrochemische und Duftstoffindustrie, ausschließt. Enantiomerenreine chirale Liganden und deren Metallkomplexe wurden dagegen bereits in MOFs eingebaut, um effiziente asymmetrische Katalysatoren zu erhalten.
Einschluss katalytisch aktiver Edelmetallnanopartikel
[Bearbeiten | Quelltext bearbeiten]In porösen Katalysatoren sind koordinativ ungesättigte Metallionen (engl. coordinatively unsaturated metal sites, CUSs) von großem Vorteil, denn diese Stellen ermöglichen starke Wechselwirkungen mit eingeschlossenen Gasen oder die Koordinierung organischer Moleküle.[45] Der Einschluss von katalytisch aktiven Edelmetallen kann durch einen mehrstufigen Prozess erreicht werden: Zunächst werden dazu freie Koordinationsstellen in den Poren des MOFs durch die Entfernung von Hilfsliganden erzeugt, das Einführen eines neuen Hilfsmoleküls erlaubt im Folgenden die Koordination von anionischen Edelmetallsalzen in den Poren, abschließend wird das Edelmetallkation reduziert.[46]
Das Einführen des neuen Hilfsmoleküls wird auch als Aufpfropfen (engl. grafting) bezeichnet, gemeint ist damit die Koordinierung funktioneller Gruppen (wie Amin-Gruppen) von organischen Molekülen an die freien Koordinationsplätze des Metallzentrums des MOFs.[46]
Funktionalisierung von MIL-101
[Bearbeiten | Quelltext bearbeiten]Der Chrom(III)-Terephthalat-MOF mit der Bezeichnung MIL-101 (Cr3(F,OH)-(H2O)2O[(O2C)-C6H4-(CO2)]3 · n H2O (n ≈ 25)) besitzt zwei Arten von mesoporösen Poren mit Durchmessern von ca. 29 und 34 Å, die durch zwei mikroporöse Fenster von ca. 12 und 16 Å zugänglich sind. Dadurch ergeben sich sehr große BET- und Langmuir-Oberflächen (4100 m2 g−1 ± 200 m2 g−1; 5900 m2 g−1 ± 300 m2 g−1) und zahlreiche potentiell freie Koordinationsstellen (bis zu 3,0 mmol/g) am Chromkation.[46]
Dadurch ist es möglich MIL-101 zunächst zu funktionalisieren, um dann katalytisch aktive Edelmetallnanopartikel einzuführen; dies kann wie folgt geschehen:[46]
- Herstellung der freien Koordinationsstellen (CUSs) durch das Ausheizen des endständigen Hilfsliganden (Wasser) im Vakuum. Da der endständige Hilfsligand auf das Zentrum der Käfige/Poren gerichtet ist, sind es die CUSs ebenfalls.
- Koordinierung von Aminen (wie z. B. Ethylendiamin (ED)) an die koordinativ ungesättigten Stellen des Chromkations im dehydratisierten MIL-101, sodass sich ED-MIL-101 ergibt. Die ED-Moleküle zeigen nun zur Mitte der Poren.
- Einkapseln von Edelmetallen in ED-MIL-101: Das Verkapselungsverfahren umfasst die Protonierung der Amin-Gruppen in den Poren (ED) mit einer wässrigen HCl-Lösung, die Reaktion der positiv geladenen Ammonium-Oberflächengruppen mit anionischen Edelmetallsalzen (z. B. [PdCl4]2-, [PtCl6]2- und [AuCl4]-) durch den Austausch der Chloridanionen und schließlich die Reduktion der Edelmetallkationen mit NaBH4. In den ED-MIL-101-Poren befinden sich dann das entsprechende elementare Edelmetall (ca. 1 Gew.-%).
ED-MIL-101 ist bis ca. 200 °C stabil und damit als möglicher Katalysator für die Knoevenagel-Kondensation geeignet. In der Tat zeigt ED-MIL-101 eine bemerkenswert hohe Aktivität (und Selektivität) in der Knoevenagel-Kondensation von Benzaldehyd und Cyanessigsäureethylester zu Ethyl-trans-α-cyanocinnamat.[46] ED-MIL-101 kann durch Filtration leicht aus der Reaktionssuspension isoliert werden und ohne nennenswerten Aktivitätsverlust wiederverwendet werden.[46]
Weitere zur Katalyse funktionalisierte MOFs
[Bearbeiten | Quelltext bearbeiten]In einem anderen Beispiel ermöglichen Pd-Nanopartikel, die in ein defektes HKUST-1-Gerüst eingebettet sind, die Erzeugung abstimmbarer Lewis-basischer Stellen, daher ist dieses Pd/MOF-Komposit in der Lage, eine schrittweise Oxidation von Benzylalkohol und eine Knoevenagel-Kondensation durchzuführen.[47]
Wassergewinnung
[Bearbeiten | Quelltext bearbeiten]Eine bereits kommerziell genutzte Anwendung von MOFs ist die Gewinnung von Wasser aus der Luft. Mithilfe des Aluminium-basierten MOF-303 gelang es, selbst in Wüstenregionen nutzbares Wasser aus der Luftfeuchtigkeit zu gewinnen. Zum Zeitpunkt der Veröffentlichung 2019 können mit einem Kilogramm MOF-303 bis zu 1,3 Liter Wasser pro Tag gewonnen werden. Die Erfinder gehen allerdings von einer zukünftigen Steigerung auf acht bis zehn Liter pro Tag aus.[48][49] Die Anlagen übersteigen damit die Wassergewinnungskapzitäten historischer Luftbrunnen bei weitem.
Elektronische und opto-elektronische Anwendungen
[Bearbeiten | Quelltext bearbeiten]2018 wurde der zweidimensionale MOF-Halbleiter Fe3(THT)2(NH4)3, auch bekannt als THT, 2,3,6,7,10,11-triphenylenehexathiol, synthetisiert. Das Material zeigte bei Raumtemperatur eine hohe Elektronenbeweglichkeit von 220 cm2 V−1 s−1, vergleichbar mit etablierten 2D-Halbleitern.[50] 2020 wurde dieses Material zum ersten Mal als Photodetektor zur Entdeckung von Wellenlängen vom UV- bis in den Nah-Infrarotbereich (400–1575 nm) eingesetzt.[51][52]
Charakterisierung
[Bearbeiten | Quelltext bearbeiten]Zur Charakterisierung eines MOFs stehen unter anderem folgende Methoden zur Verfügung:
- Schwingungsspektroskopie
- Röntgenpulverbeugung
- Röntgeneinkristallbeugung
- CHNS-Elementaranalyse
- Thermogravimetrie
- Sorptionsmessung
Besondere Merkmale
[Bearbeiten | Quelltext bearbeiten]IR-Spektroskopie
[Bearbeiten | Quelltext bearbeiten]Treten in der anorganischen Baueinheit des MOFs verbrückende Hydroxidgruppen auf (μ-OH) so ist eine scharfe OH-Bande bei ca. 3500 cm−1 zu beobachten. Ist die verbrückende Hydroxidgruppe darüber hinaus in Wasserstoffbrückenbindungen involviert so verbreitert sich die Bande (z. B. bei CAU-11 der Fall, dort werden die Schichten des MOFs durch Wasserstoffbrückenbindungen zwischen verbrückenden Hydroxid-Ionen und Sulfonylgruppen zusammengehalten.[53])
Literatur
[Bearbeiten | Quelltext bearbeiten]- Stefan Kaskel: Poren per Baukasten. ( vom 6. Oktober 2007 im Internet Archive) In: Nachrichten aus der Chemie. 53, April 2005, S. 394–399.
- A. Breitruck, H. E. Hoster, R. J. Behm: Short-range order in a metal-organic network. In: J. Phys. Chem. C. 113, 2009, S. 21265–21268. (PDF; 7,2 MB) ( vom 25. Mai 2010 im Internet Archive)
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Sebastian Bauer, Norbert Stock: MOFs – Metallorganische Gerüststrukturen. Funktionale poröse Materialien. In: Chemie in unserer Zeit. Band 42, Nr. 1, Februar 2008, S. 12–19, doi:10.1002/ciuz.200800434.
- ↑ a b c Stuart R. Batten, Neil R. Champness, Xiao-Ming Chen, Javier Garcia-Martinez, Susumu Kitagawa: Terminology of metal–organic frameworks and coordination polymers (IUPAC Recommendations 2013). In: Pure and Applied Chemistry. Band 85, Nr. 8, 31. Juli 2013, S. 1715–1724, doi:10.1351/pac-rec-12-11-20.
- ↑ Ulrich Stoeck: Neue, poröse metallorganische Gerüstverbindungen und organometallische Koordinationspolymere: Darstellung, Charakterisierung und Evaluierung ihres Potentials für die Gasspeicherung und Katalyse. Hrsg.: Lehrstuhl für anorganische Chemie I der Technischen Universität zu Dresden. Dresden Juni 2013, S. 5.
- ↑ IUPAC Provisional Recommendations on Metal-Organic Framework and Coordination Polymer Terminology – CrystEngComm Blog. Abgerufen am 26. August 2018 (amerikanisches Englisch).
- ↑ Chandan Dey, Tanay Kundu, Bishnu P. Biswal, Arijit Mallick, Rahul Banerjee: Crystalline metal-organic frameworks (MOFs): synthesis, structure and function. In: Acta Crystallographica Section B Structural Science, Crystal Engineering and Materials. Band 70, Nr. 1, 1. Februar 2014, S. 3–10, doi:10.1107/S2052520613029557.
- ↑ a b c Sebastian Bauer, Norbert Stock: Hochdurchsatz-Methoden in der Festkörperchemie. Schneller zum Ziel. In: Chemie in unserer Zeit. Band 41, Nr. 5, Oktober 2007, S. 390–398, doi:10.1002/ciuz.200700404.
- ↑ a b c d e f g Stefan Kaskel: The Chemistry of Metal-Organic Frameworks : Synthesis, Characterization, and Applications. Wiley, 2016, ISBN 978-3-527-69308-5, S. 6–7.
- ↑ Enrica Biemmi, Sandra Christian, Norbert Stock, Thomas Bein: High-throughput screening of synthesis parameters in the formation of the metal-organic frameworks MOF-5 and HKUST-1. In: Microporous and Mesoporous Materials. Band 117, Nr. 1–2, 2009, S. 111–117, doi:10.1016/j.micromeso.2008.06.040.
- ↑ Jinxuan Liu, Binit Lukose, Osama Shekhah, Hasan Kemal Arslan, Peter Weidler, Hartmut Gliemann, Stefan Bräse, Sylvain Grosjean, Adelheid Godt, Xinliang Feng, Klaus Müllen, Ioan‐Bogdan Magdau, Thomas Heine, Christof Wöll: A novel series of isoreticular metal organic frameworks: realizing metastable structures by liquid phase epitaxy. In: Nature Scientific Reports 2, Article number: 921. 2012, doi:10.1038/srep00921.
- ↑ Sunirban Das, Hyunuk Kim, Kimoon Kim: Metathesis in Single Crystal: Complete and Reversible Exchange of Metal Ions Constituting the Frameworks of Metal−Organic Frameworks. In: Journal of the American Chemical Society. Band 131, Nr. 11, 25. März 2009, S. 3814–3815, doi:10.1021/ja808995d.
- ↑ a b c d Elham Bagherzadeh, Seyed Mojtaba Zebarjad, Hamid Reza Madaah Hosseini: Morphology Modification of the Iron Fumarate MIL-88A Metal-Organic Framework Using Formic Acid and Acetic Acid as Modulators. In: European Journal of Inorganic Chemistry. Band 2018, Nr. 18, 11. Mai 2018, S. 1909–1915, doi:10.1002/ejic.201800056.
- ↑ a b Thierry Loiseau, Christophe Volkringer, Mohamed Haouas, Francis Taulelle, Gérard Férey: Crystal chemistry of aluminium carboxylates: From molecular species towards porous infinite three-dimensional networks. In: Comptes Rendus Chimie. Band 18, Nr. 12, Dezember 2015, S. 1350–1369, doi:10.1016/j.crci.2015.08.006.
- ↑ a b c Stefan Kaskel: The Chemistry of Metal-Organic Frameworks : Synthesis, Characterization, and Applications. Band 1. Wiley, 2016, ISBN 978-3-527-69308-5, S. 11–12.
- ↑ Franck Millange, Richard I. Walton: MIL-53 and its Isoreticular Analogues: a Review of the Chemistry and Structure of a Prototypical Flexible Metal-Organic Framework. In: Israel Journal of Chemistry. Band 58, Nr. 9–10, Oktober 2018, S. 1019–1035, doi:10.1002/ijch.201800084.
- ↑ Felix Steinke, Norbert Stock: Synthesis and properties of a new vanadium benzene‐1,3‐diphosphonate. In: Zeitschrift für anorganische und allgemeine Chemie. 24. Juni 2022, doi:10.1002/zaac.202200167.
- ↑ a b Steffen Hausdorf, Jörg Wagler, Regina Moßig, Florian O. R. L. Mertens: Proton and Water Activity-Controlled Structure Formation in Zinc Carboxylate-Based Metal Organic Frameworks. In: The Journal of Physical Chemistry A. Band 112, Nr. 33, 1. August 2008, S. 7567–7576, doi:10.1021/jp7110633, PMID 18652430.
- ↑ a b c d e Stephen J.I. Shearan, Norbert Stock, Franziska Emmerling, Jan Demel, Paul A. Wright, Konstantinos D. Demadis, Maria Vassaki, Ferdinando Costantino, Riccardo Vivani, Sébastien Sallard, Inés Ruiz Salcedo, Aurelio Cabeza, Marco Taddei: New Directions in Metal Phosphonate and Phosphinate Chemistry. In: Crystals. Band 9, Nr. 5, 24. Mai 2019, S. 270, doi:10.3390/cryst9050270.
- ↑ a b Abraham Clearfield: Metal Phosphonate Chemistry. In: Progress in Inorganic Chemistry. John Wiley & Sons, Inc., Hoboken, NJ, USA 2007, ISBN 978-0-470-16648-2, S. 371–510.
- ↑ Michael T. Wharmby, Gordon M. Pearce, John P. S. Mowat, John M. Griffin, Sharon E. Ashbrook: Synthesis and crystal chemistry of the STA-12 family of metal N,N′-piperazinebis(methylenephosphonate)s and applications of STA-12(Ni) in the separation of gases. In: Microporous and Mesoporous Materials (= Metal Organic Frameworks). Band 157, 15. Juli 2012, S. 3–17, doi:10.1016/j.micromeso.2011.12.003.
- ↑ Michael T. Wharmby, John P. S. Mowat, Stephen P. Thompson, Paul A. Wright: Extending the Pore Size of Crystalline Metal Phosphonates toward the Mesoporous Regime by Isoreticular Synthesis. In: Journal of the American Chemical Society. Band 133, Nr. 5, 9. Februar 2011, S. 1266–1269, doi:10.1021/ja1097995.
- ↑ Matthias J. Beier, Wolfgang Kleist, Michael T. Wharmby, Reinhard Kissner, Bertram Kimmerle: Aerobic Epoxidation of Olefins Catalyzed by the Cobalt-Based Metal–Organic Framework STA-12(Co). In: Chemistry – A European Journal. Band 18, Nr. 3, 2012, S. 887–898, doi:10.1002/chem.201101223.
- ↑ Alex Aziz, A. Rabdel Ruiz-Salvador, Norge C. Hernández, Sofia Calero, Said Hamad: Porphyrin-based metal-organic frameworks for solar fuel synthesis photocatalysis: band gap tuning via iron substitutions. In: Journal of Materials Chemistry A. Band 5, Nr. 23, 2017, S. 11894–11904, doi:10.1039/C7TA01278K.
- ↑ Ying-Ya Liu, Roel Decadt, Thomas Bogaerts, Karen Hemelsoet, Anna M. Kaczmarek: Bipyridine-Based Nanosized Metal–Organic Framework with Tunable Luminescence by a Postmodification with Eu(III): An Experimental and Theoretical Study. In: The Journal of Physical Chemistry C. Band 117, Nr. 21, 30. Mai 2013, S. 11302–11310, doi:10.1021/jp402154q.
- ↑ T. Rajkumar, Deepak Kukkar, Ki-Hyun Kim, Jong Ryeul Sohn, Akash Deep: Cyclodextrin-metal–organic framework (CD-MOF): From synthesis to applications. In: Journal of Industrial and Engineering Chemistry. Band 72, 25. April 2019, S. 50–66, doi:10.1016/j.jiec.2018.12.048.
- ↑ Kuangmin Zhao, Weiwei Zhu, Suqin Liu, Xianli Wei, Guanying Ye: Two-dimensional metal–organic frameworks and their derivatives for electrochemical energy storage and electrocatalysis. In: Nanoscale Advances. Band 2, Nr. 2, 18. Februar 2020, S. 536–562, doi:10.1039/C9NA00719A.
- ↑ a b c d e f M. Nespolo: Comment on the article The Cambridge Structural Database in chemical education: analysis of hydrogen-bonded networks in salts of hexaaqua metal ions with organic counter-ions. In: Journal of Applied Crystallography. Band 54, Nr. 2, 1. April 2021, S. 707–707, doi:10.1107/S1600576721001606.
- ↑ a b Stefan Kaskel: The Chemistry of Metal-Organic Frameworks : Synthesis, Characterization, and Applications. Band 1. Wiley, 2016, ISBN 978-3-527-69308-5, S. 127–128.
- ↑ C. Livage, C. Egger, G. Férey: In: Chem. Mater. 11, 1999, S. 1546–1550.
- ↑ H. Hayashi, A. P. Côté, H. Furukawa, M. O’Keeffe, O. M. Yaghi: In: Nature Materials. 6, 2007, S. 501–506.
- ↑ M. Eddaoudi, J. Kim, N. Rosi, D. Vodak, J. Wachter, M. O’Keeffe, O. M. Yaghi: In: Science. 295, 2002, S. 469–472.
- ↑ S. S.-Y. Chui, S. M.-F. Lo, J. P. H. Charmant, A. G. Orpen, I. D. Williams: In: Science. 283, 1999, S. 1148–1150.
- ↑ L. Zhao, C. Zhong: In: J. Phys. Chem. C. 113, 2009, S. 16860–16862.
- ↑ S. Hausdorf, W. Seichter, E. Weber, F. Mertens: Dalton Transactions. 2009, S. 1107–1113.
- ↑ M. Tonigold, Y. Lu, B. Bredenkötter, B. Rieger, S. Bahnmüller, J. Hitzbleck, G. Langstein, D. Volkmer: In: Angew. Chem. Int. Ed. 48, 2009, S. 7546–7550.
- ↑ K. M. Ok, J. Sung, G. Hu, R. M. J. Jacobs, D. O’Hare: In: J. Am. Chem. Soc. 130, 2008, S. 3762–3763.
- ↑ Gérard Férey: Hybrid porous solids: past, present, future. In: Chem. Soc. Rev. Band 37, Nr. 1, 2008, S. 191–214, doi:10.1039/B618320B.
- ↑ Dominik Fröhlich, Evangelia Pantatosaki, Panagiotis D. Kolokathis, Karen Markey, Helge Reinsch: Water adsorption behaviour of CAU-10-H: a thorough investigation of its structure–property relationships. In: Journal of Materials Chemistry A. Band 4, Nr. 30, 26. Juli 2016, S. 11859–11869, doi:10.1039/c6ta01757f.
- ↑ a b c d National Research Council (U.S.). Committee on Alternatives and Strategies for Future Hydrogen Production and Use., National Academy of Engineering., National Academy of Sciences (U.S.): The hydrogen economy : opportunities, costs, barriers, and R & D needs. National Academies Press, Washington, D.C. 2004, ISBN 0-309-53068-7.
- ↑ Ronneau, Claude.: Énergie, pollution de l'air et développement durable. Presses universitaires de Louvain, Louvain-la-Neuve 2013, ISBN 978-2-87558-171-6.
- ↑ Leslie J. Murray, Mircea Dincă, Jeffrey R. Long: Hydrogen storage in metal-organic frameworks. In: Chemical Society Reviews. Band 38, Nr. 5, 2009, S. 1294, doi:10.1039/b802256a, PMID 19384439 (englisch).
- ↑ a b Alexander U. Czaja, Natalia Trukhan, Ulrich Müller: Industrial applications of metal–organic frameworks. In: Chemical Society Reviews. Band 38, Nr. 5, 2009, S. 1284, doi:10.1039/b804680h.
- ↑ DOE Technical Targets for Onboard Hydrogen Storage for Light-Duty Vehicles. Abgerufen am 18. September 2019 (englisch).
- ↑ K. Mark Thomas: Adsorption and desorption of hydrogen on metal–organic framework materials for storage applications: comparison with other nanoporous materials. In: Dalton Transactions. Nr. 9, 2009, S. 1487, doi:10.1039/b815583f.
- ↑ a b Kenji Sumida, Matthew R. Hill, Satoshi Horike, Anne Dailly, Jeffrey R. Long: Synthesis and Hydrogen Storage Properties of Be 12 (OH) 12 (1,3,5-benzenetribenzoate) 4. In: Journal of the American Chemical Society. Band 131, Nr. 42, 28. Oktober 2009, S. 15120–15121, doi:10.1021/ja9072707.
- ↑ Susumu Kitagawa, Ryo Kitaura, Shin-ichiro Noro: Functional Porous Coordination Polymers. In: Angewandte Chemie International Edition. Band 43, Nr. 18, 2004, S. 2334–2375, doi:10.1002/anie.200300610.
- ↑ a b c d e f Young Kyu Hwang, Do-Young Hong, Jong-San Chang, Sung Hwa Jhung, You-Kyong Seo: Amine Grafting on Coordinatively Unsaturated Metal Centers of MOFs: Consequences for Catalysis and Metal Encapsulation. In: Angewandte Chemie International Edition. Band 47, Nr. 22, 19. Mai 2008, S. 4144–4148, doi:10.1002/anie.200705998.
- ↑ Ying Chuan Tan, Hua Chun Zeng: Lewis basicity generated by localised charge imbalance in noble metal nanoparticle-embedded defective metal–organic frameworks. In: Nature Communications. Band 9, Nr. 1, Dezember 2018, S. 4326, doi:10.1038/s41467-018-06828-4, PMID 30337531, PMC 6194069 (freier Volltext).
- ↑ Robert F. Service: Crystalline nets snare water and make fuel from thin air. In: Science. Band 365, Nr. 6457, 6. September 2019, S. 964–965, doi:10.1126/science.365.6457.964.
- ↑ Farhad Fathieh, Markus J. Kalmutzki, Eugene A. Kapustin, Peter J. Waller, Omar M. Yaghi: Practical water production from desert air. In: Science Advances. Band 4, Nr. 6, 18. Juni 2018, doi:10.1126/sciadv.aat3198.
- ↑ Renhao Dong, Peng Han, Himani Arora, Marco Ballabio, Melike Karakus, Zhe Zhang, Chandra Shekhar, Peter Adler, Petko St Petkov, Artur Erbe, Stefan C. B. Mannsfeld: High-mobility band-like charge transport in a semiconducting two-dimensional metal–organic framework. In: Nature Materials. 17. Jahrgang, Nr. 11, November 2018, S. 1027–1032, doi:10.1038/s41563-018-0189-z (englisch, nature.com).
- ↑ Himani Arora, Renhao Dong, Tommaso Venanzi, Jens Zscharschuch, Harald Schneider, Manfred Helm, Xinliang Feng, Enrique Cánovas, Artur Erbe: Demonstration of a Broadband Photodetector Based on a Two-Dimensional Metal–Organic Framework. In: Advanced Materials. 32. Jahrgang, Nr. 9, 2020, S. 1907063, doi:10.1002/adma.201907063.
- ↑ Himani Arora: Charge transport in two-dimensional materials and their electronic applications (Doctoral Dissertation). (PDF) 18. Februar 2020, abgerufen am 6. Juni 2021 (englisch).
- ↑ Nele Reimer, Helge Reinsch, A. Ken Inge, Norbert Stock: New Al-MOFs Based on Sulfonyldibenzoate Ions: A Rare Example of Intralayer Porosity. In: Inorganic Chemistry. Band 54, Nr. 2, 24. Dezember 2014, S. 492–501, doi:10.1021/ic502242j.


 French
French Deutsch
Deutsch



