Molybdän-Cofaktor – Wikipedia
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
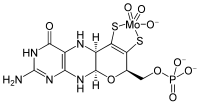 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Molybdän-Cofaktor | ||||||||||||
| Andere Namen | Moco | ||||||||||||
| Summenformel | C10H12MoN5O8PS2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 521,27 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Molybdän-Cofaktor (Moco, von englisch molybdenum cofactor) ist eine prosthetische Gruppe, der in verschiedenen Enzymen Molybdän-katalysierte Stoffwechselreaktionen bewirkt.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Es handelt sich dabei um eine Koordinationsverbindung zwischen Molybdopterin und einem Molybdän-Oxid. Das benötigte Molybdopterin wird aus Guanosintriphosphat synthetisiert. Ein Gendefekt in der Biosynthese des Molybdän-Cofaktors führt zu epileptischen Anfällen bei Neugeborenen, fortschreitende Enzephalopathie, Dysmorphien des Gesichts und Schwierigkeiten bei der Fütterung.[2]
Der Molybdän-Cofaktor wird bei Enzymen wie der Sulfitoxidasen, der Xanthinoxidasen und der Aldehydoxidasen verwendet.[3][4]
In Pflanzen und Tieren nutzen die Enzyme die trizyklische Seite des Molybdän-Cofaktors. Alle bisher entdeckten Molybdän-haltigen Enzyme nutzen diesen Cofaktor, bis auf die phylogenetischen alternativen Molybdän-haltige Nitrogenase, die Stickstoff in einigen Bakterien und Cyanobakterien binden.[5] Molybdänhaltige Enzyme in Pflanzen und Tieren katalysieren die Oxidation und manchmal die Reduktion von bestimmten Molekülen, als Teil der Stickstoff-, Schwefel- und Kohlenstoffkreisläufe.[6]
In Säugetieren kommt der Molybdän-Cofaktor bisher in vier Enzymen vor, die als MOSC-Proteine (englisch Moco sulferase C-terminal domain) bezeichnet werden.[7]
In Pflanzen sind bisher vier Moco-haltige Enzyme bekannt: Nitratreduktase, Sulfitoxidase, Xanthin-Dehydrogenase und Aldehydoxidase.[8]
In Escherichia coli sind über 50 verschiedene Enzyme mit Molybdän-Cofaktoren bekannt.[9]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ E. Bayram, Y. Topcu, P. Karakaya, U. Yis, H. Cakmakci, K. Ichida, S. H. Kurul: Molybdenum cofactor deficiency: review of 12 cases (MoCD and review). In: European journal of paediatric neurology : EJPN : official journal of the European Paediatric Neurology Society. Band 17, Nummer 1, Januar 2013, S. 1–6, doi:10.1016/j.ejpn.2012.10.003. PMID 23122324.
- ↑ G. Schwarz: Molybdenum cofactor biosynthesis and deficiency. In: Cell. Mol. Life Sci. Band 62, Nr. 23, Dezember 2005, S. 2792–2810, doi:10.1007/s00018-005-5269-y, PMID 16261263.
- ↑ B. Smolinsky, S. A. Eichler, S. Buchmeier, J. C. Meier, G. Schwarz: Splice-specific functions of gephyrin in molybdenum cofactor biosynthesis. In: J. Biol. Chem. Band 283, Nr. 25, Juni 2008, S. 17370–17379, doi:10.1074/jbc.M800985200, PMID 18411266.
- ↑ R. R. Mendel: The molybdenum cofactor. In: The Journal of biological chemistry. Band 288, Nummer 19, Mai 2013, S. 13165–13172, doi:10.1074/jbc.R113.455311. PMID 23539623. PMC 3650355 (freier Volltext).
- ↑ C. Kisker, H. Schindelin, D. Baas, J. Rétey, R. U. Meckenstock, P. M. H. Kroneck: A structural comparison of molybdenum cofactor-containing enzymes. In: FEMS Microbiol. Rev. Band 22, Nr. 5, 1999, S. 503–521, doi:10.1111/j.1574-6976.1998.tb00384.x, PMID 9990727.
- ↑ A. Havemeyer, J. Lang, B. Clement: The fourth mammalian molybdenum enzyme mARC: current state of research. In: Drug metabolism reviews. Band 43, Nummer 4, November 2011, S. 524–539, doi:10.3109/03602532.2011.608682. PMID 21942410.
- ↑ R. R. Mendel: Biology of the molybdenum cofactor. In: Journal of experimental botany. Band 58, Nummer 9, 2007, S. 2289–2296, doi:10.1093/jxb/erm024. PMID 17351249.
- ↑ C. Iobbi-Nivol, S. Leimkühler: Molybdenum enzymes, their maturation and molybdenum cofactor biosynthesis in Escherichia coli. In: Biochimica et Biophysica Acta. Band 1827, Nummer 8–9, 2013 Aug-Sep, S. 1086–1101, doi:10.1016/j.bbabio.2012.11.007. PMID 23201473.


 French
French Deutsch
Deutsch