Octyltriazon – Wikipedia
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
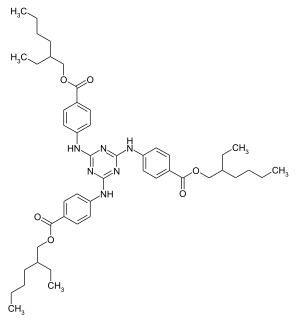 | ||||||||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Octyltriazon | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C48H66N6O6 | |||||||||||||||||||||
| Kurzbeschreibung | weiße Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 823,07 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | löslich in Ethylacetat und Ethanol[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Octyltriazon ist eine Mischung von acht isomeren chemischen Verbindungen, die sich vom Cyanurtriamid bzw. Melamin ableitet.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Die Synthese ist durch eine nukleophile Substitution von 2-Ethylhexyl-p-aminobenzoat an dem Heteroaromaten Cyanurchlorid möglich.[5][6][7] Da von einem racemischen 2-Ethylhexylderivat ausgegangen wird, entsteht bei dieser Synthese ein Isomerengemisch.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Octyltriazon ist eine weiße kristalline Substanz, die bei 129 °C mit einer Schmelzenthalpie von 23 kJ·mol−1 schmilzt.[2] Die Verbindung ist sehr gut löslich in Ethylacetat und Ethylacetat/Ethanol-Mischungen.[3]
Löslichkeit von Octyltriazon[3] Temperatur in °C 25 30 35 40 45 Ethylacetat in g·l−1 318,8 364,6 413,2 462,4 512,5 Ethylacetat/Ethanol (90/10 Ma %) in g·l−1 389,0 430,0 479,9 525,1 567,3 Ethylacetat/Ethanol (80/20 Ma %) in g·l−1 404,9 450,2 498,6 539,7 600,0 Ethylacetat/Ethanol (70/30 Ma %) in g·l−1 383,6 438,5 502,9 541,3 608,5
Octyltriazon liegt auf Grund der Ethylhexylgruppe als Stereoisomerengemisch vor, welches aus je 1/8 (R,R,R)- und (S,S,S)-Isomeren sowie aus je 3/8 (R,R,S)- und (R,S,S)-Isomeren besteht. Das Absorptionsmaximum von Octyltriazon liegt bei 314 Nanometern.[8]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Octyltriazon wird in Sonnencremes als UV-Filter im UVB-Bereich verwendet. Gemäß EU-Richtlinie 76/786 EWG ist in Formulierungen eine Maximalkonzentration von 5 g pro 100 g erlaubt.[9] Es wird von der BASF als Uvinul T 150 vermarktet.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu ETHYLHEXYL TRIAZONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- ↑ a b c F. Berte, M. Fabbi, L. Bemporad, F. Maestri: Crystalline form of a triazine derivative and its procedure for its production. 3V Sigma S.p.A. 2014. Patent US2014/255324 A1.
- ↑ a b c S. J. Rodriguez, D. M. Cristancho, P. C. Neita, E. F. Vargas, F. Martinez: Solution Thermodynamics of Ethylhexyl Triazone in Some Ethanol + Ethyl Acetate Mixtures. In: J. Sol. Chem. Band 39, 2010, S. 1122–1133, doi:10.1007/s10953-010-9575-0.
- ↑ a b Registrierungsdossier zu Tris(2-ethylhexyl)-4,4′,4′′-(1,3,5-triazine-2,4,6-triyltriimino)tribenzoate (Abschnitt GHS) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. April 2022.
- ↑ Patent EP0087098A2: s-Triazinderivate und ihre Verwendung als Lichtschutzmittel. Angemeldet am 14. Februar 1983, veröffentlicht am 31. August 1983, Anmelder: BASF AG, Erfinder: U. Hoppe, K. Seib, P. Naegele, M. Roland.
- ↑ Patent WO2012/127425 A1: Kroener, R., BASF SE 2012.
- ↑ a b Patent US8765753B2: Process for the preparation of s-triazine compounds. Angemeldet am 21. März 2012, veröffentlicht am 1. Juli 2014, Anmelder: BASF, Erfinder: Rudi Kroner.
- ↑ UV Filter – Technical Information ( vom 29. September 2015 im Internet Archive), 2011.
- ↑ P. Wolf: UV-Filter, State of the Art. In: Hautarzt. Band 60, 2009, S. 285–293, doi:10.1007/s00105-008-1623-y.


 French
French Deutsch
Deutsch