Phosphomannomutase – Wikipedia
| Phosphomannomutase | ||
|---|---|---|
| Bezeichner | ||
| Gen-Name(n) | PMM1, PMM2 | |
| Enzymklassifikation | ||
| EC, Kategorie | 5.4.2.8, Isomerase | |
| Reaktionsart | Umlagerung | |
| Substrat | Mannose-1-phosphat | |
| Produkte | Mannose-6-phosphat | |
| Vorkommen | ||
| Übergeordnetes Taxon | Eukaryoten, Bakterien[1] | |
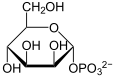
Phosphomannomutasen sind Enzyme in Eukaryoten und Bakterien, die die Umlagerung von Mannose-1-phosphat zu Mannose-6-phosphat und umgekehrt katalysieren. Eukaryoten benötigen GDP-Mannose bei der Glycosylierung von Proteinen, Bakterien verwenden Mannose als Energielieferant. Beim Menschen sind zwei paraloge Isoformen des Enzyms bekannt, die mit PMM-1 und PMM-2 bezeichnet werden. PMM-1 wird insbesondere in Leber, Herz, Gehirn und Pankreas produziert. Mutationen im PMM2-Gen können zu seltenem erblichem Glykosylierungsdefekt Typ 1a (CDG-1a) führen.[2]
Katalysierte Reaktion
[Bearbeiten | Quelltext bearbeiten]α-D-Mannose-1-phosphat und β-D-Mannose-6-phosphat gehen ineinander über.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]Wikibooks: Biochemie und Pathobiochemie: Fructose-, Mannose- und Fucose-Stoffwechsel – Lern- und Lehrmaterialien


 French
French Deutsch
Deutsch