Tanabe-Sugano-Diagramm – Wikipedia

Beim Tanabe-Sugano-Diagramm – benannt nach Yukito Tanabe und Satoru Sugano – handelt es sich um ein Diagramm, in dem für alle elektronischen Zustände eines oktaedrischen Systems die Energiedifferenz E zum (typischerweise) niedrigsten Zustand gegen die Kristallfeldaufspaltungsenergie aufgetragen werden, beide Größen normiert auf den Racah-Parameter B. Im Gegensatz zum Orgel-Diagramm lassen sich mit dem Tanabe-Sugano-Diagramm quantitative Aussagen treffen.
Die Zahl der Kurven, die von einer vertikalen Linie eines gegebenen geschnitten werden, ergibt die Zahl möglicher Übergänge und damit die Zahl erwarteter Absorptionscharakteristika. Das Tanabe-Sugano-Diagramm ist damit ein Korrelationsdiagramm, welches die Deutung von Absorptionsspektren chemischer Verbindungen ermöglicht.
Es ist folgende Feinstrukturaufspaltung zu beobachten:[1]
| Term | Aufspaltung im okt. Feld |
|---|---|
| S | A1g |
| P | T1g |
| D | Eg, T2g |
| F | A2g, T2g, T1g |
| G | A1g, Eg, T2g, T1g |
| H | Eg, T1g, T1g, T2g |
| I | A1g, A2g, Eg, T1g, T2g, T2g |
Tanabe-Sugano-Diagramme
[Bearbeiten | Quelltext bearbeiten]Die sieben Tanabe-Sugano-Diagramme für oktaedrische Komplexe:
 | 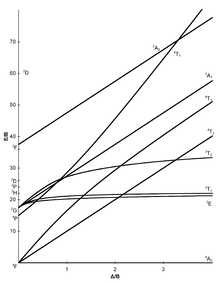 |  |  |
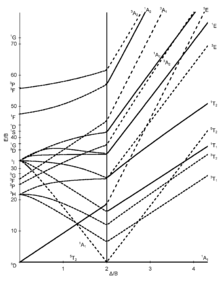 |  | 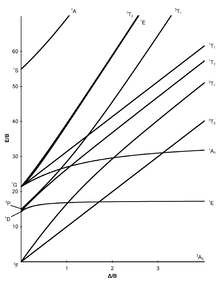 |
Die Diagramme für die d1-, d9- und d10-Elektronenkonfiguration werden nicht gebraucht.
d1-System
[Bearbeiten | Quelltext bearbeiten]In einem d1-System gibt es keine Elektronenabstoßung, daher verbleibt das Elektron im Grundzustand des t2g-Orbitals. Das Termsymbol für dieses System ist 2D; 2D spaltet in den 2T2g und den 2Eg-Zustand auf. Im UV-Vis-Spektrum eines d1-Ions ist nur eine Absorptionsbande zu finden, nämlich die für den Übergang von 2T2g nach 2Eg.
d9-System
[Bearbeiten | Quelltext bearbeiten]Das d9-System weist ebenso wie das d1-System einen 2D-Term auf. Die Anregung erfolgt hier von der (t2g)6(eg)3-Konfiguration (2Eg-Zustand) zu der (t2g)5(eg)4-Konfiguration (2T2g-Zustand).
d10-System
[Bearbeiten | Quelltext bearbeiten]In d10-Metallkomplexen gibt es keine d-d-Übergänge, daher sind auch keine UV-Vis-Absorptionsbanden beobachtbar und ein Tanabe-Sugano-Diagramm existiert nicht.
Tetraedrische Komplexgeometrie
[Bearbeiten | Quelltext bearbeiten]Für tetraedrische Komplexe werden generell keine Tanabe-Sugano-Diagramme erstellt, das liegt daran, dass ein Tanabe-Sugano-Diagramm für einen dn-Tetraeder ähnlich dem eines d(10−n)-Oktaeders ist. Da die Ligandenfeldaufspaltung im tetraedrischen Komplex nur 4/9 der des Oktaeders ist finden sich, mit einigen Ausnahmen, nur high-spin-Komplexe und daher können die rechten low-spin-Seiten im Tanabe-Sugano-Diagramm für tetraedrische Komplexe vernachlässigt werden.
Benutzung der Diagramme
[Bearbeiten | Quelltext bearbeiten]- Die d-Elektronenkonfiguration des Ions muss bestimmt werden.
- Das, für die d-Elektronenkonfiguration, passende Tanabe-Sugano-Diagramm muss gewählt werden.
- Das Maximum der Absorption muss in einem UV-Vis-Spektrum gefunden werden. Spin-erlaubte Übergänge werden dabei intensiver sein als Spin-verbotene Übergänge.
- Die Absorptionsmaxima müssen in Wellenzahlen umgerechnet und die Verhältnisse der Wellenzahlen zur Niedrigsten müssen bestimmt werden.
- Jetzt kann das Diagramm von links nach rechts untersucht werden, bis die Übergänge im ausgerechneten Verhältnis zueinander vorliegen.
- Die E/B und /B-Werte können nun abgelesen werden.
Beispiele zur quantitativen Auswertung
[Bearbeiten | Quelltext bearbeiten]
Hexaaquamangan(II) – [Mn(H2O)6]2+
[Bearbeiten | Quelltext bearbeiten]Im Komplex [Mn(H2O)6]2+ kommt Mangan in der Oxidationsstufe +2 vor, daher handelt es sich um ein oktaedrisch koordiniertes d5-Ion. Da Wasser ein Schwachfeld-Ligand ist (vgl. Spektrochemische Reihe), ist der Grundterm im Tanabe-Sugano-Diagramm 6A1. Da im Tanabe-Sugano-Diagramm kein weiterer Sextett-Zustand auftaucht ist kein Spin-erlaubter-Übergang möglich. Die beobachteten Absorptionen werden daher von niedriger Intensität sein.
Dennoch könnte nun das Verhältnis aller gemessenen Wellenzahlen zur Niedrigsten bestimmt werden. Mit diesem Verhältnis kann dann im d5-Tanabe-Sugano-Diagramm nach passenden Übergängen gesucht werden (bei 1 bzw. 2 Δ/B), wenn ebendieser gefunden wurde, können die E/B-Werte (y-Achse) abgelesen werden. Δokt ergibt sich dann durch:
Für alle Übergänge sollte annähernd derselbe B- bzw. Δokt-Wert herauskommen.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Quellenangabe
[Bearbeiten | Quelltext bearbeiten]- Catherine E. Housecroft und Alan G. Sharpe: Anorganische Chemie. 2. aktualisierte Auflage, Pearson Studium, München 2006, ISBN 978-3-8273-7192-8.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ C. E. Housecroft; A. G. Sharpe: Inorganic Chemistry. 4th ed Auflage. Pearson, Harlow, England 2012, ISBN 978-0-273-74275-3, S. 691.


 French
French Deutsch
Deutsch

