Tolvaptan – Wikipedia
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
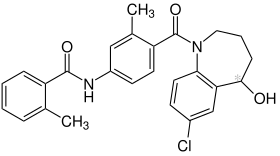 | ||||||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Tolvaptan | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C26H25ClN2O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 448,94 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | 220–221 °C[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Tolvaptan ist der internationale Freiname für einen Arzneistoff zur Erhöhung der Wasserausscheidung aus dem Körper.
Zugelassen ist Tolvaptan
- als Samsca zur Behandlung eines krankhaft erniedrigten Natriumspiegels im Blut (Hyponatriämie) beim Erwachsenen, bedingt durch das Schwartz-Bartter-Syndrom (SIADH), sowie
- als Jinarc zur Behandlung von Erwachsenen mit autosomal-dominanter polyzystischer Nierenerkrankung (PKD). Dies ist eine Erbkrankheit, bei der sich in der Niere zahlreiche flüssigkeitsgefüllte Zysten bilden (sogenannte Zystenniere), die schließlich die Nierenfunktion reduzieren und zu Nierenversagen führen können.
Vermarktet werden die Präparate durch die japanische Arzneimittelfirma Ōtsuka.
Wirkprinzip
[Bearbeiten | Quelltext bearbeiten]Tolvaptan soll selektiv die durch das antidiuretische Hormon (ADH, auch Vasopressin) ausgelöste Rückresorption von freiem Wasser über Aquaporine (Wasserkanäle in den Membranen der Zellen) im Sammelrohr der Niere unterdrücken (Vasopressin-Antagonist). Tolvaptan bindet im Vergleich zu Vasopressin mit einer um den Faktor 1,8 höheren Affinität an den Arginin-Vasopressin-Rezeptor 2, wodurch dieser gehemmt wird und die Ausscheidung von Wasser (Diurese) erhöht wird. Dabei wird die Ausscheidung von den im Wasser gelösten Elektrolyten nicht beeinflusst. Das Wirkprinzip von Tolvaptan unterscheidet sich in diesem Punkt entscheidend von dem der konventionellen Diuretika.[3]
Pharmakokinetik
[Bearbeiten | Quelltext bearbeiten]Nach der Einnahme wird Tolvaptan schnell resorbiert. Die Maximalkonzentration im Blutplasma wird nach etwa zwei Stunden erreicht, wobei circa 56 % der eingenommenen Dosis bioverfügbar sind. Die Plasmahalbwertszeit liegt bei etwa acht Stunden. Die Ausscheidung erfolgt im Wesentlichen über das Leber-Galle-Darm-System. Weniger als 1 % wird über den Nieren-Blasen-Weg mit dem Harn eliminiert.[3]
Behandlung der SIADH
[Bearbeiten | Quelltext bearbeiten]Tolvaptan ist seit 2. August 2009 in der Europäischen Union zur Behandlung von Erwachsenen mit Hyponatriämie, als sekundäre Folge des Syndroms der inadäquaten Sekretion des antidiuretischen Hormons (SIADH), unter dem Markennamen Samsca zugelassen. Es ist der erste oral verfügbare selektive V2-Vasopressin-Rezeptor-Antagonist.[3]
Die Behandlung mit Tolvaptan muss mit einer Dosis von 15 mg einmal täglich eingeleitet werden. Die Dosis kann je nach Verträglichkeit auf maximal 60 mg einmal täglich erhöht werden, um den gewünschten Natriumspiegel im Serum zu erreichen.[4]
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]In klinischen Studien mit Tolvaptan traten bei den Patienten sehr häufig – das bedeutet bei mehr als einem von zehn Behandelten – ein Durstgefühl oder Übelkeit auf. Häufig, das heißt bei 1 bis 10 von 100 Behandelten, waren Mundtrockenheit, übermäßiger Wasserkonsum, verstärkter Harndrang oder häufigeres Wasserlassen, Wasserverlust, Müdigkeit, allgemeine Schwäche, Appetitmangel, Verstopfung, Schwindel, niedriger Blutdruck beim Aufstehen, Ohnmacht, fleckige Hautblutungen, Juckreiz, Fieber, ein Anstieg der Natrium-, Kalium-, Kreatinin-, Harnsäure- und Blutzuckerwerte sowie eine Abnahme des Blutzuckerspiegels.[4]
Im März 2012 wies der Hersteller Ōtsuka in einem Rote-Hand-Brief auf Risiken von zu raschen Serumnatriumanstiegen bei Anwendung von Tolvaptan hin.[5]
Die EMA hat im Mai 2013 einen Warnhinweis ausgegeben, dass die Überdosierung von Tolvaptan zu Leberschädigungen führen könnte.[6]
Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Auf die Einnahme von Tolvaptan sollte bei einer Anurie (stark verminderte Harnproduktion), bei einer Hyponatriämie bei extrazellulärem Volumenmangel (hypovolämische Hyponatriämie), bei einer echten Volumendepletion (beispielsweise durch Diarrhoe, Blutung oder Erbrechen), bei einer Hypernatriämie, bei Patienten ohne Durstgefühl, während der Schwangerschaft und Stillzeit sowie bei einer Überempfindlichkeit gegen den Wirkstoff oder gegen einen der Bestandteile seiner Formulierung verzichtet werden (Kontraindikationen).[4]
Behandlung der ADPKD
[Bearbeiten | Quelltext bearbeiten]Jinarc ist das erste in Europa zugelassene Medikament für Erwachsene mit autosomal-dominanter polyzystischer Nierenerkrankung (ADPKD) mit Niereninsuffizienzstadien 1 bis 3 zu Behandlungsbeginn mit Anzeichen für eine rasche Krankheitsprogression.[7] Tolvaptan ist ein selektiver Vasopressin-2-(V2)-Rezeptor-Antagonist, der den Nierenfunktionsverlust mindert und das renale Zystenwachstum reduziert. Die EU-Zulassung erfolgte im Mai 2015.
Die Wirksamkeit und die Sicherheit von Tolvaptan wurden anhand eines klinischen Studienprogramms – einschließlich der internationalen dreijährigen, randomisierten, doppelblinden, placebokontrollierten Phase-3-Studie TEMPO 3/4 mit über 1.400 erwachsenen ADPKD-Patienten – nachgewiesen.[8]
Selektiver Wirkmechanismus
[Bearbeiten | Quelltext bearbeiten]Tolvaptan blockiert spezifisch die Bindung von Vasopressin an den Vasopressin-2-Rezeptor (V2-Rezeptor) in den Tubulusepithelzellen der distalen Abschnitte des Nephrons.[7] Die Bindungsaffinität von Tolvaptan an diesen Rezeptor ist 1,8-mal höher als die des körpereigenen Vasopressins.[9]
Vasopressin (auch antidiuretisches Hormon, ADH) reguliert die Wasserretention im Körper – und damit die Urinkonzentration –, indem es die Wasserrückresorption in den Sammelrohren der Niere aktiviert (Antidiurese).[10] Nach der Bindung von Vasopressin an den V2-Rezeptor werden die vom zyklischen Adenosinmonophosphat (cAMP) gesteuerten Signalwege in Gang setzt, die dann zur Antidiurese führen.[11][12][13] Vasopressin ist der Hauptstimulus für die cAMP-Produktion in Sammelrohr und distalem Nephron.[14][15]
Bei ADPKD kommt es durch Mutation der Gene PKD1 oder PKD2 unter anderem zu einer Hochregulation des V2-Rezeptors und damit zu einer überaktiven Vasopressin-Signalisierung. Die dadurch ansteigende cAMP-Konzentration fördert über den Signalweg der Proteinkinase A (PKA) die Bildung und das Wachstum von Zysten in den Nieren.[16][17][18]
Indem Tolvaptan Vasopressin am V2-Rezeptor verdrängt, wird die cAMP-Produktion reduziert, sodass es in der Folge zu einer Verminderung der Zellproliferation, der Zystenbildung und des Zystenwachstums sowie zu einer vermehrten Wasserausscheidung (Aquarese) kommt.[19]
Nebenwirkungen und Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Aufgrund des Wirkmechanismus von Tolvaptan, der zu einer gesteigerten Aquarese führt, sind die häufigsten auftretenden Nebenwirkungen Durst, Polyurie, Nykturie und Pollakisurie. Kopfschmerzen, Schwindel, Müdigkeit und Erschöpfung sind weitere häufige unerwünschte Nebenwirkungen.[7]
Die Studie TEMPO 3/4 hat ein erhöhtes Risiko für das Auftreten von Leberschädigungen bei den ADPKD-Patienten gezeigt, die Tolvaptan einnehmen. Bei Patienten, die Tolvaptan erhielten, trat häufiger (4,9 %) eine klinisch bedeutsame Erhöhung des Leberenzyms Alanin-Aminotransferase auf als bei Patienten, die ein Placebo erhielten (1,2 %).[7]
Die Behandlung mit Tolvaptan muss unter der Aufsicht von Ärzten mit Erfahrung in der Behandlung der ADPKD und mit vollständiger Kenntnis der Risiken der Tolvaptan-Therapie, einschließlich der Hepatotoxizität und der Überwachungsanforderungen, eingeleitet und überwacht werden.[7]
Nicht angewendet werden darf Tolvaptan bei erhöhten Leberenzymwerten und bei vorbestehenden Lebererkrankungen, bei einer Überempfindlichkeit gegen den Wirkstoff, bei Anurie, bei Hypernatriämie, Hypovolämie und bei Personen ohne Durstempfinden sowie in der Schwangerschaft und Stillzeit.[7]
Synthese
[Bearbeiten | Quelltext bearbeiten]Tolvaptan lässt sich über mehrere Stufen, beispielsweise aus 3-Chlor-2-nitrobenzoesäure, synthetisieren. Hierzu werden unter anderem p-Toluolsulfonsäurechlorid (TsCl) und Kalium-tert-butanolat (t-BuOK) verwendet.[20]

Stereochemie
[Bearbeiten | Quelltext bearbeiten]Tolvaptan enthält ein Stereozentrum und besteht aus zwei Enantiomeren. Hierbei handelt es sich um ein Racemat, also ein 1:1-Gemisch von (R)- und der (S)-Form:[21]
| Enantiomere von Tolvaptan | |
|---|---|
 CAS-Nummer: 331947-66-1 |  CAS-Nummer: 331947-44-5 |
Weiterführende Literatur
[Bearbeiten | Quelltext bearbeiten]- G. A. Reif, T. Yamaguchi, E. Nivens, H. Fujiki, C.S. Pinto, D.P. Wallace: Tolvaptan inhibits ERK-dependent cell proliferation, Cl- secretion and in vitro cyst growth of human ADPKD cells stimulated by vasopressin. In: American Journal of Physiology-Renal Physiology. 2011;301:F1005-F1013. doi:10.1152/ajprenal.00243.2011. PMID 21816754.
- H. D. Zmily, S. Daifallah, J. K. Ghali: Tolvaptan, hyponatremia, and heart failure. In: International journal of nephrology and renovascular disease Band 4, 2011, S. 57–71, doi:10.2147/IJNRD.S7032. PMID 21694950. PMC 310879 (freier Volltext).
- A. Ambrosy, S. R. Goldsmith, M. Gheorghiade: Tolvaptan for the treatment of heart failure: a review of the literature. In: Expert Opinion on Pharmacotherapy Band 12, Nummer 6, April 2011, S. 961–976, doi:10.1517/14656566.2011.567267, PMID 21401442.
- E. Ferrer: Tolvaptan for the treatment of hyponatremia and congestive heart failure. In: Drugs of Today Band 46, Nummer 3, März 2010, S. 163–171, doi:10.1358/dot.2010.46.3.1464842, PMID 20467590.
- G. L. Plosker: Tolvaptan. In: Drugs. 2010;70:S. 443–454, doi:10.2165/11204630-000000000-00000, PMID 20205486.
- M. Gheorghiade, W. A. Gattis u. a.: Effects of tolvaptan, a vasopressin antagonist, in patients hospitalized with worsening heart failure: a randomized controlled trial. In: Journal of the American Medical Association. 2004;291:S. 1963–1971, doi:10.1001/jama.291.16.1963, PMID 15113814.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ A. Cordero-Vargas: Bioorganic & Medicinal Chemistry, Band 14, Nr. 18, 2006, S. 6165–6173.
- ↑ a b Datenblatt Tolvaptan bei Sigma-Aldrich, abgerufen am 22. Mai 2017 (PDF).
- ↑ a b c K. A. Gräfe, S. Siebenand: Neu auf dem Markt – Laropiprant, Plerixafor und Tolvaptan. In: Pharmazeutische Zeitung 40, 2009.
- ↑ a b c ema.europa.eu: Zusammenfassung der Merkmale des Arzneimittels. (PDF; 223 kB).
- ↑ Rote-Hand-Brief über die Risiken von zu raschen Serumnatriumanstiegen. (PDF; 583 kB) abgerufen von der Website der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ).
- ↑ Mittelung EMA zu Samsca. (PDF; 165 kB) Abgerufen am 17. September 2014.
- ↑ a b c d e f JINARC Fachinformation; Stand September 2016.
- ↑ Torres VE et al. N Engl J Med. 2012;367:2407–2418.
- ↑ Yamamura Y et al. J Pharmacol Exp Ther. 1998;287(3):860-867.
- ↑ Boone M, Deen P. Pflugers Arch. 2008;456(6):1005–1024.
- ↑ Gattone VH 2nd et al. Dev Genet. 1999;24(3-4):309–318.
- ↑ Belibi FA et al. Kidney Int. 2004;66(3):964–973.
- ↑ Boone M, Deen P. Pflugers Arch. 2008;456(6):1005–1024.
- ↑ Meijer E et al. Kidney Blood Press Res. 2011;34(4):235–244.
- ↑ Grantham JJ et al. Nat Rev Nephrol. 2011;7(10):556–566.
- ↑ Takiar V, Caplan MJ. Biochim Biophys Acta. 2011;1812(10):1337–1343.
- ↑ Dell KM. Adv Chronic Kidney Dis. 2011;18(5):339–347.
- ↑ Torres VE et al. Lancet 2007; 369(9569):1287–1301.
- ↑ Ibraghimov-Beskrovnaya O, Natoli TA. Trends Mol Med 2011;17(11):625–633.
- ↑ K. Kondo, H. Ogawa u. a.: 7-Chloro-5-hydroxy-1-[2-methyl-4-(2-methylbenzoyl-amino)benzoyl ]-2,3,4,5-tetrahydro-1H-1-benzazepine (OPC-41061): a potent, orally active nonpeptide arginine vasopressin V2 receptor antagonist. In: Bioorganic & Medicinal Chemistry Band 7, Nummer 8, August 1999, S. 1743–1754, PMID 10482466.
- ↑ Rote Liste Service GmbH (Hrsg.): Rote Liste 2017 – Arzneimittelverzeichnis für Deutschland (einschließlich EU-Zulassungen und bestimmter Medizinprodukte). Rote Liste Service GmbH, Frankfurt/Main, 2017, Aufl. 57, ISBN 978-3-946057-10-9, S. 222.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Tolvaptan-Arzneimittel auf der Website der Europäischen Arzneimittelagentur (Europäischer Öffentlicher Beurteilungsbericht, EPAR)


 French
French Deutsch
Deutsch