Zincke-Reaktion – Wikipedia

Die Zincke-Reaktion ist eine Namensreaktion aus dem Bereich der Organischen Chemie. Sie dient der Synthese von Pyridinium-Verbindungen aus Pyridinen und ist nach ihrem Entdecker, dem deutschen Chemiker Theodor Zincke (1843–1928), benannt.[1] Sie ist nicht zu verwechseln mit der Zincke-Suhl-Reaktion oder der Zincke-Nitrierung.
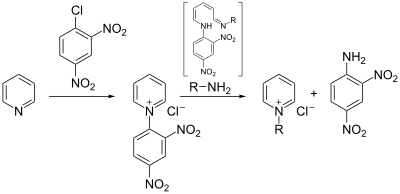
Mechanismus
[Bearbeiten | Quelltext bearbeiten]In einem ersten Schritt wird ein Zincke-Salz (2) aus dem eingesetzten Pyridinderivat hergestellt. Dies geschieht durch Umsetzung des Pyridins mit einem elektronenarmen Aromaten, häufig 1-Chlor-2,4-dinitrobenzol, wobei sich ein Pyridiniumsalz bildet. Das Salz wird anschließend mit zwei Äquivalenten des primären Amins umgesetzt, das jenen Rest trägt, welcher nach Ende der Reaktion am Pyridin verbleiben soll. Das Amin addiert sich zunächst in 2-Position an das Pyridinumsalz (3), was nach Deprotonierung zur Öffnung des Rings führt (4). Durch Substitution des Amins aus dem vorigen Pyridin mit einem dritten Äquivalent des gewünschten Amins wird der gewünschte Rest an die korrekte Position gebracht (6a). Die Reaktion verläuft im Weiteren als Umkehr des bisherigen Reaktionsverlaufs. Der Ring wird wieder geschlossen (7), das in 2-Position befindliche Amin protoniert (8) und unter Abspaltung des Amins die gewünschte Pyridiniumverbindung (9) freigesetzt.[2]

Werden anstelle primärer Amine sekundäre Amine eingesetzt, so werden aus (6) in Gegenwart von Wasser offenkettige Aldehyde, sogenannte Zincke-Aldehyde erhalten.[3]

Errata
[Bearbeiten | Quelltext bearbeiten]Aufmerksamkeit in der neueren Fachliteratur erfuhr die Publikation einer angeblichen Eintopf-Synthese des Diazaannulens (1), die unabhängig von zwei Arbeitsgruppen publiziert worden war.[4] Daraufhin verfasste der deutsche Hochschullehrer Manfred Christl,[5] ein ehemaliger Schüler von R. Huisgen und S. Hünig, einen Leserbrief,[6] in dem er stichhaltig Struktur und Synthese des postulierten Diazaannulens anzweifelte. Des Weiteren wies er darauf hin, dass es sich bei der eigentlich ablaufenden Reaktion um die seit über hundert Jahren[7][8] bekannte Zincke-Reaktion handele und das entsprechende Produkt der Zincke-Reaktion (2) gebildet würde. Beide Gruppen zogen daraufhin ihre Publikationen zurück.[9] Über den Fall neuzeitlicher schlampiger Wissenschaftsrecherche wurde auch im Spiegel[10] und der Nature[11] berichtet. Es zeigte sich, dass beiden Arbeitsgruppen die notwendige Erfahrung bei der Auswertung von Massen- und NMR-Spektren fehlte, Techniken also, die es zu Zeiten von Zincke noch nicht gab. Zu Zeiten von Zincke war es üblich, molare Massen durch Kryoskopie zu überprüfen.

Anwendung bei der Syntheseplanung
[Bearbeiten | Quelltext bearbeiten]Neben der variablen Synthesemöglichkeit Alkyl- oder Aryl-substituierter Pyridiniumsalze wird die Zincke-Reaktion auch in neueren Fachpublikationen zu aktuellen Problemstellungen eingesetzt. So wurde beispielsweise eine neue Indolsynthese auf Basis der Zincke-Reaktion entwickelt.[12]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ T. Zincke, G. Heuser, W. Moller: Ueber Dinitrophenylpyridiniumchlorid und dessen Umwandlungsproducte., in: Liebigs Ann. 1904, 330, 361–374; doi:10.1002/jlac.19043300217 und 1904, 333, 296–345; doi:10.1002/jlac.19043330212. - T. Zincke, G. Weisspfenning: Über Dinitrophenylisochinoliniumchlorid und dessen Umwandlungsprodukte., in: Liebigs Ann. 1913, 396, 103–131; doi:10.1002/jlac.19133960107.
- ↑ J. J. Lie: Name Reactions: A Collection of Detailed Mechanisms, 4. Auflage, S. 596, Springer Verlag, Berlin, 2009, ISBN 3-642-01052-0.
- ↑ T. Zincke, W. Wurker: Ueber Dinitrophenylpyridiniumchlorid und dessen Umwandlungsproducte (2. Mittheilung.). Ueber Dinitrophenylpyridiniumchlorid und dessen Umwandlungsproducte., in: Liebigs Ann. 1904, 338, 107–141; doi:10.1002/jlac.19043380107.
- ↑ I. Yamaguchi, Y. Gobara, M. Sato: One-Pot Synthesis of N-Substituted Diaza[12]annulenes., in: Org. Lett. 2006, 8, 4279–4281; doi:10.1021/ol061585q. - L. Shi, D. Lundberg, D. G. Musaev, F. M. Menger: [12]Annulene Gemini Surfactants: Structure and Self-Assembly, in: Angew. Chem. 2007, 119, 5993–5995; doi:10.1002/ange.200702140.
- ↑ Prof. Dr. Christl – Curriculum Vitae. Universität Würzburg, abgerufen am 3. Januar 2018.
- ↑ M. Christl: 1,7-Diaza[12]annulen-Derivate? 100 Jahre alte Pyridiniumsalze!, in: Angew. Chem. 2007, 119, 9312–9313; doi:10.1002/ange.200704704cube.
- ↑ Friedrich Konrad Beilstein, Bernhard Prager, Paul Jacobsen: Beilsteins Handbuch der Organischen Chemie. Hrsg.: Deutsche Chemische Gesellschaft. 4. Auflage. Band 5: Cyclische Kohlenwasserstoffe. Springer, Berlin 1922, S. 264 (Textarchiv – Internet Archive).
- ↑ Friedrich Konrad Beilstein, Bernhard Prager, Paul Jacobsen: Beilsteins Handbuch der Organischen Chemie. Hrsg.: Deutsche Chemische Gesellschaft. 4. Auflage. Band 20: Heterocyclische Reihe. Springer, Berlin 1935, S. 217 (Textarchiv – Internet Archive).
- ↑ I. Yamaguchi, Y. Gobara, M. Sato: One-Pot Synthesis of N-Substituted Diaza[12]annulenes., in: Org. Lett. 2007, 9, 5139; doi:10.1021/ol702583k. - L. Shi, D. Lundberg, D. G. Musaev, F. M. Menger: Berichtigung: [12]Annulene Gemini Surfactants: Structure and Self-Assembly, in: Angew. Chem. 2007, 119, 9295; doi:10.1002/ange.200790248.
- ↑ Jens Lubbadeh: Wissenschafts-Posse: Ahnungslose Chemiker entdecken Verbindung zum zweiten Mal. In: Spiegel Online. 6. Dezember 2007, abgerufen am 3. Januar 2018.
- ↑ K. Sanderson: Where have I seen that before? 103-year-old chemical reaction pops up again., in: Nature News December 2007; doi:10.1038/news.2007.341
- ↑ A. M. Kearney, C. D. Vanderwal: Synthesis of Nitrogen Heterocycles by the Ring Opening of Pyridinium Salts., in: Angew. Chem. 2006, 118, 7967–7970; doi:10.1002/ange.200602996.


 French
French Deutsch
Deutsch