Ácido tartárico , la enciclopedia libre
| Ácido tartárico | ||
|---|---|---|
 Ácido tartárico (isómero óptico (S,S)) | ||
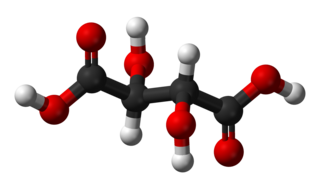 Estructura 3D del ácido tartárico | ||
| Nombre IUPAC | ||
| Ácido 2,3-dihydroxibutanodioico | ||
| General | ||
| Otros nombres | ácido 2,3-dihidroxisuccinico; ácido racémico | |
| Fórmula semidesarrollada | HO 2CCH(OH)CH(OH)CO 2H | |
| Fórmula estructural | 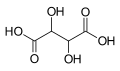 | |
| Fórmula molecular | C4H 6O 6 | |
| Identificadores | ||
| Número CAS | mezcla racémica: 133-37-9 isómero R,R: 87-69-4 isómero S,S: 147-71-7 mesoisómero: 147-73-9[1] | |
| ChEBI | 15674 | |
| ChEMBL | CHEMBL333714 | |
| ChemSpider | 852 | |
| PubChem | 21583978 875, 21583978 | |
| UNII | JQO211TF1A | |
| Propiedades físicas | ||
| Apariencia | Polvo cristalino blanco | |
| Masa molar | 150,087 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido tartárico o ácido tártrico es un ácido orgánico dicarboxílico dihidroxilado, de fórmula molecular C4H6O6 y fórmula estructural semidesarrollada, HO
2CCH(OH)CH(OH)CO
2H. De acuerdo con la nomenclatura IUPAC, le corresponde el nombre de ácido 2,3-dihidroxibutanodioico. Contiene, por tanto, dos grupos carboxílicos y dos grupos alcohol en una cadena de hidrocarburo lineal de longitud cuatro. Se trata de una sustancia cristalina de color blanco que se puede obtener del zumo de uva y de algunas frutas, como tamarindos, los plátanos, los aguacates y los cítricos.[2] Tiene utilidad como aditivo alimentario (antioxidante E334) y como saborizante, para dar un toque amargo a los alimentos. Su sal más conocida, el bitartrato de potasio, comúnmente denominada crémor tártaro, se produce de forma natural durante el proceso de fermentación.
Origen y síntesis
[editar]El ácido tartárico ya era conocido desde muy antiguo, principalmente por los productores de vino, aunque fue en tiempos más modernos cuando se estableció un procedimiento de extracción, que fue desarrollado por el químico sueco Carl Wilhelm Scheele en 1769. Posee un pKa de 3.036, por lo que se considera un ácido débil.

El ácido tartárico jugó un papel importante en el descubrimiento de la quiralidad química. Esta propiedad del ácido tartárico fue observada por primera vez en 1832 por Jean Baptiste Biot, quien observó su capacidad para rotar la luz polarizada. Louis Pasteur continuó esta investigación en 1847 estudiando las formas de los cristales de tartrato de sodio y amonio, que descubrió que eran quirales, lo que supuso su primera contribución importante a la ciencia, verificar el dimorfismo del ácido tartárico. Observando con un microscopio los cristales, se percató que estos presentaban formas diferentes. Con ayuda de unas pinzas consiguió separarlos en dos grupos, disolviendo ambos grupos por separado, encontrando que una disolución era dextrógira y la otra levógira, pero que al mezclarlas, perdían toda actividad óptica. De esta forma se descubrió esta tipo de isomería, que se conoce como isomería óptica, que es consecuencia de la quiralidad que muestran algunas sustancias químicas en su estructura molecular.[3][4]
La forma natural del ácido que se obtiene del zumo de uva o de otros jugos vegetales, es el isómero ácido L-(+)-tartárico. originalmente denominado ácido d-tartárico, porque su actividad óptica se manifestaba girando el plano de la luz polarizada hacia el lado derecho. De acuerdo con la nomenclatura moderna, basada en la convención de Cahn, Ingold y Prelog,[5] le corresponde el nombre de ácido (2R,3R)-tartárico o más correctamente ácido (2R,3R)-2,3-dihydroxy-butanodioico. Al ser un compuesto quiral, le corresponde un esteroisómero, el ácido (2S,3S)-tartárico (ácido D-(-)-tartárico). El mesodiastómero se denomina ácido (2R,3S)-tartárico o ácido (2S,3R)-tartárico.
Aplicaciones
[editar]El ácido tartárico es un acidificante y conservante natural (E-334).[6] Este compuesto se encuentra principalmente en las uvas y es un subproducto de la industria vinícola, donde se utiliza como corrector de la acidez del vino. También se utiliza a escala industrial, en la preparación de bebidas efervescentes como gaseosas. De amplio uso en la industria alimentaria por su capacidad para modificar o disimular sabores no deseados como consecuencia de algunos tratamientos o por la adición de otras sustancias y por ser un estabilizador de otros ingredientes. Entre sus propiedades como aditivo alimentario, destacan:
- Regulador de pH: Ayuda a mantener la acidez deseada en alimentos y bebidas.
- Antioxidante: Previene la oxidación de otros ingredientes, prolongando la vida útil de los productos.
- Estabilizante de color: Mantiene el color original de los alimentos, especialmente en frutas y verduras.
- Mejorador de sabor: Aporta un sabor ácido característico, ligeramente amargo, mejorando el perfil de sabor de alimentos y bebidas.
- Agente quelante: Se une a metales pesados, evitando la degradación y manteniendo la calidad del alimento.
También se utiliza en fotografía y barnices y una variante conocida como sal de Rochelle (tartrato de sodio y potasio) constituye un suave laxante.

En algunas de sus formas, (bitartrato de potasio) se usa como condimento para la comida, donde se conoce como cremor tártaro. Se utiliza en diversas recetas, especialmente en repostería y confitería para aumentar el volumen de masas y preparaciones haciéndolo reaccionar con bicarbonato para obtener un sucedáneo de fermentación (levadura química). Se utiliza también para estabilizar claras de huevo además de poder realizar merengue y pasteles como pastel del Diablo.
Así mismo, el ácido tartárico se puede utilizar en análisis gravimétrico como agente precipitante de diversos elementos como el potasio, el sodio, el magnesio, el estroncio o el tántalo.
El ácido tartárico tiene uso como agente resolvente de racematos, así como en la purificación a nivel enantiomérico de compuestos con centro estereogénicos. En estos casos, estos racematos o compuestos susceptibles de ser enriquecidos a nivel de pureza enantiomérica con el ácido tartárico, deben tener puntos básicos (el más típico es una amina), para que el ácido tartárico correspondiente pueda formar una sal de tartrato de amonio, que sea cristalizable y aislable por filtración, y así enriquecer o resolver el pertinente compuesto quiral.
Véase también
[editar]Bibliografía
[editar]- Beyer, Hans; Walter, Wolfgang (1987). Manual de química orgánica. Reverte. ISBN 9788429170665. Consultado el 20 de septiembre de 2012.
- De Rosa, Tullio (1998). Tecnología de Los Vinos Blancos. Mundi-Prensa Libros. ISBN 9788471147004.
Referencias
[editar]- ↑ [http://webbook.nist.gov/cgi/cbook.cgi?ID=mezcla racémica: 133-37-9 isómero R,R: 87-69-4 isómero S,S: 147-71-7 mesoisómero: 147-73-9 Número CAS]
- ↑ PubChem. «DL-Tartaric acid». pubchem.ncbi.nlm.nih.gov (en inglés). Consultado el 3 de junio de 2024.
- ↑ Ensayo "La molécula tridimensional", séptimo capítulo del libro "El electrón es zurdo y otros ensayos" de Isaac Asimov, aproximadamente en el sitio 35,4 % del libro (aproximadamente en el sitio 30,8 % del ensayo)
- ↑ Asimov, Isaac (1980). «Cap. 7. Estructura molecular». Breve historia de la química. Alianza Editorial. p. 116. ISBN 84-206-1580-3.
- ↑ Cahn, R. S.; Ingold, C. K.; Prelog,V. (1956). «1956 - Experientia 1956, 12, 81-94 PDF» [Especificación de la configuración asimétrica en Química Orgánica]. Scribd. Consultado el 4 de junio de 2024.
- ↑ Organización de consumidores y usuarios (OCU). «Qué es el aditivo E334 Ácido tartárico (L(+)-)». www.ocu.org. Consultado el 4 de junio de 2024.
Enlaces externos
[editar] Wikimedia Commons alberga una galería multimedia sobre Ácido tartárico.
Wikimedia Commons alberga una galería multimedia sobre Ácido tartárico.


 French
French Deutsch
Deutsch