Castalagina , la enciclopedia libre
| Castalagina | ||
|---|---|---|
 | ||
| General | ||
| Otros nombres | Vescalagina | |
| Fórmula estructural | 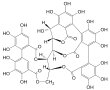 | |
| Fórmula molecular | C41H26O26 | |
| Identificadores | ||
| Número CAS | 24312-00-3[1] | |
| ChEMBL | 607711 | |
| PubChem | 3002104 | |
| UNII | BZ58QSX2MQ | |
| C1C2C(C3C4C(C5=C(C(=C(C(=C5C(=O)O4)C6=C(C(=C(C(=C6C(=O)O3)C7=C(C(=C(C=C7C(=O)O2)O)O)O)O)O)O)O)O)O)O)OC(=O)C8=CC(=C(C(=C8C9=C(C(=C(C=C9C(=O)O1)O)O)O)O)O)O | ||
| InChI=InChI=1S/C41H26O26/c42-8-1-5-12(24(48)21(8)45)13-6(2-9(43)22(46)25(13)49)39(60)65-34-11(4-63-37(5)58)64-38(59)7-3-10(44)23(47)26(50)14(7)15-18-16(28(52)32(56)27(15)51)17-19-20(30(54)33(57)29(17)53)31(55)35(66-41(19)62)36(34)67-40(18)61/h1-3,11,31,34-36,42-57H,4H2/t11-,31-,34-,35+,36+/m1/s1 Key: UDYKDZHZAKSYCO-JLQXGYSZSA-N | ||
| Propiedades físicas | ||
| Masa molar | 934,63 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Castalagina es un elagitanino, un tipo de tanino hidrolizable, que se encuentra en la madera de roble y castaño[2] y en la corteza del tallo de Anogeissus leiocarpus y Terminalia avicennoides.[3]
Castalagina e el (33beta)-isomero de vescalagina.[4] Durante el envejecimiento de alcoholes en barricas de roble , la vescalagina puede ser extraída de la madera y, posteriormente, puede transformarse en nuevos derivados de reacciones químicas.[5] Vescalagina es uno de los más abundantes elagitaninos extraídos de la madera de roble usando vino blanco.[6]
Derivados
[editar]El flavono-elagitanino conocido como acutissimin A se crea cuando el vescalagin tanino del roble interactúa con un flavonoide en el vino.
Biosíntesis
[editar]En algunas plantas, incluyendo el roble y el castaño, los elagitaninos se forman a partir de 1,2,3,4,6-pentagalloyl-glucosa y más elaborado mediante deshidrogenación oxidativa (formaciones de tellimagrandin II y casuarictin). Después de la conversión de casuarictina a pedunculagina, el anillo de piranosa de la glucosa se abre y se forma la familia de compuestos que incluyen casuariina, casuarinina, castalagina, y castlina, vescalagina y vescalina.[7]
Castalagina por lo tanto forma estructura de un penta galoil -glucosa. Castalagina y vescalagin (1,2,3,5- nonahydroxytriphenoyl -4,6- hexahydroxydiphenoyl -glucosa) pueden estar más polimerizada en sus correspondientes dímeros roburin A[8] y roburin D , y 33-carboxi-33-deoxyvescalagin.[9]
Glucósidos
[editar]Grandinina es un glucósido castalagina[10] mediante la unión de la pentosa lixosa.[11]
Referencias
[editar]- ↑ Número CAS
- ↑ Zahri, S; Belloncle, C; Charrier, F; Pardon, P; Quideau, S; Charrier, B (2007). «UV light impact on ellagitannins and wood surface colour of European oak (Quercus petraea and Quercus robur)». Applied Surface Science 253 (11): 4985-9. doi:10.1016/j.apsusc.2006.11.005.
- ↑ Shuaibu MN, Pandey K, Wuyep PA, et al. (noviembre de 2008). «Castalagin from Anogeissus leiocarpus mediates the killing of Leishmania in vitro». Parasitology Research 103 (6): 1333-8. PMID 18690475. doi:10.1007/s00436-008-1137-7.
- ↑ Vivas N, Laguerre M, Pianet de Boissel I, Vivas de Gaulejac N, Nonier MF (abril de 2004). «Conformational interpretation of vescalagin and castalagin physicochemical properties». Journal of Agricultural and Food Chemistry 52 (7): 2073-8. PMID 15053554. doi:10.1021/jf030460m.
- ↑ Puech JL, Mertz C, Michon V, Le Guernevé C, Doco T, Hervé Du Penhoat C (mayo de 1999). «Evolution of castalagin and vescalagin in ethanol solutions. Identification of new derivatives». Journal of Agricultural and Food Chemistry 47 (5): 2060-6. PMID 10552496. doi:10.1021/jf9813586.
- ↑ Marinov, M. G.; Dimitrova, E. D.; Puech, J. -L. (1997). «Kinetics of ellagitannin extraction from oak wood using white wine». Journal of Wine Research 8: 29-40. doi:10.1080/09571269708718095.
- ↑ Tannins chemistry by Hagerman A. E. Archivado el 26 de agosto de 2013 en Wayback Machine.
- ↑ Herve Du Penhoat, Catherine L.M.; Michon, Veronique M.F.; Ohassan, Abdelhamid; Peng, Shuyun; Scalbert, Augustin; Gage, Douglas (1991). «Roburin A, A dimeric ellagitannin from heartwood of Quercus robur». Phytochemistry 30: 329-32. doi:10.1016/0031-9422(91)84148-L.
- ↑ Glabasnia, Arne; Hofmann, Thomas (2007). «Identification and Sensory Evaluation of Dehydro- and Deoxy-ellagitannins Formed upon Toasting of Oak Wood (Quercus alba L.)». Journal of Agricultural and Food Chemistry 55 (10): 4109-18. PMID 17444655. doi:10.1021/jf070151m.
- ↑ Fridrich, Diana; Glabasnia, Arne; Fritz, Jessica; Esselen, Melanie; Pahlke, Gudrun; Hofmann, Thomas; Marko, Doris (2008). «Oak Ellagitannins Suppress the Phosphorylation of the Epidermal Growth Factor Receptor in Human Colon Carcinoma Cells». Journal of Agricultural and Food Chemistry 56 (9): 3010-15. PMID 18419129. doi:10.1021/jf073427z.
- ↑ Hofmann T, Glabasnia A, Schwarz B, Wisman KN, Gangwer KA, Hagerman AE (diciembre de 2006). «Protein Binding and Astringent Taste of a Polymeric Procyanidin, 1,2,3,4,6-Penta-O-galloyl-β-D-glucopyranose, Castalagin and Grandinin». Journal of Agricultural and Food Chemistry 54 (25): 9503-9. PMC 2597504. PMID 17147439. doi:10.1021/jf062272c.
Enlaces externos
[editar]- Esta obra contiene una traducción derivada de «Castalagin» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.


 French
French Deutsch
Deutsch