Ciclos biogeoquímicos marinos , la enciclopedia libre

Los ciclos biogeoquímicos marinos son ciclos biogeoquímicos que se producen en el medio marino, es decir, en el agua salada de los mares u océanos o en el agua salobre de los estuarios costeros. Estos ciclos biogeoquímicos son las vías por las que se mueven las sustancias y elementos químicos dentro del medio marino. Además, las sustancias y los elementos pueden importarse o exportarse del medio marino. Estas importaciones y exportaciones pueden producirse en forma de intercambios con la atmósfera, el fondo oceánico o la escorrentía terrestre.
Existen ciclos biogeoquímicos para los elementos calcio, carbono, hidrógeno, mercurio, nitrógeno, oxígeno, fósforo, selenio y azufre; ciclos moleculares para el agua y el sílice; ciclos macroscópicos como el ciclo de las rocas; así como ciclos inducidos por el hombre para compuestos sintéticos como el bifenilo policlorado (PCB). En algunos ciclos existen depósitos donde una sustancia puede almacenarse durante mucho tiempo. El ciclo de estos elementos está interconectado.
Los organismos marinos, y en particular los microorganismos marinos, son cruciales para el funcionamiento de muchos de estos ciclos. Las fuerzas que impulsan los ciclos biogeoquímicos incluyen procesos metabólicos en el interior de los organismos, procesos geológicos en los que interviene el manto terrestre, así como reacciones químicas entre las propias sustancias, razón por la que se denominan ciclos biogeoquímicos. Aunque las sustancias químicas pueden descomponerse y recombinarse, los propios elementos químicos no pueden ser creados ni destruidos por estas fuerzas, por lo que, aparte de algunas pérdidas y ganancias del espacio exterior, los elementos se reciclan o almacenan (secuestran) en algún lugar del planeta o dentro de él.
Descripción general
[editar]La energía fluye direccionalmente a través de los ecosistemas, entrando como luz solar (o moléculas inorgánicas para los quimioautótrofos) y saliendo como calor durante las numerosas transferencias entre niveles tróficos. Sin embargo, la materia que compone los organismos vivos se conserva y se recicla. Los seis elementos más comunes asociados a las moléculas orgánicas -carbono, nitrógeno, hidrógeno, oxígeno, fósforo y azufre- adoptan diversas formas químicas y pueden existir durante largos periodos en la atmósfera, en la tierra, en el agua o bajo la superficie terrestre. En este reciclaje de materiales intervienen procesos geológicos como la meteorización, la erosión, el drenaje del agua y la subducción de las placas continentales. Dado que la geología y la química desempeñan un papel fundamental en el estudio de este proceso, el reciclaje de materia inorgánica entre los organismos vivos y su entorno se denomina ciclo biogeoquímico.[1]
Los organismos utilizan los seis elementos mencionados de diversas formas. El hidrógeno y el oxígeno se encuentran en el agua y en las moléculas orgánicas, ambos esenciales para la vida. El carbono se encuentra en todas las moléculas orgánicas, mientras que el nitrógeno es un componente importante de los ácidos nucleicos y las proteínas. El fósforo se utiliza para fabricar ácidos nucleicos y los fosfolípidos que componen las membranas biológicas. El azufre es fundamental para la forma tridimensional de las proteínas. El ciclo de estos elementos está interconectado. Por ejemplo, el movimiento del agua es fundamental para la lixiviación del azufre y el fósforo en los ríos, que luego pueden desembocar en los océanos. Los minerales circulan por la biosfera entre los componentes bióticos y abióticos y de un organismo a otro.[2]
El ciclo del agua
[editar]
El agua es el medio de los océanos, el medio que transporta todas las sustancias y elementos que intervienen en los ciclos biogeoquímicos marinos. El agua, tal y como se encuentra en la naturaleza, casi siempre incluye sustancias disueltas, por lo que el agua ha sido descrita como el «disolvente universal» por su capacidad para disolver tantas sustancias.[3][4] Esta capacidad le permite ser el «disolvente de la vida».[5] El agua es también la única sustancia común que existe como sólido, líquido y gas en condiciones terrestres normales.[6] Dado que el agua líquida fluye, las aguas oceánicas circulan y fluyen en corrientes por todo el mundo. Como el agua cambia fácilmente de fase, puede ser transportada a la atmósfera en forma de vapor de agua o congelarse como un iceberg. Después puede precipitarse o fundirse para volver a convertirse en agua líquida. Toda la vida marina está inmersa en el agua, matriz y vientre de la vida misma.[7] El agua puede descomponerse en sus constituyentes hidrógeno y oxígeno mediante procesos metabólicos o abióticos, y posteriormente recombinarse para volver a convertirse en agua.
Aunque el ciclo del agua es en sí mismo un ciclo biogeoquímico, el flujo de agua por encima y por debajo de la Tierra es un componente clave del ciclo de otros productos biogeoquímicos.[8] La escorrentía es responsable de casi todo el transporte de sedimentos erosionados y fósforo de la tierra a las masas de agua.[9] La eutrofización cultural de los lagos se debe principalmente al fósforo, aplicado en exceso a los campos agrícolas en forma de fertilizantes, y luego transportado por tierra y río abajo. Tanto la escorrentía como las aguas subterráneas desempeñan un papel importante en el transporte de nitrógeno de la tierra a las masas de agua.[10] La zona muerta en la desembocadura del río Misisipi es consecuencia de los nitratos procedentes de los fertilizantes que se arrastran desde los campos agrícolas y se canalizan por el sistema fluvial hasta el Golfo de México. La escorrentía también interviene en el ciclo del carbono, de nuevo a través del transporte de roca y suelo erosionados.[11]
Salinidad del océano
[editar]La salinidad del océano se debe principalmente a la erosión de las rocas y al transporte de sales disueltas desde la tierra, con una contribución menor de las fuentes hidrotermales del fondo marino.[12] La evaporación del agua oceánica y la formación de hielo marino aumentan aún más la salinidad del océano. Sin embargo, estos procesos que aumentan la salinidad se ven continuamente contrarrestados por otros que la disminuyen, como la continua entrada de agua dulce procedente de los ríos, las precipitaciones de lluvia y nieve y la fusión del hielo.[13] Los dos iones más frecuentes en el agua de mar son el cloruro y el sodio. Juntos constituyen alrededor del 85% de todos los iones disueltos en el océano. Los iones de magnesio y sulfato constituyen la mayor parte del resto. La salinidad varía con la temperatura, la evaporación y las precipitaciones. Suele ser baja en el ecuador y los polos, y alta en las latitudes medias.[12]
- Salinidad media anual de la superficie del mar, medida en 2009 en unidades prácticas de salinidad[14]
- Diferencias verticales de la salinidad del mar entre la superficie y una profundidad de 300 metros. La salinidad aumenta con la profundidad en las regiones rojas y disminuye en las azules.[15]
Rocío marino
[editar]
Una corriente de microorganismos aerotransportados circula por el planeta por encima de los sistemas meteorológicos pero por debajo de las rutas aéreas comerciales.[16] Algunos microorganismos peripatéticos son arrastrados por tormentas de polvo terrestre, pero la mayoría proceden de microorganismos marinos presentes en el rocío marino. En 2018, los científicos informaron de que cientos de millones de virus y decenas de millones de bacterias se depositan diariamente en cada metro cuadrado alrededor del planeta.[17][18] Este es otro ejemplo de que el agua facilita el transporte de material orgánico a grandes distancias, en este caso en forma de microorganismos vivos.
La sal disuelta no se evapora a la atmósfera como el agua, pero forma aerosoles de sal marina en el aerosol marino. Muchos procesos físicos sobre la superficie oceánica generan aerosoles de sal marina. Una causa común es el estallido de burbujas de aire, que son arrastradas por la tensión del viento durante la formación de las olas de viento o whitecap. Otra es el desgarro de las gotas de la parte superior de las olas.[19] El flujo total de sal marina del océano a la atmósfera es de unas 3.300 Tg (3.300 millones de toneladas) al año.[20]
Circulación oceánica
[editar]
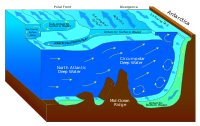
La radiación solar afecta a los océanos: el agua caliente del Ecuador tiende a circular hacia los polos, mientras que el agua fría polar se dirige hacia el Ecuador. Las corrientes superficiales vienen dictadas inicialmente por las condiciones de los vientos superficiales. Los alisios soplan hacia el oeste en los trópicos[21] y los vientos del oeste soplan hacia el este en latitudes medias.[22] Este patrón de vientos aplica una tensión a la superficie oceánica subtropical con una curvatura negativa en el hemisferio norte[23] y lo contrario en el hemisferio sur. El transporte de Sverdrup resultante es hacia el ecuador.[24] Debido a la conservación de la vorticidad potencial causada por los vientos que se mueven hacia el polo en la periferia occidental de la dorsal subtropical y el aumento de la vorticidad relativa del agua que se mueve hacia el polo, el transporte se equilibra mediante una corriente estrecha y acelerada hacia el polo, que fluye a lo largo del límite occidental de la cuenca oceánica, compensando los efectos de la fricción con la corriente fría del límite occidental que se origina en latitudes altas.[25] El proceso global, conocido como intensificación occidental, hace que las corrientes del límite occidental de una cuenca oceánica sean más fuertes que las del límite oriental.[26]
A medida que se desplaza hacia los polos, el agua caliente transportada por una fuerte corriente de agua cálida sufre un enfriamiento por evaporación. El enfriamiento es impulsado por el viento: el viento que se mueve sobre el agua la enfría y también provoca la evaporación, dejando una salmuera más salada. En este proceso, el agua se vuelve más salada y densa y disminuye su temperatura. Una vez que se forma el hielo marino, las sales quedan
fuera del hielo, un proceso conocido como exclusión de salmuera.[27] Estos dos procesos producen agua más densa y fría. El agua que atraviesa el océano Atlántico septentrional se vuelve tan densa que comienza a hundirse a través de agua menos salada y menos densa. Esta corriente descendente de agua pesada, fría y densa se convierte en parte de las aguas profundas del Atlántico Norte, una corriente que se dirige hacia el sur.[28]
Los vientos impulsan las corrientes oceánicas en los 100 metros superiores de la superficie del océano. Sin embargo, las corrientes oceánicas también fluyen a miles de metros por debajo de la superficie. Estas corrientes oceánicas profundas son impulsadas por diferencias en la densidad del agua, que está controlada por la temperatura (termo) y la salinidad (halina). Este proceso se conoce como circulación termohalina. En las regiones polares de la Tierra, el agua del océano se enfría mucho, formando hielo marino. Como consecuencia, el agua marina circundante se vuelve más salada, ya que cuando se forma el hielo marino, la sal se queda atrás. A medida que el agua del mar se vuelve más salada, su densidad aumenta y comienza a hundirse. El agua superficial es arrastrada para reemplazar el agua que se hunde, que a su vez acaba volviéndose lo suficientemente fría y salada como para hundirse. Esto da lugar a las
corrientes oceánicas profundas que impulsan la cinta transportadora global.[29]
| Tiempos medios de permanencia en los embalses [30] | |
|---|---|
| Reservorio | Tiempo de permanencia promedio |
| Antártica | 20,000 años |
| Océanos | 3,200 años |
| Glaciares | 20 a 100 años |
| Nieve estacional | 2 a 6 meses |
| Humedad del suelo | 1 a 2 meses |
| Aguas subterráneas: poco profundas | 100 a 200 años |
| Aguas subterráneas: profundas | 10,000 años |
| Lagos (véase el tiempo de retención de los lagos) | 50 a 100 años |
| Ríos | 2 a 6 años |
| Atmósfera | 9 días |

La circulación termohalina impulsa un sistema de corrientes a escala global llamado «cinta transportadora global». La cinta transportadora comienza en la superficie del océano, cerca del polo, en el Atlántico Norte. Allí, las temperaturas árticas enfrían el agua. También se vuelve más salada porque cuando se forma el hielo marino, la sal no se congela y se queda en el agua circundante. El agua fría es ahora más densa, debido a las sales añadidas, y se hunde hacia el fondo del océano. El agua superficial se desplaza para sustituir al agua que se hunde, creando así una corriente. Esta agua profunda se desplaza hacia el sur, entre los continentes, pasa el ecuador y desciende hasta los extremos de África y Sudamérica. La corriente recorre el borde de la Antártida, donde el agua se enfría y vuelve a hundirse, como en el Atlántico Norte. Así, la cinta transportadora se «recarga». A medida que se desplaza alrededor de la Antártida, dos secciones se separan de la cinta transportadora y giran hacia el norte. Una sección se desplaza hacia el Océano Índico y la otra hacia el Océano Pacífico. Estas dos secciones que se separan se calientan y se vuelven menos densas a medida que viajan hacia el norte, hacia el ecuador, de modo que suben a la superficie (afloramiento). A continuación, vuelven a girar hacia el sur y el oeste, hacia el Atlántico Sur, para regresar finalmente al Atlántico Norte, donde el ciclo comienza de nuevo. La cinta transportadora se mueve a velocidades mucho más lentas (unos pocos centímetros por segundo) que las corrientes impulsadas por el viento o las mareas (de decenas a cientos de centímetros por segundo). Se calcula que cualquier metro cúbico de agua tarda unos 1.000 años en completar el viaje a lo largo de la cinta transportadora mundial. Además, la cinta transportadora mueve un inmenso volumen de agua: más de 100 veces el caudal del río Amazonas (Ross, 1995). La cinta transportadora es también un componente vital de los ciclos globales de nutrientes oceánicos y de dióxido de carbono. Las aguas superficiales cálidas pierden nutrientes y dióxido de carbono, pero vuelven a enriquecerse cuando recorren la cinta transportadora en forma de capas profundas o de fondo. La base de la cadena alimentaria mundial depende de las aguas frías, ricas en nutrientes, que favorecen el crecimiento de algas y algas marinas.[31]
El tiempo medio de permanencia de una molécula de agua en el océano es de unos 3.200 años. En comparación, el tiempo medio de permanencia en la atmósfera es de unos nueve días. Si se congela en la Antártida o se introduce en aguas subterráneas profundas, puede permanecer secuestrada durante diez mil años.[32][33]
Ciclo de elementos clave
[editar]| Some key elements involved in marine biogeochemical cycles | ||
|---|---|---|
| Elemento | Diagrama | Descripción |
| Carbono |  | El ciclo marino del carbono implica procesos que intercambian carbono entre diversos reservorios dentro del océano, así como entre la atmósfera, el interior de la Tierra y el fondo marino. El ciclo del carbono es el resultado de la interacción de muchas fuerzas a lo largo de múltiples escalas temporales y espaciales que hacen circular el carbono por el planeta, garantizando su disponibilidad global. El ciclo del carbono marino es un elemento central del ciclo global del carbono y contiene tanto carbono inorgánico (carbono no asociado a un ser vivo, como el dióxido de carbono) como carbono orgánico (carbono que está, o ha estado, incorporado a un ser vivo). Parte del ciclo del carbono marino transforma el carbono entre materia no viva y materia viva. Tres procesos principales (o bombas) que componen el ciclo marino del carbono llevan el dióxido de carbono atmosférico (CO2) al interior del océano y lo distribuyen por los océanos. Estas tres bombas son: (1) la bomba de solubilidad, (2) la bomba de carbonatos y (3) la bomba biológica. La reserva activa total de carbono en la superficie de la Tierra durante periodos inferiores a 10.000 años es de aproximadamente 40.000 gigatoneladas de C (Gt C, una gigatonelada equivale a mil millones de toneladas, o al peso de aproximadamente 6 millones de ballenas azules), y cerca del 95% (~38.000 Gt C) se almacena en el océano, principalmente en forma de carbono inorgánico disuelto.[34][35] La especiación del carbono inorgánico disuelto en el ciclo del carbono marino es uno de los principales controladores de la química ácido-base en los océanos. |
| Oxígeno |  | El ciclo del oxígeno implica transiciones biogeoquímicas de átomos de oxígeno entre diferentes estados de oxidación en iones, óxidos y moléculas a través de reacciones redox dentro y entre las esferas/reservorios del planeta Tierra.[36] La palabra oxígeno en la literatura se refiere típicamente al oxígeno molecular (O2) ya que es el producto común o reactante de muchas reacciones redox biogeoquímicas dentro del ciclo.[37] Los procesos dentro del ciclo del oxígeno se consideran biológicos o geológicos y se evalúan como fuente (producción de O2) o sumidero (consumo de O2).[36][37] |
| Hidrógeno |  | El ciclo del hidrógeno consiste en intercambios de hidrógeno entre fuentes y sumideros bióticos (vivos) y abióticos (no vivos) de compuestos que contienen hidrógeno. El hidrógeno (H) es el elemento más abundante del universo.[38] En la Tierra, las moléculas inorgánicas que contienen H son el agua (H2O), el hidrógeno gaseoso (H2), el metano (CH4), el ácido sulfhídrico (H2S) y el amoníaco (NH3). Muchos compuestos orgánicos también contienen átomos de H, como los hidrocarburos y la materia orgánica. Dada la ubicuidad de los átomos de hidrógeno en los compuestos químicos inorgánicos y orgánicos, el ciclo del hidrógeno se centra en el hidrógeno molecular (H2). |
| Nitrógeno |  | El ciclo del nitrógeno es el proceso mediante el cual el nitrógeno se convierte en múltiples formas químicas a medida que circula entre la atmósfera y los ecosistemas terrestres y marinos. La conversión del nitrógeno puede llevarse a cabo mediante procesos tanto biológicos como físicos. Entre los procesos importantes del ciclo del nitrógeno se encuentran la fijación, la amonificación, la nitrificación y la desnitrificación. El 78% de la atmósfera terrestre es nitrógeno molecular (N2),[39] lo que la convierte en la mayor fuente de nitrógeno. Sin embargo, el nitrógeno atmosférico tiene una disponibilidad limitada para su uso biológico, lo que provoca una escasez de nitrógeno utilizable en muchos tipos de ecosistemas. El ciclo del nitrógeno es de especial interés para los ecólogos porque la disponibilidad de nitrógeno puede afectar a la tasa de procesos clave de los ecosistemas, como la producción primaria y la descomposición. Actividades humanas como la combustión de combustibles fósiles, el uso de fertilizantes nitrogenados artificiales y la liberación de nitrógeno en las aguas residuales han alterado drásticamente el ciclo global del nitrógeno.[40][41][42] La modificación humana del ciclo global del nitrógeno puede afectar negativamente al sistema medioambiental natural y también a la salud humana.[43][44] |
| Fósforo |  | El ciclo del fósforo es el movimiento del fósforo a través de la litosfera, la hidrosfera y la biosfera. A diferencia de muchos otros ciclos biogeoquímicos, la atmósfera no desempeña un papel significativo en el movimiento del fósforo, porque el fósforo y los compuestos basados en el fósforo suelen ser sólidos en los rangos típicos de temperatura y presión que se encuentran en la Tierra. La producción de gas fosfina sólo se produce en condiciones locales especializadas. Por lo tanto, el ciclo del fósforo debe considerarse desde el sistema terrestre en su conjunto y, a continuación, centrarse específicamente en el ciclo en los sistemas terrestres y acuáticos. Localmente, las transformaciones del fósforo son químicas, biológicas y microbiológicas: las principales transferencias a largo plazo en el ciclo global, sin embargo, están impulsadas por los movimientos tectónicos en el tiempo geológico.[45]Los seres humanos han provocado importantes cambios en el ciclo global del fósforo a través del transporte de minerales fosforados y el uso de fertilizantes fosforados, así como el transporte de alimentos de las granjas a las ciudades, donde se pierden en forma de efluentes. |
| Sulfuro |  | El ciclo del azufre es el conjunto de procesos por los que el azufre se desplaza entre las rocas, los cursos de agua y los sistemas vivos. Estos ciclos biogeoquímicos son importantes en geología porque afectan a muchos minerales. Los ciclos bioquímicos también son importantes para la vida porque el azufre es un elemento esencial, ya que es un constituyente de muchas proteínas y cofactores, y los compuestos de azufre pueden utilizarse como oxidantes o reductores en la respiración microbiana.[46] El ciclo global del azufre implica las transformaciones de las especies de azufre a través de diferentes estados de oxidación, que desempeñan un papel importante tanto en los procesos geológicos como en los biológicos. El principal sumidero de azufre de la Tierra son los océanos SO42-, donde es el principal agente oxidante.[47] |
| Hierro |  | El ciclo del hierro (Fe) es el ciclo biogeoquímico del hierro a través de la atmósfera, la hidrosfera, la biosfera y la litosfera. Aunque el Fe es muy abundante en la corteza terrestre,[48]es menos común en aguas superficiales oxigenadas. El hierro es un micronutriente clave en la productividad primaria,[49]y un nutriente limitante en el océano Austral, el Pacífico ecuatorial oriental y el Pacífico subártico, conocidas como regiones oceánicas de alto contenido en nutrientes y bajo contenido en clorofila (HNLC).[50]El hierro existe en una gama de estados de oxidación de -2 a +7; sin embargo, en la Tierra se encuentra predominantemente en su estado redox +2 o +3 y es un metal redox activo primario en la Tierra.[51] El ciclo del hierro entre sus estados de oxidación +2 y +3 se denomina ciclo del hierro. Este proceso puede ser totalmente abiótico o facilitado por microorganismos, especialmente bacterias que oxidan el hierro. Los procesos abióticos incluyen la oxidación de metales ferrosos, donde el Fe2+ se oxida abióticamente a Fe3+ en presencia de oxígeno, y la reducción de Fe3+ a Fe2+ por minerales de sulfuro de hierro. El ciclo biológico del Fe2+ lo realizan microbios oxidantes y reductores del hierro.[52][53] |
| Cálcio |  | El ciclo del calcio es una transferencia de calcio entre las fases disuelta y sólida. Existe un suministro continuo de iones de calcio a los cursos de agua procedentes de rocas, organismos y suelos.[54][55]Los iones de calcio se consumen y se eliminan de los medios acuosos al reaccionar para formar estructuras insolubles como el carbonato cálcico y el silicato cálcico,[54][56] que pueden depositarse para formar sedimentos o los exoesqueletos de organismos.[57] Los iones de calcio también pueden utilizarse biológicamente, ya que el calcio es esencial para funciones biológicas como la producción de huesos y dientes o la función celular.[58][59] El ciclo del calcio es un hilo conductor entre los procesos terrestres, marinos, geológicos y biológicos.[60] El ciclo del calcio marino se ve afectado por el cambio del dióxido de carbono atmosférico debido a la acidificación de los océanos.[57] |
| Silicio |  | El ciclo del sílice implica el transporte de sílice entre los sistemas de la Tierra. El sílice ópalo (SiO2), también llamado dióxido de silicio, es un compuesto químico de silicio. El silicio es un elemento bioesencial y uno de los más abundantes de la Tierra.[61][62] El ciclo del sílice se solapa de forma significativa con el ciclo del carbono (véase el ciclo del carbonato-silicato) y desempeña un papel importante en el secuestro del carbono a través de la meteorización continental, la exportación biogénica y el enterramiento en forma de rezumes en escalas de tiempo geológicas.[63] |
Modelos en caja
[editar]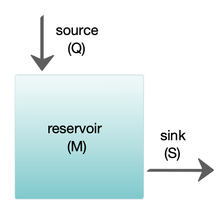
Los modelos de caja se utilizan ampliamente para modelizar sistemas biogeoquímicos.[65] Los modelos de caja son versiones simplificadas de sistemas complejos, reduciéndolos a cajas (o depósitos de almacenamiento) de materiales químicos, vinculados por flujos de materiales (flujos). Los modelos de caja simples tienen un pequeño número de cajas con propiedades, como el volumen, que no cambian con el tiempo. Se supone que las cajas se comportan como si estuvieran mezcladas homogéneamente.[64] Estos modelos se utilizan a menudo para derivar fórmulas analíticas que describen la dinámica y la abundancia en estado estacionario de las especies químicas implicadas.
El diagrama de la derecha muestra un modelo básico de una caja. El depósito contiene la cantidad de material M considerada, definida por sus propiedades químicas, físicas o biológicas. La fuente Q es el flujo de material que entra en el depósito, y el sumidero S es el flujo de material que sale del depósito. El balance es la comprobación y el equilibrio de las fuentes y los sumideros que afectan a la renovación del material en un yacimiento. El yacimiento se encuentra en estado estacionario si Q = S, es decir, si las fuentes equilibran los sumideros y no se producen cambios a lo largo del tiempo.[64]
Los modelos de cajas biogeoquímicas globales suelen medir: — «masas de embalse» en petagramas (Pg) — flujos de flujo en petagramos por año (Pg yr−1) Los diagramas de este artículo utilizan principalmente estas unidades ________________________________________________ un petagrama = 1015 gramos = una gigatonelada = un billón (109) toneladas |
El tiempo de rotación (también llamado tiempo de renovación o edad de salida) es el tiempo medio que el material pasa residiendo en el depósito. Si el embalse se encuentra en estado estacionario, es el mismo tiempo que se tarda en llenarlo o vaciarlo. Así, si τ es el tiempo de renovación, entonces τ = M/S.[64] La ecuación que describe la tasa de cambio del contenido de un depósito es:
Cuando dos o más depósitos están conectados, puede considerarse que el material circula entre los depósitos, y puede haber patrones predecibles en el flujo cíclico.[64] Los modelos multicaja más complejos suelen resolverse mediante técnicas numéricas.


El diagrama anterior muestra un presupuesto simplificado de los flujos de carbono oceánico. Se compone de tres sencillos modelos de caja interconectados, uno para la zona eufótica, otro para el interior del océano u océano oscuro y otro para los sedimentos oceánicos. En la zona eufótica, la producción neta de fitoplancton es de unos 50 Pg de C al año. Alrededor de 10 Pg se exportan al interior del océano, mientras que los otros 40 Pg se respiran. La degradación del carbono orgánico se produce a medida que las partículas (nieve marina) se depositan en el interior del océano. Sólo 2 Pg llegan finalmente al fondo marino, mientras que los otros 8 Pg son respirados en el océano oscuro. En los sedimentos, la escala de tiempo disponible para la degradación aumenta en órdenes de magnitud con el resultado de que el 90% del carbono orgánico aportado se degrada y sólo 0,2 Pg C yr-1 se entierra finalmente y se transfiere de la biosfera a la geosfera.[66]
El diagrama anterior muestra un presupuesto simplificado de los flujos de carbono oceánico. Se compone de tres sencillos modelos de caja interconectados, uno para la zona eufótica, otro para el interior del océano u océano oscuro y otro para los sedimentos oceánicos. En la zona eufótica, la producción neta de fitoplancton es de unos 50 Pg de C al año. Alrededor de 10 Pg se exportan al interior del océano, mientras que los otros 40 Pg se respiran. La degradación del carbono orgánico se produce a medida que las partículas (nieve marina) se depositan en el interior del océano. Sólo 2 Pg llegan finalmente al fondo marino, mientras que los otros 8 Pg son respirados en el océano oscuro. En los sedimentos, la escala de tiempo disponible para la degradación aumenta en órdenes de magnitud con el resultado de que el 90% del carbono orgánico aportado se degrada y sólo 0,2 Pg C yr-1 se entierra finalmente y se transfiere de la biosfera a la geosfera.[66]
Materias disueltas y partículas
[editar]


Bomba biológica
[editar]
La bomba biológica, en su forma más simple, es el secuestro biológico del carbono del océano desde la atmósfera hacia el interior del océano y los sedimentos del fondo marino.[75] Es la parte del ciclo del carbono oceánico responsable del ciclo de la materia orgánica formada principalmente por el fitoplancton durante la fotosíntesis (bomba de tejido blando), así como del ciclo del carbonato cálcico (CaCO3) formado en conchas por ciertos organismos como el plancton y los moluscos (bomba de carbonato).[76]
La bomba biológica puede dividirse en tres fases distintas,[77] la primera de las cuales es la producción de carbono fijo por fotótrofos planctónicos en la región superficial eufótica (iluminada por el sol) del océano. En estas aguas superficiales, el fitoplancton utiliza dióxido de carbono (CO2), nitrógeno (N), fósforo (P) y otros oligoelementos (bario, hierro, zinc, etc.) durante la fotosíntesis para producir carbohidratos, lípidos y proteínas. Algunos plancton (por ejemplo, los cocolitóforos y los foraminíferos) combinan calcio (Ca) y carbonatos disueltos (ácido carbónico y bicarbonato) para formar una capa protectora de carbonato cálcico (CaCO3).
Una vez que este carbono se fija en el tejido blando o duro, los organismos permanecen en la zona eufótica para ser reciclados como parte del ciclo regenerativo de nutrientes o, una vez que mueren, pasan a la segunda fase de la bomba biológica y comienzan a hundirse hasta el fondo del océano. Las partículas que se hunden suelen formar agregados a medida que se hunden, lo que aumenta enormemente la velocidad de hundimiento. Es esta agregación la que da a las partículas una mejor oportunidad de escapar a la depredación y descomposición en la columna de agua y finalmente llegar al fondo marino.
Una vez que este carbono se fija en el tejido blando o duro, los organismos permanecen en la zona eufótica para ser reciclados como parte del ciclo regenerativo de nutrientes o, una vez que mueren, pasan a la segunda fase de la bomba biológica y comienzan a hundirse hasta el fondo del océano. Las partículas que se hunden suelen formar agregados a medida que se hunden, lo que aumenta enormemente la velocidad de hundimiento. Es esta agregación la que da a las partículas una mejor oportunidad de escapar a la depredación y descomposición en la columna de agua y finalmente llegar al fondo marino.
El carbono fijado que es descompuesto por las bacterias en el descenso o una vez en el fondo marino entra entonces en la fase final de la bomba y es remineralizado para ser utilizado de nuevo en la producción primaria. Las partículas que escapan totalmente a estos procesos quedan secuestradas en el sedimento y pueden permanecer allí durante millones de años. Este carbono secuestrado es el responsable, en última instancia, de la reducción del CO2 atmosférico.
| Video externo | ||
|---|---|---|
| | ||
Atención: este archivo está alojado en un sitio externo, fuera del control de la Fundación Wikimedia. |
- Brum JR, Morris JJ, Décima M and Stukel MR (2014) "Mortality in the oceans: Causes and consequences". Eco-DAS IX Symposium Proceedings, Chapter 2, pages 16–48. Association for the Sciences of Limnology and Oceanography. ISBN 978-0-9845591-3-8.
- Mateus, M.D. (2017) "Bridging the gap between knowing and modeling viruses in marine systems—An upcoming frontier". Frontiers in Marine Science, 3: 284. doi 10.3389/fmars.2016.00284
- Beckett, S.J. and Weitz, J.S. (2017) "Disentangling niche competition from grazing mortality in phytoplankton dilution experiments". PLOS ONE, 12(5): e0177517. doi 10.1371/journal.pone.0177517.
Rol de los microorganismos
[editar]

Ciclos del carbono, oxígeno e hidrógeno
[editar]El ciclo del carbono marino se compone de procesos que intercambian carbono entre diversos reservorios dentro del océano, así como entre la atmósfera, el interior de la Tierra y el fondo marino. El ciclo del carbono es el resultado de la interacción de muchas fuerzas a lo largo de múltiples escalas temporales y espaciales que hacen circular el carbono por todo el planeta, garantizando su disponibilidad global. El ciclo oceánico del carbono es un proceso central del ciclo global del carbono y contiene tanto carbono inorgánico (carbono no asociado a un ser vivo, como el dióxido de carbono) como carbono orgánico (carbono que está, o ha estado, incorporado a un ser vivo). Parte del ciclo del carbono marino transforma el carbono entre materia no viva y materia viva.

Tres procesos principales (o bombas) que componen el ciclo marino del carbono llevan el dióxido de carbono (CO2) atmosférico al interior del océano y lo distribuyen por los océanos. Estas tres bombas son: (1) la bomba de solubilidad, (2) la bomba de carbonatos y (3) la bomba biológica. La reserva activa total de carbono en la superficie de la Tierra durante periodos inferiores a 10.000 años es de aproximadamente 40.000 gigatoneladas de C (Gt C, una gigatonelada es mil millones de toneladas, o el peso de aproximadamente 6 millones de ballenas azules), y cerca del 95% (~38.000 Gt C) está almacenado en el océano, principalmente como carbono inorgánico disuelto.[34][35] La especiación del carbono inorgánico disuelto en el ciclo del carbono marino es un controlador primario de la química ácido-base en los océanos.

| Formas de carbono [80] | |||
|---|---|---|---|
| Forma de carbono | Fórmula química | Estado | Reservorio principal |
| dióxido de carbono | CO2 | gas | atmósfera |
| ácido carbónico | H2CO3 | líquido | océano |
| ion bicarbonato | HCO3− | líquido (ion disuelto) | océano |
| compuestos orgánicos | Ejemplos: C6H12O6 (glucosa) CH4 (metano) | gas sólido | organismos marinos sedimentos orgánicos (combustibles fósiles) |
| otros compuestos de carbono | Ejemplos: CaCO3 (carbonato cálcico) CaMg(CO3)2 (carbonato cálcico y magnésico) | sólido | conchas roca sedimentaria |
Ciclos del nitrógeno y el fósforo
[editar]

El ciclo del nitrógeno es tan importante en el océano como en tierra firme. Aunque el ciclo general es similar en ambos casos, existen diferentes actores y modos de transferencia del nitrógeno en el océano.[81] El nitrógeno entra en el océano a través de las precipitaciones, la escorrentía o como N2 procedente de la atmósfera. El nitrógeno no puede ser utilizado por el fitoplancton como N2, por lo que debe someterse a la fijación de nitrógeno, que es realizada predominantemente por cianobacterias.[82] Sin suministros de nitrógeno fijado que entren en el ciclo marino, el nitrógeno fijado se agotaría en unos 2000 años.[83] El fitoplancton necesita nitrógeno en formas biológicamente disponibles para la síntesis inicial de materia orgánica. El amoníaco y la urea se liberan al agua por excreción del plancton. Las fuentes de nitrógeno se eliminan de la zona eufótica por el movimiento descendente de la materia orgánica. Esto puede ocurrir por el hundimiento del fitoplancton, la mezcla vertical o el hundimiento de los residuos de los migradores verticales. El hundimiento hace que el amoníaco se introduzca a profundidades más bajas por debajo de la zona eufótica. Las bacterias son capaces de convertir el amoníaco en nitrito y nitrato, pero la luz las inhibe, por lo que esto debe ocurrir por debajo de la zona eufótica.[82] Las bacterias realizan la amonificación o mineralización para convertir el nitrógeno orgánico en amoníaco. A continuación, puede producirse la nitrificación para convertir el amonio en nitrito y nitrato.[84] El nitrato puede volver a la zona eufótica mediante la mezcla vertical y el afloramiento, donde puede ser absorbido por el fitoplancton para continuar el ciclo. El N2 puede devolverse a la atmósfera mediante la desnitrificación.
Se cree que el amonio es la fuente preferida de nitrógeno fijo para el fitoplancton porque su asimilación no implica una reacción redox y, por tanto, requiere poca energía. El nitrato requiere una reacción redox para su asimilación, pero es más abundante, por lo que la mayoría del fitoplancton se ha adaptado para disponer de las enzimas necesarias para llevar a cabo esta reducción (nitrato reductasa). Hay algunas excepciones notables y bien conocidas que incluyen la mayoría de los Prochlorococcus y algunos Synechococcus que sólo pueden absorber nitrógeno en forma de amonio.[83]
El fósforo es un nutriente esencial para plantas y animales. El fósforo es un nutriente limitante para los organismos acuáticos. El fósforo forma parte de importantes moléculas que sustentan la vida y que son muy comunes en la biosfera. El fósforo entra en la atmósfera en cantidades muy pequeñas cuando el polvo se disuelve en el agua de lluvia y la niebla marina, pero permanece sobre todo en la tierra y en los minerales de la roca y el suelo. El 80% del fósforo extraído se utiliza para fabricar fertilizantes. Los fosfatos procedentes de fertilizantes, aguas residuales y detergentes pueden contaminar lagos y arroyos. El enriquecimiento excesivo de fosfato tanto en aguas dulces como en aguas marinas costeras puede provocar floraciones masivas de algas que, al morir y descomponerse, sólo conducen a la eutrofización de las aguas dulces. Investigaciones recientes sugieren que el contaminante predominante responsable de la proliferación de algas en estuarios de agua salada y hábitats marinos costeros es el nitrógeno.[85]
El fósforo es más abundante en la naturaleza como parte del ion ortofosfato (PO4)3-, formado por un átomo de P y 4 átomos de oxígeno. En tierra, la mayor parte del fósforo se encuentra en rocas y minerales. Los depósitos ricos en fósforo se han formado generalmente en el océano o a partir del guano y, con el tiempo, los procesos geológicos traen sedimentos oceánicos a la tierra. La meteorización de rocas y minerales libera fósforo en forma soluble, que es absorbido por las plantas y transformado en compuestos orgánicos. A continuación, las plantas pueden ser consumidas por los herbívoros y el fósforo se incorpora a sus tejidos o se excreta. Tras su muerte, el animal o la planta se descomponen y el fósforo vuelve al suelo, donde una gran parte del fósforo se transforma en compuestos insolubles. La escorrentía puede transportar una pequeña parte del fósforo de vuelta al océano.[86]
Ciclo de nutrientes
[editar]
Un ciclo de nutrientes es el movimiento e intercambio de materia orgánica e inorgánica de vuelta a la producción de materia. El proceso está regulado por las vías disponibles en las redes tróficas marinas, que en última instancia descomponen la materia orgánica de nuevo en nutrientes inorgánicos. Los ciclos de los nutrientes se producen dentro de los ecosistemas. El flujo de energía sigue siempre una trayectoria unidireccional y no cíclica, mientras que el movimiento de los nutrientes minerales es cíclico. Los ciclos minerales incluyen el ciclo del carbono, el ciclo del oxígeno, el ciclo del nitrógeno, el ciclo del fósforo y el ciclo del azufre, entre otros, que se reciclan continuamente junto con otros nutrientes minerales en una nutrición ecológica productiva.
Existe un considerable solapamiento entre los términos ciclo biogeoquímico y ciclo de los nutrientes. Algunos libros de texto los integran y parecen tratarlos como términos sinónimos.[88] Sin embargo, los términos suelen aparecer de forma independiente. El ciclo de los nutrientes se utiliza más a menudo en referencia directa a la idea de un ciclo intrasistema, en el que un ecosistema funciona como una unidad. Desde un punto de vista práctico, no tiene sentido evaluar un ecosistema terrestre considerando toda la columna de aire que hay sobre él, así como las grandes profundidades de la Tierra que hay bajo él. Aunque un ecosistema no suele tener límites claros, como modelo de trabajo resulta práctico considerar la comunidad funcional donde se produce la mayor parte de la transferencia de materia y energía.[89] El ciclo de los nutrientes se produce en ecosistemas que participan en los «ciclos biogeoquímicos más amplios de la Tierra a través de un sistema de entradas y salidas».[89]
Nutrientes disueltos
[editar]Los nutrientes disueltos en el agua de mar son esenciales para la supervivencia de la vida marina. El nitrógeno y el fósforo son especialmente importantes. Se consideran nutrientes limitantes en muchos entornos marinos, porque los productores primarios, como las algas y las plantas marinas, no pueden crecer sin ellos. Son fundamentales para estimular la producción primaria del fitoplancton. Otros nutrientes importantes son el silicio, el hierro y el zinc.[90]
El proceso de ciclaje de los nutrientes en el mar comienza con el bombeo biológico, cuando el fitoplancton extrae los nutrientes de las aguas superficiales para convertirlos en parte de su composición orgánica. El fitoplancton es devorado por otros organismos o muere y desciende como nieve marina. Allí se descomponen y vuelven al estado disuelto, pero a mayores profundidades oceánicas. La fertilidad de los océanos depende de la
abundancia de nutrientes y se mide por la producción primaria, que es la tasa de fijación de carbono por unidad de agua y por unidad de tiempo. «La producción primaria se suele cartografiar por satélite utilizando la distribución de la clorofila, que es un pigmento producido por las plantas que absorbe energía durante la fotosíntesis. La distribución de la clorofila se muestra en la figura anterior. Se puede ver la mayor abundancia cerca de las costas, donde los nutrientes de la tierra son alimentados por los ríos. El otro lugar donde los niveles de clorofila son altos es en las zonas de afloramiento, donde los nutrientes son llevados a la superficie del océano desde las profundidades por el proceso de afloramiento...".[90]

«Otro elemento crítico para la salud de los océanos es el contenido de oxígeno disuelto. El oxígeno en la superficie del océano se añade continuamente a través de la interfaz aire-mar, así como por fotosíntesis; se consume en la respiración de los organismos marinos y durante la descomposición u oxidación de la materia orgánica que llueve en el océano y se deposita en el fondo oceánico. La mayoría de los organismos necesitan oxígeno, por lo que su agotamiento tiene efectos adversos para las poblaciones marinas. La temperatura también afecta a los niveles de oxígeno, ya que las aguas cálidas pueden retener menos oxígeno disuelto que las frías. Esta relación tendrá importantes implicaciones para los océanos del futuro, como veremos... La última propiedad del agua de mar que consideraremos es el contenido de CO2 disuelto. El CO2 es casi opuesto al oxígeno en muchos procesos químicos y biológicos; es consumido por el plancton durante la fotosíntesis y repuesto durante la respiración, así como durante la oxidación de la materia orgánica. Como veremos más adelante, el contenido de CO2 tiene importancia para el estudio del envejecimiento de las aguas profundas".[90]

Ciclo marino del azufre
[editar]
La reducción de sulfatos en los fondos marinos está fuertemente focalizada hacia los sedimentos cercanos a la superficie, con altas tasas deposicionales a lo largo de los márgenes oceánicos. El ciclo del azufre marino bentónico es, por tanto, sensible a la influencia antropogénica, como el calentamiento de los océanos y el aumento de la carga de nutrientes en los mares costeros. Esto estimula la productividad fotosintética y da lugar a una mayor exportación de materia orgánica al fondo marino, a menudo combinada con una baja concentración de oxígeno en el agua del fondo (Rabalais et al., 2014; Breitburg et al., 2018). De este modo, la zonación biogeoquímica se comprime hacia la superficie del sedimento y el equilibrio de la mineralización de la materia orgánica se desplaza de los procesos óxicos y subóxicos hacia la reducción del sulfato y la metanogénesis (Middelburg y Levin, 2009).[91]

El ciclo del azufre en ambientes marinos ha sido bien estudiado mediante la herramienta de la sistemática isotópica del azufre expresada como δ34S. Los océanos globales modernos tienen un almacenamiento de azufre de 1,3 × 1021 g,[92] principalmente en forma de sulfato con un valor δ34S de +21‰.[93] El flujo global de entrada es de 1,0 × 1014 g/año con una composición isotópica de azufre de ~3‰.[[93] El sulfato fluvial derivado de la meteorización terrestre de minerales sulfurados (δ34S = +6‰) es la principal entrada de azufre en los océanos. Otras fuentes son la desgasificación metamórfica y volcánica y la actividad hidrotermal (δ34S = 0‰), que liberan especies reducidas de azufre (por ejemplo, H2S y S0). Hay dos salidas principales de azufre de los océanos. El primer sumidero es el enterramiento de sulfato, ya sea como evaporitas marinas (por ejemplo, yeso) o sulfato asociado a carbonato (CAS), que representa 6 × 1013 g/año (δ34S = +21‰). El segundo sumidero de azufre es el enterramiento de pirita en los sedimentos de la plataforma o en los sedimentos del fondo marino profundo (4 × 1013 g/año; δ34S = -20‰).[94]] El flujo total de salida de azufre marino es de 1.0 × 1014 g/año que coincide con los flujos de entrada, lo que implica que el presupuesto de azufre marino moderno está en estado estacionario.[93] El tiempo de residencia del azufre en los océanos globales modernos es de 13.000.000 años.[95]
En los océanos modernos, Hydrogenovibrio crunogenus, Halothiobacillus y Beggiatoa son bacterias primarias oxidantes del azufre,[96][97] y forman simbiosis quimiosintéticas con huéspedes animales.[98] El huésped proporciona sustratos metabólicos (por ejemplo, CO2, O2, H2O) al simbionte, mientras que el simbionte genera carbono orgánico para mantener las actividades metabólicas del huésped. El sulfato producido suele combinarse con los iones de calcio lixiviados para formar yeso, que puede formar depósitos muy extendidos cerca de los centros de extensión oceánica media.[99]
Los respiraderos hidrotermales emiten sulfuro de hidrógeno que favorece la fijación de carbono por bacterias quimiolitotróficas que oxidan el sulfuro de hidrógeno con oxígeno para producir azufre elemental o sulfato.[96]
Ciclo del hierro y polvo
[editar]
El ciclo del hierro (Fe) es el ciclo biogeoquímico del hierro a través de la atmósfera, la hidrosfera, la biosfera y la litosfera. Aunque el Fe es muy abundante en la corteza terrestre,[104] es menos común en las aguas superficiales oxigenadas. El hierro es un micronutriente clave en la productividad primaria,[49] y un nutriente limitante en el océano Austral, el Pacífico ecuatorial oriental y el Pacífico subártico, conocidas como regiones oceánicas de alto contenido en nutrientes y bajo contenido en clorofila (HNLC).[50]
En el océano, el hierro circula entre el plancton, las partículas agregadas (hierro no biodisponible) y el hierro disuelto (hierro biodisponible), y se convierte en sedimento al enterrarse.[100][105][106] Las fuentes hidrotermales liberan hierro ferroso al océano,[107] además de los aportes de hierro oceánico procedentes de fuentes terrestres. El hierro llega a la atmósfera a través del vulcanismo,[108] el viento eólico[109] y, en algunos casos, por la combustión humana. En el Antropoceno, el hierro se extrae de las minas de la corteza y una parte se vuelve a depositar en depósitos de residuos.[103][106]


El hierro es un micronutriente esencial para casi todas las formas de vida. Es un componente clave de la hemoglobina, importante para la fijación del nitrógeno como parte de la familia de enzimas Nitrogenasa, y como parte del núcleo hierro-azufre de la ferredoxina facilita el transporte de electrones en cloroplastos, mitocondrias eucariotas y bacterias. Debido a la alta reactividad del Fe2+ con el oxígeno y a la baja solubilidad del Fe3+, el hierro es un nutriente limitante en la mayoría de las regiones del mundo.
Ciclos de calcio y sílice
[editar]
El ciclo del calcio es una transferencia de calcio entre las fases disuelta y sólida. Existe un suministro continuo de iones de calcio a los cursos de agua procedentes de rocas, organismos y suelos.[54][112] Los iones de calcio se consumen y se eliminan de los medios acuosos al reaccionar para formar estructuras insolubles como el carbonato cálcico y el silicato cálcico,[54][113] que pueden depositarse para formar sedimentos o los exoesqueletos de los organismos.[54] Los iones de calcio también pueden ser utilizados biológicamente, ya que el calcio es esencial para funciones biológicas como la producción de huesos y dientes o la función celular.[58][59] El ciclo del calcio es un hilo conductor entre los procesos terrestres, marinos, geológicos y biológicos.[114] El calcio se mueve a través de estos diferentes medios en sus ciclos por toda la Tierra. El ciclo del calcio marino se ve afectado por el cambio del dióxido de carbono atmosférico debido a la acidificación de los océanos.[57]
El carbonato cálcico biogénico se forma cuando los organismos marinos, como los cocolitóforos, los corales, los pterópodos y otros moluscos, transforman los iones de calcio y el bicarbonato en conchas y exoesqueletos de calcita o aragonito, ambas formas de carbonato cálcico.[57] Éste es el sumidero dominante del calcio disuelto en el océano.[114] Los organismos muertos se hunden en el fondo del océano, depositando capas de concha que con el tiempo se cementan para formar piedra caliza. Este es el origen de la caliza marina y terrestre.[57]
El calcio precipita en carbonato cálcico según la siguiente ecuación:
Ca2+ + 2HCO3− → CO2+ H2O + CaCO3[112]
La relación entre el calcio disuelto y el carbonato cálcico se ve muy afectada por los niveles de dióxido de carbono (CO2) en la atmósfera.
El aumento de dióxido de carbono produce más bicarbonato en el océano según la siguiente ecuación:
CO2 + CO32− + H2O → 2HCO3−[115]


Dada su estrecha relación con el ciclo del carbono y los efectos de los gases de efecto invernadero, se prevé que tanto el ciclo del calcio como el del carbono cambien en los próximos años.[118] El seguimiento de los isótopos del calcio permite predecir los cambios medioambientales, ya que muchas fuentes sugieren un aumento de las temperaturas tanto en la atmósfera como en el medio marino. Como consecuencia, esto alterará drásticamente la descomposición de las rocas, el pH de los océanos y los cursos de agua y, por tanto, la sedimentación del calcio, albergando toda una serie de implicaciones en el ciclo del calcio.
Debido a las complejas interacciones del calcio con muchas facetas de la vida, es poco probable que se conozcan los efectos de la alteración de las condiciones ambientales hasta que se produzcan. Sin embargo, se pueden hacer predicciones provisionales basadas en investigaciones contrastadas. El aumento de los niveles de dióxido de carbono y la disminución del pH de los océanos alterarán la solubilidad del calcio, lo que impedirá que los corales y los organismos con concha desarrollen sus exoesqueletos basados en el calcio, haciéndolos vulnerables o incapaces de sobrevivir.[119][120]
La mayor parte de la producción biológica de sílice biogénico en el océano está impulsada por las diatomeas, con contribuciones adicionales de los radiolarios. Estos microorganismos extraen ácido silícico disuelto de las aguas superficiales durante su crecimiento, y lo devuelven reciclándose por toda la columna de agua después de morir. Los aportes de silicio al océano desde arriba llegan a través de los ríos y el polvo eólico, mientras que los de abajo incluyen el reciclado de sedimentos del fondo marino, la meteorización y la actividad hidrotermal.[121]


Biomineralización
[editar]
«La actividad biológica es una fuerza dominante que moldea la estructura química y la evolución del medio ambiente de la superficie terrestre. La presencia de una atmósfera-hidrosfera oxigenada en torno a una tierra sólida altamente reductora es la consecuencia más sorprendente del surgimiento de la vida en la Tierra. A su vez, la evolución biológica y el funcionamiento de los ecosistemas están condicionados en gran medida por procesos geofísicos y geológicos. Comprender las interacciones entre los organismos y su entorno abiótico, y la consiguiente evolución acoplada de la biosfera y la geosfera, es un tema central de la investigación en biogeología. Los biogeoquímicos contribuyen a esta comprensión estudiando las transformaciones y el transporte de los sustratos químicos y los productos de la actividad biológica en el medio ambiente".[122]
«Desde la explosión del Cámbrico, las partes mineralizadas de los cuerpos han sido secretadas en grandes cantidades por la biota. Dado que el carbonato cálcico, el sílice y el fosfato cálcico son las principales fases minerales que constituyen estas partes duras, la biomineralización desempeña un papel importante en los ciclos biogeoquímicos globales del carbono, el calcio, el silicio y el fósforo".[122]
Ciclado profundo
[editar]
El ciclo profundo implica el intercambio de materiales con el manto. El ciclo profundo del agua implica el intercambio de agua con el manto, con el agua transportada hacia abajo por las placas oceánicas en subducción y que regresa a través de la actividad volcánica, distinto del proceso del ciclo del agua que ocurre por encima y en la superficie de la Tierra. Parte del agua llega hasta el manto inferior e incluso puede alcanzar el núcleo externo.
En la visión convencional del ciclo del agua (también conocido como ciclo hidrológico), el agua se mueve entre los depósitos de la atmósfera y la superficie terrestre o cerca de ella (incluidos el océano, los ríos y lagos, los glaciares y casquetes polares, la biosfera y las aguas subterráneas). Sin embargo, además del ciclo superficial, el agua también desempeña un papel importante en los procesos geológicos que llegan hasta la corteza y el manto. El contenido de agua en el magma determina el grado de explosividad de una erupción volcánica; el agua caliente es el principal conducto para que los minerales de importancia económica se concentren en depósitos minerales hidrotermales; y el agua desempeña un papel importante en la formación y migración del petróleo.[123] El petróleo es un combustible fósil derivado de antiguos materiales orgánicos fosilizados, como el zooplancton y las algas.[124][125]
El agua no sólo está presente como fase separada en el suelo. El agua de mar se filtra en la corteza oceánica e hidrata rocas ígneas como el olivino y el piroxeno, transformándolas en minerales hidrosolubles como serpentinas, talco y brucita.[126] En esta forma, el agua es transportada hacia el manto. En la parte superior del manto, el calor y la presión deshidratan estos minerales, liberando gran parte de ella a la cuña del manto suprayacente, lo que desencadena la fusión de rocas que se elevan para formar arcos volcánicos.[127] Sin embargo, algunos de los «minerales nominalmente anhidros» que son estables a mayor profundidad en el manto pueden almacenar pequeñas concentraciones de agua en forma de hidroxilo (OH-)[128] y, dado que ocupan grandes volúmenes de la Tierra, son capaces de almacenar al menos tanta como los océanos del mundo.[123]

La opinión convencional sobre el origen del océano es que se llenó por desgasificación del manto a principios del Arcaico y que el manto ha permanecido deshidratado desde entonces.[130] Sin embargo, la subducción transporta agua hacia abajo a un ritmo que vaciaría el océano en 1-2.000 millones de años. A pesar de ello, los cambios en el nivel global del mar en los últimos 3-4.000 millones de años sólo han sido de unos cientos de metros, mucho menores que la profundidad media de los océanos de 4 kilómetros. Por tanto, se espera que los flujos de entrada y salida de agua del manto estén aproximadamente equilibrados y que el contenido de agua del manto sea constante. El agua transportada al manto acaba volviendo a la superficie en erupciones en las dorsales oceánicas medias y los puntos calientes.[131] Las estimaciones de la cantidad de agua en el manto oscilan entre 1⁄4 y 4 veces el agua del océano.[131]
El ciclo del carbono profundo es el movimiento del carbono a través del manto y el núcleo de la Tierra. Forma parte del ciclo del carbono y está íntimamente relacionado con el movimiento del carbono en la superficie y la atmósfera de la Tierra. Al devolver el carbono a las profundidades de la Tierra, desempeña un papel fundamental en el mantenimiento de las condiciones terrestres necesarias para la existencia de la vida. Sin él, el carbono se acumularía en la atmósfera, alcanzando concentraciones extremadamente altas durante largos periodos de tiempo.[132]
Ciclo de la roca
[editar]
Combustibles fósiles
[editar]El fitoplancton y el zooplancton acuáticos que murieron y se sedimentaron en grandes cantidades en condiciones anóxicas hace millones de años empezaron a formar petróleo y gas natural como resultado de la descomposición anaeróbica (por el contrario, las plantas terrestres tendían a formar carbón y metano). Con el paso del tiempo geológico, esta materia orgánica, mezclada con lodo, quedó enterrada bajo otras capas pesadas de sedimentos inorgánicos. La elevada temperatura y presión resultantes provocaron la alteración química de la materia orgánica, primero en un material ceroso conocido como querógeno, que se encuentra en los esquistos bituminosos, y después, con más calor, en hidrocarburos líquidos y gaseosos en un proceso conocido como catagénesis. Tales organismos y sus combustibles fósiles resultantes suelen tener una antigüedad de millones de años, y a veces de más de 650 millones de años,[133] la energía liberada en la combustión sigue siendo de origen fotosintético.[134]
Otros ciclos
[editar]Como oligoelementos, micronutrientes, ciclos inducidos por el hombre para compuestos sintéticos como los bifenilos policlorados (PCB).
Referencias
[editar]- ↑ «OpenStax | Free Textbooks Online with No Catch». openstax.org (en inglés estadounidense). Consultado el 25 de febrero de 2025.
- ↑ Fisher, Matthew R. (2017). 3.2 Biogeochemical Cycles (en inglés). Consultado el 25 de febrero de 2025.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). «Chemistry of the Elements (2nd ed.)». Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ «Water, the Universal Solvent | U.S. Geological Survey». www.usgs.gov (en inglés). Consultado el 25 de febrero de 2025.
- ↑ Reece, Jane B. (2013). «Campbell Biology (10th ed.)». Pearson. ISBN 9780321775658.
- ↑ Reece, Jane B. (2013). «Campbell Biology (10th ed.)». Pearson. ISBN 9780321775658.
- ↑ Collins, J. C. (1991). The Matrix of Life: A View of Natural Molecules from the Perspective of Environmental Water (en inglés). Molecular Presentations. ISBN 978-0-9629719-0-7. Consultado el 25 de febrero de 2025.
- ↑ «http://www.enviroliteracy.org/subcategory.php/198.html». www.enviroliteracy.org. Archivado desde el original el 27 de abril de 2021. Consultado el 25 de febrero de 2025.
- ↑ «"Phosphorus Cycle"». The Environmental Literacy Council. 2016.
- ↑ «Nitrogen and the Hydrologic Cycle, AEX-463-96». web.archive.org. 1 de septiembre de 2006. Consultado el 25 de febrero de 2025.
- ↑ «EO Library: The Carbon Cycle». web.archive.org. 28 de septiembre de 2006. Consultado el 25 de febrero de 2025.
- ↑ a b US Department of Commerce, National Oceanic and Atmospheric Administration. «Why is the ocean salty?». oceanservice.noaa.gov (en inglés estadounidense). Consultado el 25 de febrero de 2025.
- ↑ «Salinity | Science Mission Directorate». science.nasa.gov (en inglés). Archivado desde el original el 28 de septiembre de 2023. Consultado el 25 de febrero de 2025.
- ↑ Sea Surface Temperature, Salinity and Density NASA Scientific Visualization Studio, 9 October 2009.
- ↑ Sundby, S. and Kristiansen, T. (2015) "The principles of buoyancy in marine fish eggs and their vertical distributions across the world oceans". PLOS ONE, 10(10): e0138821. doi 10.1371/journal.pone.0138821.
 Modified text was copied from this source, which is available under a Creative Commons Attribution 4.0 International License.
Modified text was copied from this source, which is available under a Creative Commons Attribution 4.0 International License. - ↑ Magazine, Smithsonian. «Living Bacteria Are Riding Earth's Air Currents». Smithsonian Magazine (en inglés). Consultado el 25 de febrero de 2025.
- ↑ Robbins, Jim (13 de abril de 2018). «Trillions Upon Trillions of Viruses Fall From the Sky Each Day». The New York Times (en inglés estadounidense). ISSN 0362-4331. Consultado el 25 de febrero de 2025.
- ↑ Reche, Isabel; D’Orta, Gaetano; Mladenov, Natalie; Winget, Danielle M.; Suttle, Curtis A. (2018-04). «Deposition rates of viruses and bacteria above the atmospheric boundary layer». The ISME Journal (en inglés) 12 (4). doi:10.1038/s41396-017-0042-4. Archivado desde el original el 16 de noviembre de 2023. Consultado el 25 de febrero de 2025.
- ↑ Levin, Zev; Cotton, William R., eds. Aerosol Pollution Impact on Precipitation. ISBN 978-1-4020-8689-2. doi:10.1007/978-1-4020-8690-8.
- ↑ Tercer Informe de Evaluación del IPCC: Cambio Climático 2001 (TAR)
- ↑ «AMS Glossary». web.archive.org. 11 de diciembre de 2008. Consultado el 25 de febrero de 2025.
- ↑ «Allenpress.com». amsglossary.allenpress.com. Archivado desde el original el 3 de septiembre de 2024. Consultado el 25 de febrero de 2025.
- ↑ Matthias Tomczak and J. Stuart Godfrey (2009). Regional Oceanography: an Introduction.. ISBN 81-7035-306-8.
- ↑ Earthguide (2007). «Lesson 6: Unraveling the Gulf Stream Puzzle - On a Warm Current Running North». University of California at San Diego.
- ↑ University, Open Open (17 de septiembre de 2001). Ocean Circulation (en inglés). Elsevier. ISBN 978-0-08-053794-8. Consultado el 25 de febrero de 2025.
- ↑ «Investigating the Ocean - Gulf Stream». www.science-house.org. Archivado desde el original el 21 de enero de 2013. Consultado el 25 de febrero de 2025.
- ↑ «Thermohaline Ocean Circulation». web.archive.org. 25 de marzo de 2009. Consultado el 25 de febrero de 2025.
- ↑ «Thermohaline circulation». web.archive.org. 23 de mayo de 2008. Consultado el 25 de febrero de 2025.
- ↑ US Department of Commerce, National Oceanic and Atmospheric Administration. «Thermohaline Circulation - Currents: NOAA's National Ocean Service Education». oceanservice.noaa.gov (en inglés estadounidense). Consultado el 25 de febrero de 2025.
- ↑ Pidwirny, M. (2006). «Chapter 8: Introduction to the Hydrosphere». Fundamentals of Physical Geography (2nd edición). 8(b) The Hydrologic Cycle – via PhysicalGeography.net.
- ↑ US Department of Commerce, National Oceanic and Atmospheric Administration. «The Global Conveyor Belt - Currents: NOAA's National Ocean Service Education». oceanservice.noaa.gov (en inglés estadounidense). Consultado el 25 de febrero de 2025.
- ↑ «8(b) The Hydrologic Cycle». www.physicalgeography.net. Consultado el 25 de febrero de 2025.
- ↑ Van Der Ent, R.J. and Tuinenburg, O.A. (2017). «"The residence time of water in the atmosphere revisited".». Hydrology and Earth System Sciences. doi:10.5194/hess-21-779-2017.
- ↑ a b Schlesinger, William H.; Bernhardt, Emily S. (2013). Biogeochemistry: an analysis of global change (3rd edición). Waltham, MA: Academic Press. ISBN 9780123858740. OCLC 827935936.
- ↑ a b Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K. et al. (13 de octubre de 2000). «The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System». Science (en inglés) 290 (5490): 291-296. Bibcode:2000Sci...290..291F. ISSN 0036-8075. PMID 11030643. doi:10.1126/science.290.5490.291.
- ↑ a b Knoll, Andrew H; Canfield, Donald E; Konhauser, Kurt (2012). «7». Fundamentals of geobiology. Chichester, West Sussex: John Wiley & Sons. pp. 93-104. ISBN 978-1-118-28087-4. OCLC 793103985.
- ↑ a b «The Global Oxygen Cycle». Treatise on Geochemistry. Elsevier. 2014. pp. 437-473. ISBN 978-0-08-098300-4. doi:10.1016/b978-0-08-095975-7.00811-1. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Abundances of the elements in the solar system». Space Science Reviews (en inglés) 15 (1): 121. 1973. Bibcode:1973SSRv...15..121C. ISSN 0038-6308. S2CID 120201972. doi:10.1007/BF00172440. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Steven B. Carroll; Steven D. Salt (2004). Ecology for gardeners. Timber Press. p. 93. ISBN 978-0-88192-611-8. Archivado desde el original el 1 de febrero de 2018. Consultado el 23 de octubre de 2016.
- ↑ Kuypers, MMM; Marchant, HK; Kartal, B (2011). «The Microbial Nitrogen-Cycling Network». Nature Reviews Microbiology 1 (1): 1-14. PMID 29398704. S2CID 3948918. doi:10.1038/nrmicro.2018.9. hdl:21.11116/0000-0003-B828-1.
- ↑ Galloway, J. N. (2004). «Nitrogen cycles: past, present, and future generations». Biogeochemistry 70 (2): 153-226. S2CID 98109580. doi:10.1007/s10533-004-0370-0.
- ↑ Reis, Stefan; Bekunda, Mateete; Howard, Clare M; Karanja, Nancy; Winiwarter, Wilfried; Yan, Xiaoyuan; Bleeker, Albert; Sutton, Mark A (1 de diciembre de 2016). «Synthesis and review: Tackling the nitrogen management challenge: from global to local scales». Environmental Research Letters 11 (12): 120205. Bibcode:2016ERL....11l0205R. ISSN 1748-9326. doi:10.1088/1748-9326/11/12/120205.
- ↑ Gu, Baojing; Ge, Ying; Ren, Yuan; Xu, Bin; Luo, Weidong; Jiang, Hong; Gu, Binhe; Chang, Jie (17 de agosto de 2012). «Atmospheric Reactive Nitrogen in China: Sources, Recent Trends, and Damage Costs». Environmental Science & Technology 46 (17): 9420-9427. Bibcode:2012EnST...46.9420G. ISSN 0013-936X. PMID 22852755. doi:10.1021/es301446g.
- ↑ Kim, Haryun; Lee, Kitack; Lim, Dhong-Il; Nam, Seung-Il; Kim, Tae-Wook; Yang, Jin-Yu T.; Ko, Young Ho; Shin, Kyung-Hoon et al. (11 de mayo de 2017). «Widespread Anthropogenic Nitrogen in Northwestern Pacific Ocean Sediment». Environmental Science & Technology 51 (11): 6044-6052. Bibcode:2017EnST...51.6044K. ISSN 0013-936X. PMID 28462990. doi:10.1021/acs.est.6b05316.
- ↑ Biogeochemistry: An analysis of global change. 1991. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Brock Biology of Microorganisms (11th edición). Pearson. 2006. p. 136. ISBN 978-0-13-196893-6. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Sulfur transport and sulphur isotope fractionations in ocean floor hydrothermal systems». Mineralogical Magazine. 58A (1): 88-89. 1994. Bibcode:1994MinM...58...88B. doi:10.1180/minmag.1994.58A.1.49. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Abundance of chemical elements in the continental crust: a new table». Geochimica et Cosmochimica Acta 28 (8): 1273-1285. 1964. Bibcode:1964GeCoA..28.1273T. doi:10.1016/0016-7037(64)90129-2. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ a b «The integral role of iron in ocean biogeochemistry». Nature 543 (7643): 51-59. March 2017. Bibcode:2017Natur.543...51T. PMID 28252066. S2CID 2897283. doi:10.1038/nature21058.
- ↑ a b «Iron deficiency limits phytoplankton growth in the north-east Pacific subarctic». Nature 331 (6154): 341-343. 1988. Bibcode:1988Natur.331..341M. S2CID 4325562. doi:10.1038/331341a0.
- ↑ «The interplay of microbially mediated and abiotic reactions in the biogeochemical Fe cycle». Nature Reviews. Microbiology 12 (12): 797-808. December 2014. PMID 25329406. S2CID 24058676. doi:10.1038/nrmicro3347. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ «Ecosystem functioning from a geomicrobiological perspective – a conceptual framework for biogeochemical iron cycling». Environmental Chemistry 7 (5): 399. 2010. doi:10.1071/EN10040. Parámetro desconocido
|vauthors=ignorado (ayuda) - ↑ Kappler, Andreas; Straub, Kristina L. (2005-01-01). "Geomicrobiological Cycling of Iron". Reviews in Mineralogy and Geochemistry. 59 (1): 85–108. doi:10.2138/rmg.2005.59.5. ISSN 1529-6466.
- ↑ a b c d e Walker, James C. G.; Hays, P. B.; Kasting, J. F. (1981). «A negative feedback mechanism for the long-term stabilization of Earth's surface temperature». Journal of Geophysical Research 86 (C10): 9776. Bibcode:1981JGR....86.9776W. ISSN 0148-0227. doi:10.1029/jc086ic10p09776.
- ↑ Berner, R. A. (1 de mayo de 2004). «A model for calcium, magnesium and sulfate in seawater over Phanerozoic time». American Journal of Science 304 (5): 438-453. Bibcode:2004AmJS..304..438B. ISSN 0002-9599. doi:10.2475/ajs.304.5.438.
- ↑ Ridgwell, Andy; Zeebe, Richard E. (15 de junio de 2005). «The role of the global carbonate cycle in the regulation and evolution of the Earth system». Earth and Planetary Science Letters 234 (3–4): 299-315. ISSN 0012-821X. doi:10.1016/j.epsl.2005.03.006.
- ↑ a b c d e Raisman, Scott; Murphy, Daniel T. (2013). Ocean acidification: Elements and Considerations. Hauppauge, New York: Nova Science Publishers, Inc. ISBN 9781629482958.
- ↑ a b Nordin, B. E. C (1988). Calcium in Human Biology. ILSI Human Nutrition Reviews (en inglés). London: Springer London. ISBN 9781447114376. OCLC 853268074. S2CID 9765195. doi:10.1007/978-1-4471-1437-6.
- ↑ a b Rubin, Ronald P.; Weiss, George B.; Putney, James W. Jr (11 de noviembre de 2013). Calcium in Biological Systems (en inglés). Springer Science & Business Media. ISBN 9781461323778.
- ↑ Fantle, Matthew S.; Tipper, Edward T. (2014). «Calcium isotopes in the global biogeochemical Ca cycle: Implications for development of a Ca isotope proxy». Earth-Science Reviews 131: 148-177. ISSN 0012-8252. doi:10.1016/j.earscirev.2014.02.002 – via Elsevier ScienceDirect.
- ↑ Hunt, J. W.; Dean, A. P.; Webster, R. E.; Johnson, G. N.; Ennos, A. R. (2008). «A Novel Mechanism by which Silica Defends Grasses Against Herbivory». Annals of Botany 102 (4): 653-656. ISSN 1095-8290. PMC 2701777. PMID 18697757. doi:10.1093/aob/mcn130.
- ↑ Conley, Daniel J. (December 2002). «Terrestrial ecosystems and the global biogeochemical silica cycle». Global Biogeochemical Cycles 16 (4): 68-1-68-8. Bibcode:2002GBioC..16.1121C. ISSN 0886-6236. S2CID 128672790. doi:10.1029/2002gb001894.
- ↑ Defant, Marc J.; Drummond, Mark S. (October 1990). «Derivation of some modern arc magmas by melting of young subducted lithosphere». Nature 347 (6294): 662-665. Bibcode:1990Natur.347..662D. ISSN 0028-0836. S2CID 4267494. doi:10.1038/347662a0.
- ↑ a b c d e Bianchi, Thomas S. (2007). Biogeochemistry of Estuaries (en inglés). Oxford University Press, USA. ISBN 978-0-19-516082-6. Consultado el 26 de febrero de 2025.
- ↑ Sarmiento, J.L.; Toggweiler, J.R. (1984). «"A new model for the role of the oceans in determining atmospheric P CO 2"». Nature. doi:10.1038/308621a0.
- ↑ a b c Middelburg, J.J. (2019). «Marine carbon biogeochemistry: a primer for earth system scientists, page 5». Springer Nature. ISBN 9783030108229. doi:10.1007/978-3-030-10822-9.
- ↑ Sarmiento, Jorge L.; Gruber, Nicolas (1 de agosto de 2002). «Sinks for Anthropogenic Carbon». Physics Today 55 (8): 30-36. ISSN 0031-9228. doi:10.1063/1.1510279. Consultado el 26 de febrero de 2025.
- ↑ Chhabra, Abha (2013). «"Carbon and Other Biogeochemical Cycles"». En Stocker, T.F.; Qin, D.; Plattner, G.-K.; Tignor, M.; Allen, S.K.; Boschung, J.; Nauels, A.; Xia, Y.; Bex, V.; Midgley, P.M. (eds.). CLIMATE CHANGE 2013 The Physical Science Basis, WORKING GROUP I CONTRIBUTION TO THE FIFTH ASSESSMENT REPORT OF THE INTERGOVERNMENTAL PANEL ON CLIMATE CHANGE (1st ed.). Cambridge University Press. doi:10.13140/2.1.1081.8883.
- ↑ Kandasamy, Selvaraj; Nagender Nath, Bejugam (2016). «"Perspectives on the Terrestrial Organic Matter Transport and Burial along the Land-Deep Sea Continuum: Caveats in Our Understanding of Biogeochemical Processes and Future Needs"». Frontiers in Marine Science. 3. doi:10.3389/fmars.2016.00259.
- ↑ Hansell DA and Craig AC (2015). «"Marine Dissolved Organic Matter and the Carbon Cycle"». Oceanography. doi:10.5670/oceanog.2001.05.
- ↑ Pagano, T., Bida, M. and Kenny, J.E. (2014). «"Trends in levels of allochthonous dissolved organic carbon in natural water: a review of potential mechanisms under a changing climate"». Water. doi:10.3390/w6102862.
- ↑ Monroy, P., Hernández-García, E., Rossi, V. and López, C. (2017). «"Modeling the dynamical sinking of biogenic particles in oceanic flow".». Nonlinear Processes in Geophysics. doi:10.5194/npg-24-293-2017.
- ↑ Simon, M., Grossart, H., Schweitzer, B. and Ploug, H. (2002). «"Microbial ecology of organic aggregates in aquatic ecosystems"». Aquatic microbial ecology. doi:10.3354/ame028175.
- ↑ Cavan, E.L., Belcher, A., Atkinson, A., Hill, S.L., Kawaguchi, S., McCormack, S., Meyer, B., Nicol, S., Ratnarajah, L., Schmidt, K. and Steinberg, D.K. (2019). «"The importance of Antarctic krill in biogeochemical cycles".». Nature communications. doi:10.1038/s41467-019-12668-7.
- ↑ Sigman DM, Haug GH (2006). «"The biological pump in the past"». Treatise on Geochemistry. Vol. 6. Pergamon Press.
- ↑ Hain MP, Sigman DM, Haug GH (2014). «The Biological Pump in the Past"». Treatise on Geochemistry. ISBN 9780080983004. doi:10.1016/B978-0-08-095975-7.00618-5.
- ↑ De La Rocha CL. (2006). «The Biological Pump». Treatise on Geochemistry; vol. 6, (ed.). Pergamon Press.
- ↑ Heinrichs, M.E., Mori, C. and Dlugosch, L. (2020). «"Complex Interactions Between Aquatic Organisms and Their Chemical Environment Elucidated from Different Perspectives"». YOUMARES 9-The Oceans: Our Research, Our Future , pages 279–297. Springer. doi:10.1007/978-3-030-20389-4_15.
- ↑ Prentice, I.C. (2001). «"The carbon cycle and atmospheric carbon dioxide"». Climate change 2001: the scientific basis: contribution of Working Group I to the Third Assessment Report of the Intergouvernmental Panel on Climate Change / Houghton, J.T. [edit.]
- ↑ Biogeochemical Cycles CK-12 Biology. Accessed: 2 June 2020.
- ↑ Moulton, Orissa M; Altabet, Mark A; Beman, J Michael; Deegan, Linda A; Lloret, Javier; Lyons, Meaghan K; Nelson, James A; Pfister, Catherine A (2016). «"Microbial associations with macrobiota in coastal ecosystems: patterns and implications for nitrogen cycling"». Frontiers in Ecology and the Environment. ISSN 1540-9295. doi:10.1002/fee.1262.
- ↑ a b Miller, Charles (2008). «Biological oceanography». Malden, MA: Blackwell Publishing. ISBN 978-0-632-05536-4.
- ↑ a b Gruber, Nicolas (2008). «Nitrogen in the Marine Environment.». Burlington, MA: Elsevier. ISBN 978-0-12-372522-6.
- ↑ «Learning Unit: Nitrogen Cycle - Marine Environment - ChemgaPedia». web.archive.org. 15 de abril de 2012. Consultado el 27 de febrero de 2025.
- ↑ «Eutrophication | Soil Science Society of America». web.archive.org. 16 de abril de 2014. Consultado el 27 de febrero de 2025.
- ↑ Peltzer DA, Wardle DA, Allison VJ, Baisden WT, Bardgett RD, Chadwick OA, et al. (2010). «"Understanding ecosystem retrogression"». Ecological Monographs. doi:10.1890/09-1552.1.
- ↑ Robert Bear, David Rintoul. Principles of Biology (en inglés). OpenStax CNX. Consultado el 27 de febrero de 2025.
- ↑ Levin, Simon A.; Carpenter, Stephen R.; Godfray, H. Charles J.; Kinzig, Ann P.; Loreau, Michel; Losos, Jonathan B.; Walker, Brian; Wilcove, David S. (27 de julio de 2009). The Princeton Guide to Ecology (en inglés). Princeton University Press. ISBN 978-1-4008-3302-3. Consultado el 27 de febrero de 2025.
- ↑ a b Bormann, F. H.; Likens, G. E. (1967). «"Nutrient cycling"». Science. PMID 17737551. doi:10.1126/science.155.3761.424.
- ↑ a b c «Dissolved Nutrients | EARTH 103: Earth in the Future». www.e-education.psu.edu. Consultado el 27 de febrero de 2025.
- ↑ Jørgensen, B.B., Findlay, A.J. and Pellerin, A. (2019). «"The biogeochemical sulfur cycle of marine sediments".». Frontiers in microbiology. doi:10.3389/fmicb.2019.00849.
- ↑ Brimblecombe, Peter (2014). «"The global sulfur cycle"». Treatise on Geochemistry. Vol. 10. Amsterdam: Elsevier. ISBN 9780080983004. doi:10.1016/B978-0-08-095975-7.00814-7.
- ↑ a b c Fike DA, Bradley AS, Rose CV (2015). «"Rethinking the Ancient Sulfur Cycle"». Annual Review of Earth and Planetary Sciences. doi:10.1146/annurev-earth-060313-054802.
- ↑ Canfield DE (2004). «"The evolution of the Earth surface sulfur reservoir"». American Journal of Science. doi:10.2475/ajs.304.10.839.
- ↑ Kah LC, Lyons TW, Frank TD (2004). «"Low marine sulphate and protracted oxygenation of the Proterozoic biosphere"». Nature. PMID 15483609. doi:10.1038/nature02974.
- ↑ a b Sievert SM, Hügler M, Taylor CD, Wirsen CO (2008). «"Sulfur Oxidation at Deep-Sea Hydrothermal Vents"». Dahl C, Friedrich CG (eds.). Microbial Sulfur Metabolism. Springer Berlin Heidelberg. ISBN 978-3-540-72679-1. doi:10.1007/978-3-540-72682-1_19.
- ↑ Jiang, L., Lyu, J. and Shao, Z. (2017). «"Sulfur metabolism of Hydrogenovibrio thermophilus strain s5 and its adaptations to deep-sea hydrothermal vent environment".». Frontiers in microbiology. doi:10.3389/fmicb.2017.02513.
- ↑ Klotz, Martin G.; Bryant, Donald A.; Hanson, Thomas E. (2011). «The Microbial Sulfur Cycle». Frontiers in Microbiology (en inglés) 2. ISSN 1664-302X. doi:10.3389/fmicb.2011.00241. Archivado desde el original el 4 de junio de 2023. Consultado el 27 de febrero de 2025.
- ↑ Pedersen RB, Rapp HT, Thorseth IH, Lilley MD, Barriga FJ, Baumberger T, et al. (2010). «"Discovery of a black smoker vent field and vent fauna at the Arctic Mid-Ocean Ridge"». Nature Communications. PMID 21119639. doi:10.1038/ncomms1124.
- ↑ a b Nickelsen, L.; Keller, D. P.; Oschlies, A. (12 de mayo de 2015). «A dynamic marine iron cycle module coupled to the University of Victoria Earth System Model: the Kiel Marine Biogeochemical Model 2 for UVic 2.9». Geoscientific Model Development (en english) 8 (5): 1357-1381. ISSN 1991-959X. doi:10.5194/gmd-8-1357-2015. Consultado el 27 de febrero de 2025.
- ↑ Jickells TD, An ZS, Andersen KK, Baker AR, Bergametti G, Brooks N, et al. (2005). «"Global iron connections between desert dust, ocean biogeochemistry, and climate".». Science. PMID 15802595. doi:10.1126/science.1105959.
- ↑ Raiswell R, Canfield DE (2012). «"The iron biogeochemical cycle past and present"». Geochemical Perspectives. doi:10.7185/geochempersp.1.1.
- ↑ a b Wang T, Müller DB, Graedel TE (2007). «"Forging the Anthropogenic Iron Cycle".». Environmental Science & Technology. PMID 17711233. doi:10.1021/es062761t.
- ↑ Taylor SR (1964). «"Abundance of chemical elements in the continental crust: a new table".». Geochimica et Cosmochimica Acta. doi:10.1016/0016-7037(64)90129-2.
- ↑ Völker C, Tagliabue A (2015). «"Modeling organic iron-binding ligands in a three-dimensional biogeochemical ocean model"». Marine Chemistry. doi:10.1016/j.marchem.2014.11.008.
- ↑ a b Matsui, Hitoshi; Mahowald, Natalie M.; Moteki, Nobuhiro; Hamilton, Douglas S.; Ohata, Sho; Yoshida, Atsushi; Koike, Makoto; Scanza, Rachel A. et al. (2018). «Anthropogenic combustion iron as a complex climate forcer». Nature Communications (en inglés) 9. doi:10.1038/s41467-018-03997-0. Archivado desde el original el 4 de noviembre de 2023. Consultado el 27 de febrero de 2025.
- ↑ Emerson, David (6 de enero de 2016). «The Irony of Iron – Biogenic Iron Oxides as an Iron Source to the Ocean». Frontiers in Microbiology (en inglés) 6. ISSN 1664-302X. doi:10.3389/fmicb.2015.01502. Archivado desde el original el 16 de diciembre de 2023. Consultado el 27 de febrero de 2025.
- ↑ Olgun N, Duggen S, Croot PL, Delmelle P, Dietze H, Schacht U, et al. (2011). «"Surface ocean iron fertilization: The role of airborne volcanic ash from subduction zone and hot spot volcanoes and related iron fluxes into the Pacific Ocean"». Global Biogeochemical Cycles. doi:10.1029/2009GB003761.
- ↑ Gao, Y.; Kaufman, Y. J.; Tanré, D.; Kolber, D.; Falkowski, P. G. (2001). «Seasonal distributions of aeolian iron fluxes to the global ocean». Geophysical Research Letters (en inglés) 28 (1): 29-32. ISSN 1944-8007. doi:10.1029/2000GL011926. Consultado el 27 de febrero de 2025.
- ↑ Basu, Subhajit; Gledhill, Martha; Beer, Dirk de; S. G. Prabhu Matondkar; Shaked, Yeala (2019). «Colonies of marine cyanobacteria Trichodesmium interact with associated bacteria to acquire iron from dust». Communications Biology (en inglés) 2. doi:10.1038/s42003-019-0534-z. Archivado desde el original el 10 de julio de 2024. Consultado el 27 de febrero de 2025.
- ↑ Ratnarajah, Lavenia; Nicol, Steve; Bowie, Andrew R. (29 de marzo de 2018). «Pelagic Iron Recycling in the Southern Ocean: Exploring the Contribution of Marine Animals». Frontiers in Marine Science (en english) 5. ISSN 2296-7745. doi:10.3389/fmars.2018.00109. Consultado el 27 de febrero de 2025.
- ↑ a b Berner, Robert A. (1 de mayo de 2004). «A model for calcium, magnesium and sulfate in seawater over Phanerozoic time». American Journal of Science (en inglés) 304 (5): 438-453. doi:10.2475/ajs.304.5.438. Consultado el 27 de febrero de 2025.
- ↑ Ridgwell, Andy; Zeebe, Richard E. (2005). «"The role of the global carbonate cycle in the regulation and evolution of the Earth system"». Earth and Planetary Science Letters. ISSN 0012-821X. doi:10.1016/j.epsl.2005.03.006.
- ↑ a b Fantle, Matthew S.; Tipper, Edward T. (1 de febrero de 2014). «Calcium isotopes in the global biogeochemical Ca cycle: Implications for development of a Ca isotope proxy». Earth-Science Reviews 129: 148-177. ISSN 0012-8252. doi:10.1016/j.earscirev.2013.10.004. Consultado el 27 de febrero de 2025.
- ↑ Raisman, Scott; Murphy, Daniel T. (2013). «Ocean Acidification : Elements and Considerations.». Hauppauge, New York: Nova Science Publishers, Inc. ISBN 9781629482958.
- ↑ Winck, Flavia Vischi; Páez Melo, David Orlando; González Barrios, Andrés Fernando (2013). «"Carbon acquisition and accumulation in microalgae Chlamydomonas: Insights from "omics" approaches"». Journal of Proteomics. PMID 24120529. doi:10.1016/j.jprot.2013.09.016.
- ↑ Zhang, Junzhi; Li, Luwei; Qiu, Lijia; Wang, Xiaoting; Meng, Xuanyi; You, Yu; Yu, Jianwei; Ma, Wenlin (2017-11). «Effects of Climate Change on 2-Methylisoborneol Production in Two Cyanobacterial Species». Water (en inglés) 9 (11): 859. ISSN 2073-4441. doi:10.3390/w9110859. Consultado el 27 de febrero de 2025.
- ↑ Komar, N.; Zeebe, R. E. (2016). «Calcium and calcium isotope changes during carbon cycle perturbations at the end-Permian». Paleoceanography (en inglés) 31 (1): 115-130. ISSN 1944-9186. doi:10.1002/2015PA002834. Consultado el 27 de febrero de 2025.
- ↑ «"PMEL CO2 - Carbon Dioxide Program"». www.pmel.noaa.gov. 2018.
- ↑ «Ocean Acidification | Smithsonian Ocean». ocean.si.edu (en inglés). 30 de abril de 2018. Consultado el 27 de febrero de 2025.
- ↑ Treguer, P.; Nelson, D. M.; Van Bennekom, A. J.; Demaster, D. J.; Leynaert, A.; Queguiner, B. (1995). «"The Silica Balance in the World Ocean: A Reestimate"». Science. PMID 17746543. doi:10.1126/science.268.5209.375.
- ↑ a b Van Cappellen, P. (2003). «"Biomineralization and global biogeochemical cycles"». Reviews in mineralogy and geochemistry. doi:10.2113/0540357.
- ↑ a b Bodnar, R.J.; Azbej, T.; Becker, S.P.; Cannatelli, C.; Fall, A.; Severs, M.J. (2013). «"Whole Earth geohydrologic cycle, from the clouds to the core: The distribution of water in the dynamic Earth system"». M.E., Bickford (ed.). The Web of Geological Sciences: Advances, Impacts, and Interactions: Geological Society of America Special Paper 500. The Geological Society of America. ISBN 9780813725000. doi:10.1130/2013.2500(13).
- ↑ Kvenvolden, Keith A. (1 de enero de 2006). Organic geochemistry – A retrospective of its first 70 years. doi:10.1016/j.orggeochem.2005.09.001. Consultado el 28 de febrero de 2025.
- ↑ Schobert, Harold H. (2013). «Chemistry of fossil fuels and biofuels.». Cambridge: Cambridge University Press. ISBN 978-0-521-11400-4.
- ↑ Peacock, Simon M.; Hyndman, Roy D. (1999). «Hydrous minerals in the mantle wedge and the maximum depth of subduction thrust earthquakes». Geophysical Research Letters (en inglés) 26 (16): 2517-2520. ISSN 1944-8007. doi:10.1029/1999GL900558. Consultado el 28 de febrero de 2025.
- ↑ Rüpke, L; Morgan, Jason Phipps; Hort, Matthias; Connolly, James A. D. (2004). «"Serpentine and the subduction zone water cycle"». Earth and Planetary Science Letters. doi:10.1016/j.epsl.2004.04.018.
- ↑ Bell, D. R.; Rossman, G. R. (1992). «"Water in Earth's Mantle: The Role of Nominally Anhydrous Minerals"». Science. PMID 17801227. doi:10.1126/science.255.5050.1391.
- ↑ Dasgupta, Rajdeep (2011). «The Influence of Magma Ocean Processes on the Present-day Inventory of Deep Earth Carbon». Post-AGU 2011 CIDER Workshop.
- ↑ Keppler, Hans (2013). «"Volatiles under high pressure"». Karato, Shun-ichiro; Karato, Shun'ichirō (eds.). Physics and chemistry of the deep Earth. John Wiley & Sons. ISBN 9780470659144. doi:10.1002/9781118529492.ch1.
- ↑ a b Hirschmann, Marc M. (2006). «"Water, melting, and the deep Earth H2O cycle"». Annual Review of Earth and Planetary Sciences. doi:10.1146/annurev.earth.34.031405.125211.
- ↑ «The Deep Carbon Cycle and our Habitable Planet | Deep Carbon Observatory». web.archive.org. 27 de julio de 2020. Consultado el 28 de febrero de 2025.
- ↑ Paul Mann, Lisa Gahagan, and Mark B. Gordon (2009). «"Tectonic setting of the world's giant oil and gas fields"». Michel T. Halbouty (ed.) Giant Oil and Gas Fields of the Decade, 1990–1999, Tulsa, Okla.: American Association of Petroleum Geologists,.
- ↑ "thermochemistry of fossil fuel formation".
Referencias adicionales
[editar]- James, Rachael y Open University (2005) Marine Biogeochemical Cycles Butterworth-Heinemann. ISBN 9780750667937.


 French
French Deutsch
Deutsch![Salinidad media anual de la superficie del mar, medida en 2009 en unidades prácticas de salinidad[14]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/61/SeaSurfaceSalinity.jpg/624px-SeaSurfaceSalinity.jpg)
![Diferencias verticales de la salinidad del mar entre la superficie y una profundidad de 300 metros. La salinidad aumenta con la profundidad en las regiones rojas y disminuye en las azules.[15]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/7f/Vertical_differences_in_ocean_salinity_%280_to_300m%29.png/540px-Vertical_differences_in_ocean_salinity_%280_to_300m%29.png)