Malaria , la enciclopedia libre
| Malaria | ||
|---|---|---|
 Trofozoítos (formas anulares) y gametocitos de Plasmodium falciparum en sangre humana. | ||
| Especialidad | infectología medicina tropical parasitología | |
| Síntomas | Fiebre, vómitos, dolor de cabeza, piel amarilla (ictericia) | |
| Sinónimos | ||
| ||
La malaria (del italiano medieval mal - malo- y aria - aire-) o paludismo (del latín paludis, genitivo del nombre palus, ‘ciénaga, pantano’ y de -ismo, en este caso acción o proceso patológico) es una enfermedad infecciosa producida por parásitos del género Plasmodium, y transmitida por las hembras de varias especies de mosquitos Anopheles.
Algunos estudios científicos sugieren que pudo haberse transmitido al ser humano a través de los gorilas occidentales.[1] Es la primera enfermedad de importancia entre las enfermedades debilitantes. Más de 400 000 personas mueren al año por causa de la malaria, de los cuales unos 240 000 son niños.[2]
En mayo de 2007, la Asamblea Mundial de la Salud decidió conmemorar el 25 de abril el Día Mundial del Paludismo.[3]
La enfermedad puede ser causada por una o por varias de las diferentes especies de Plasmodium. Hay más de 120 especies de Plasmodium que infectan a mamíferos, aves y reptiles, pero sólo ocho infectan regularmente al ser humano:[4] Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae, Plasmodium ovale (P. o. curtisi y P. o. wallikeri) o Plasmodium knowlesi, las tres primeras han sido notificadas en el continente americano. Los vectores de esta enfermedad son diversas especies de mosquitos del género Anopheles. Solo las hembras de los mosquitos se alimentan de sangre para poder madurar los huevos; los machos no pican y no pueden transmitir enfermedades, ya que únicamente se alimentan de néctares y jugos vegetales.
La gran mayoría de casos de malaria ocurren por transmisión vectorial (a través de la picadura del mosquito); sin embargo, hay otras formas de contagio entre humanos: 1) transmisión vertical (enfermedad congénita del feto), en la que una mujer embarazada lo transmita por vía placentaria al feto, 2) por transfusiones sanguíneas, de donantes de riesgo (en regiones de endemicidad de la malaria) o que han padecido la enfermedad a las cuales no se le practica una serología en el banco de sangre (detección de antígenos o tamización de anticuerpos para malaria[5]), 3) por trasplante de órganos sin serología, 4) por uso compartido de agujas en drogodependientes endovenosos.
En regiones donde la malaria es altamente endémica, las personas se infectan tan a menudo que desarrollan la inmunidad adquirida que ofrece protección parcial, es decir, son portadores más o menos asintomáticos del parásito.
Alrededor del 40 % de la población mundial vive en zonas afectadas por malaria, principalmente en los países más pobres. Los mosquiteros tratados con insecticida (MTI) previenen esta enfermedad de manera efectiva.[2] Sin embargo, se han identificado ciertos obstáculos en cuanto al aumento de su uso.[cita requerida]
Una revisión sistemática de diez estudios, nueve realizados en África y uno en la India, concluyó que la entrega gratuita de MTI aumenta ligeramente el número de propietarios, comparado con su provisión a precio de mercado o subvencionado. Asimismo, educar sobre el uso adecuado de MTI aumenta el número de personas que duermen bajo un mosquitero, comparado con un grupo de control que no recibió dicha educación. No se midieron efectos secundarios adversos. Por último, existe evidencia de una mejoría de la morbilidad por malaria como resultado del aumento de tenencia y uso de MTI, aunque estos hallazgos siguen siendo inciertos.[6] Sin embargo, otros estudios no confirmaron estos hallazgos.[7]
Historia
[editar]La malaria ha infectado a los humanos durante más de 50 000 años, y puede que haya sido un patógeno humano durante la historia entera de nuestra especie,[8] hipótesis que también se apoya en la observación de especies cercanas a los parásitos humanos de la malaria en los chimpancés, pariente ancestral de los humanos.[9] Además, se encuentran referencias de las peculiares fiebres periódicas de la malaria a lo largo de la historia, comenzando desde 2700 a. C. en China.[10]
La malaria era endémica en África hasta que fue distribuida al continente americano con el tráfico trasatlántico de esclavos africanos comenzando en el siglo 15. Algunos de los esclavos africanos, muchos de los cuales tenían mayor inmunidad, tenían enfermedades como la malaria y la fiebre amarilla y provocaron pandemias entre las naciones indígenas de las Américas e incluso en los colonos europeos.[11]
Los estudios científicos sobre la malaria hicieron su primer avance de importancia en 1880, cuando el médico militar francés Charles Louis Alphonse Laveran, quien trabajaba en Argelia, observó parásitos dentro de los glóbulos rojos de personas con malaria. Propuso por ello que la malaria la causaba un protozoario, la primera vez que se identificó a un protozoario como causante de una enfermedad.[12] Por este y otros descubrimientos subsecuentes, se le concedió el Premio Nobel en Fisiología o Medicina en 1907. Al protozoario en cuestión se le llamó Plasmodium, por los científicos italianos Ettore Marchiafava y Angelo Celli.[13] Al año siguiente Carlos Finlay, un médico hispano-cubano que trataba pacientes con fiebre amarilla en La Habana, sugirió que eran los mosquitos quienes transmitían la enfermedad de un humano a otro. Posteriormente, fue el británico Sir Ronald Ross, durante sus trabajos en la India, quien finalmente demostró, en 1898, que la malaria era transmitida por los mosquitos. Lo probó al mostrar que ciertas especies del mosquito transmitían la malaria a pájaros, al conseguir aislar los parásitos de las glándulas salivales de mosquitos que se alimentaban de aves infectadas.[14] Por su aporte investigador, Ross recibió el premio Nobel de Medicina en 1902. Después de renunciar al Servicio Médico de la India, Ross trabajó en la recién fundada Liverpool School of Tropical Medicine y dirigió los esfuerzos por controlar la malaria en Egipto, Panamá, Grecia y Mauricio.[15] Los hallazgos de Finlay y Ross fueron confirmados luego por un comité médico dirigido por Walter Reed en 1900, y sus recomendaciones implementadas por William C. Gorgas en medidas de salud adoptadas durante la construcción del Canal de Panamá. Este trabajo salvó la vida de miles de trabajadores y ayudó a desarrollar los métodos usados en campañas de salud pública contra la malaria.
El primer tratamiento eficaz para la malaria fue la corteza del árbol Cinchona o quino, que contiene el alcaloide quinina. Este árbol crece en las colinas de los Andes, en particular en Perú. Los habitantes del Perú usaban el producto natural para controlar la malaria, y los Jesuitas introdujeron esta práctica en Europa durante los años 1640, donde fue aceptada con rapidez.[16] Sin embargo, no fue sino hasta 1820 cuando la quinina, el ingrediente activo, fue extraída de la corteza y nombrada por los químicos franceses Pierre Joseph Pelletier y Joseph Bienaimé Caventou.[17]

A comienzos del siglo XX, antes de los antibióticos, los pacientes con sífilis eran intencionalmente infectados con malaria para crear una fiebre, siguiendo las investigaciones de Julius Wagner-Jauregg. Al controlar la fiebre con quinina, los efectos tanto de la sífilis como la malaria podían ser minimizados. Algunos de los pacientes murieron por la malaria, pero el riesgo era preferible por encima de la casi segura muerte por sífilis.[18]
A pesar de que se estableció en el siglo XIX y a comienzos del siglo XX la presencia del estadio sanguíneo en el humano y la contraparte del ciclo de vida de la malaria en el mosquito, solo en 1980 se observó la forma latente hepática del parásito, conocida como hipnozoito, en las especies P. vivax y P. ovale. Este descubrimiento explicó finalmente por qué daba la impresión de que algunas personas se curaban de la enfermedad, para recaer años después de que el parásito hubiese desaparecido de su circulación sanguínea.[19][20]
Durante la II Guerra Mundial el bando nazi planeó utilizarla como arma biológica mediante una bomba que esparciría mosquitos hembra con el protozoo en cuestión. Las pruebas dieron positivo, pero el bando aliado desbarató el avance del proyecto.[21]
Por otro lado, el valor medicinal de la planta Artemisia annua ha sido utilizado por los herbolarios chinos en su medicina tradicional durante 2000 años. Las artemisininas de esta planta, descubiertas por la científica china Tu Youyou y sus compañeros en la década de 1970, se convirtieron en el tratamiento recomendado para la malaria por P. falciparum, administrada en casos graves en combinación con otros antipalúdicos. Tu Youyou recibió el Premio Nobel 2015 en Fisiología o Medicina por su contribución a la investigación contra la malaria, ya que gracias a su trabajo se salvaron vidas y se mejoraron los tratamientos paliativos de las personas diagnosticadas.[22]
Síntomas
[editar]Los síntomas son muy variados, empezando con fiebre, escalofríos, sudoración y dolor de cabeza. Además se puede presentar náuseas, vómitos, tos, heces con sangre, dolores musculares, ictericia, defectos de la coagulación sanguínea, shock, insuficiencia renal o hepática, distrés respiratorio, ruptura esplénica, trastornos del sistema nervioso central y coma.[23] [24] [25]
La fiebre y los escalofríos son síntomas cíclicos, repitiéndose cada tercer o cuarto días según la especie involucrada.[23][24][25]
| P. vivax | P. falciparum | P. malariae | |
|---|---|---|---|
| Duración del ciclo preeritrocítico | 6 a 8 días | 5 a 7 días | 12 a 16 días |
| Periodo prepatente | 11 a 23 días | 9 a 10 días | 15 a 16 días |
| Periodo de incubación | 12 a 17 días | 9 a 14 días | 18 a 40 días |
| Ciclo esquizogónico de los hematíes | 48 horas | 48 horas (irregular) | 72 horas |
| Parasitemia (rango mm³) | 2 000 | 1 000 a 50 000 | 6 000 |
| Gravedad del ataque primario | Benigno | Grave en los no inmunes | Benigno |
| Duración de la crisis febril | 8 a 12 horas | 16 a 36 horas | 8 a 10 horas |
| Recurrencias | Medianas | Nulas o escasas | Abundantes |
| Lapsos entre recurrencias | Largos | Cortos | Muy largos |
| Duración de la infección | 2 a 3 años | 1 a 2 años | 3 a 50 años |
La reactivación debida a hipnozoítos suele ocurrir durante los tres primeros años (paludismo recidivante).
P. falciparum es el que produce la malaria más aguda y grave. Produce secuestro de hematíes en microcirculación capilar, evita el paso por el bazo y, por tanto, su destrucción. Produce malaria cerebral, con alteraciones en el nivel de conciencia, coma, convulsiones, hipoglucemia, hiperinsulinemia en adultos, acidosis metabólica, ictericia o hemorragias que son signos de mal pronóstico que requieren una actuación médica inmediata. La enfermedad es grave en niños y mujeres embarazadas.
La proteína I de la membrana eritrocitaria de P. falciparum (PfEMPI) se une a ligandos en las células endoteliales (CD36, tromboplastina, VCAM I, ICAM I Y E-selectina). Los eritrocitos infectados se agrupan en rosetas y se pegan a las células endoteliales, producen isquemia y causa las manifestaciones de la malaria cerebral.
También se estimula la producción de niveles muy elevados de citoquinas (IL1, TNF, INF) que estimulan la producción de óxido nítrico, produciendo daño celular. En la malaria cerebral maligna, los vasos cerebrales están taponados por eritrocitos parasitados. Aparecen hemorragias anulares relacionadas con hipoxia local, acompañadas de zonas inflamatorias llamadas granulomas de Dürck o de la malaria.
Tratamiento de la malaria
[editar]La OMS recomienda que antes de administrar el tratamiento se confirme el diagnóstico con métodos parasitológicos. Se utilizan la microscopía y las pruebas rápidas de detección de Ag en sangre para obtener los resultados en menos de una hora.
Microscopía
[editar]Para estas técnicas se requiere coloración de la muestra con derivados de Romanovski. Una de las coloraciones más usadas es la de Giemsa. El examen se realiza mediante:
- La gota gruesa: es una técnica de referencia que requiere microscopistas expertos. Es la técnica más difundida.
Permite el examen de una mayor cantidad de sangre en menos tiempo. Se pone una gota en el centro de la lámina y se hacen movimientos envolventes para romper los hematíes y que permita observar los parásitos.
- Extensión sangre periférica: es más lento que la gota gruesa, no se rompen los hematíes, por lo que los parásitos no cambian la morfología y es más fácil identificarlos.
Puede utilizarse sangre venosa anticoagulada recogida en tubos con EDTA.
Serología
[editar]Las pruebas serológicas más utilizadas para detectar el paludismo son las siguientes ensayos inmunoenzimáticos (ELISA), ensayos indirectos de anticuerpos fluorescentes (IFAT) y ensayos multiplex basados en microesferas. Estas técnicas detectan anticuerpos contra antígenos específicos de Plasmodium como la CSP (proteína del circunsporozoito) o la MSP-1 (proteína 1 de la superficie del merozoito).[26][27] IFAT y ELISA se emplean sobre todo en estudios epidemiológicos. Su utilidad en zonas endémicas se ve limitada por al constante contacto con el parásito, lo que hace que una buena parte de las poblaciones de estas áreas tengan títulos de anticuerpos.
Diferenciación de especies
[editar]P. falciparum: Los eritrocitos infectados no aumentan de tamaño, ni se deforman y están poliparasitados con mayor frecuencia. Los gametocitos se ven en forma de banana. En sangre periférica es muy raro observar esquizontes ya que los eritrocitos parasitados están adheridos al endotelio capilar. Cuando están presentes son un signo de malaria complicada. P. falciparum se observa también en el borde de la membrana de los eritrocitos y a esta posición se denomina “appliquée o accolé”. A veces se detectan gránulos rojizos en la membrana de los eritrocitos llamados puntos de Mauer.
P. malariae: Los eritrocitos son de tamaño normal o disminuido. El parásito adopta formas en “banda y en barra” dentro de los eritrocitos. El esquizonte presenta ocho merozoítos que se disponen “en roseta”. A veces aparecen los puntos de Ziemann como gránulos rojizos en el interior de la célula anfitriona.
P. vivax: Los eritrocitos presentan un tamaño aumentado y en su membrana se observan gránulos de color rosa (punteado de Schüffner). Los esquizontes eritrocitarios suelen contener hasta 24 merozoítos y los esquizontes maduros presentan la hemozoína (pigmento palúdico o pigmento malárico) formando gránulos grandes.[28]
P. ovale: Los eritrocitos presentan un tamaño aumentado y presentan punteado de Schüffner positivo. El esquizonte maduro contiene la mitad de los merozíotos que el de P vivax.
Diagnóstico diferencial
[editar]Se puede dar un diagnóstico diferencial entre malaria y otras enfermedades febriles como, entre otras, leptospirosis, Chagas, leishmaniasis visceral, dengue, chicungunya y la fiebre de Zika.[29]
Malaria complicada
[editar]Paciente con parasitemia positiva y con uno de los siguientes síntomas o signos que indican riesgo de una complicación: Poliartralgia severa, alteraciones neurológicas, hemoglobina por debajo de 7 g/dl, hiperparasitemia (definida como conteo de trofozoitos superior a 50 000 o la presencia de esquizontes —en el caso de P. falciparum—), ictericia, disnea o taquipnea, disminución de la diuresis, coluria, vómitos a repetición o cualquier tipo de sangrado. La mortalidad de la malaria complicada sin tratamiento es cercana al 100 %.
Prevención
[editar]Los métodos utilizados para prevenir el paludismo incluyen los medicamentos, la eliminación de los mosquitos y la prevención de las picaduras. A partir de 2020, existe una vacuna contra el paludismo (conocida como RTS,S) cuyo uso está autorizado.[30] La presencia del paludismo en una zona requiere una combinación de alta densidad de población humana, alta densidad de población de mosquitos anofeles y altas tasas de transmisión de humanos a mosquitos y de mosquitos a humanos. Si cualquiera de estos factores se reduce lo suficiente, el parásito termina por desaparecer de esa zona, como ocurrió en América del Norte, Europa y partes del Oriente Medio. Sin embargo, a menos que el parásito sea eliminado de todo el mundo, podría restablecerse si las condiciones vuelven a una combinación que favorezca la reproducción del parásito.
Control de mosquitos
[editar]El control de mosquitos se encarga de administrar la población de mosquitos para reducir su impacto en la salud humana y la economía.
Para la protección individual, los repelentes de insectos más eficaces se basan en el DEET o la picaridina.[31] Sin embargo, no hay pruebas suficientes de que los repelentes de mosquitos puedan prevenir la infección del paludismo.[32]
Los mosquiteros tratados con insecticidas y la fumigación residual de interiores han demostrado ser muy eficaces para prevenir el paludismo entre los niños en las zonas donde es común.[33]
Mosquiteros tratados con insecticidas
[editar]
Los mosquiteros ayudan a mantener a los mosquitos alejados de las personas y a reducir las tasas de infección y la transmisión del paludismo. Los mosquiteros no son una barrera perfecta y a menudo se tratan con un insecticida diseñado para matar al mosquito antes de que este tenga tiempo de encontrar una forma de pasar el mosquitero. Se estima que los mosquiteros tratados con insecticidas son dos veces más eficaces que los no tratados y ofrecen una protección superior al 70 % en comparación con los que no tienen mosquiteros.[34]
Se estima que las mosquiteras es una de las intervenciones más efectivas, ya que a un coste de menos de 5 € por mosquitera se protegen de media a 1,8 personas durante 3 años.[35]
Entre 2000 y 2008, el uso de mosquiteros tratados con insecticidas salvó la vida de unos 250 000 niños en el África subsahariana.[34] Se estima que en 2007 el 13 % de los hogares de los países subsaharianos poseían mosquiteros tratados con insecticidas[36] y que en 2008 el 31 % de los hogares africanos poseían al menos un mosquitero tratado con insecticidas. En el año 2000, 1,7 millones (1,8 %) de niños africanos que vivían en zonas del mundo donde la malaria es común estaban protegidos por un MTI. Esa cifra aumentó a 20,3 millones (18,5 %) de niños africanos que utilizaban mosquiteros tratados con insecticidas en 2007, lo que dejó a 89,6 millones de niños desprotegidos[75] y a un 68 % de niños africanos que utilizaban mosquiteros en 2015.[37] La mayoría de los mosquiteros están impregnados con piretroides, una clase de insecticidas de baja toxicidad. Son más eficaces cuando se usan desde el anochecer hasta el amanecer.[38] Se recomienda colgar un "mosquitero de cama" grande sobre el centro de la cama y meter los bordes debajo del colchón o asegurarse de que sea lo suficientemente grande como para tocar el suelo.[39] Los mosquiteros tratados con insecticidas son beneficiosos para los resultados del embarazo en las regiones de África donde la malaria es endémica, pero se necesitan más datos en Asia y América Latina.[40]
En áreas de alta resistencia a la malaria, el butóxido de piperonilo combinado con piretroides en ITN es efectivo para reducir las tasas de infección de la malaria.[41]
DDT
[editar]
Otra vía para detener la malaria en el mundo, que se ha utilizado extensamente en el pasado, es la utilización de insecticidas, como las piretrinas o el DDT. Se prohibió el uso de este último por sus posibles efectos en la salud y en la fauna, pero un grupo de científicos cree que debería revisarse esta prohibición tan estricta.[42] Se considera ahora que un uso medido con fines sanitarios, distinto del uso masivo con fines económicos del que fue objeto en el pasado, es una buena opción para el control o erradicación de la malaria bajo condiciones muy controladas, limitándose al interior de las casas y tejados en las zonas donde esta enfermedad es endémica, según la OMS. Algunos grupos ambientalistas, como la Pesticide Action Network no están de acuerdo con esta medida.[43]
Los defensores del uso del DDT, entre los que se incluyen científicos, estadísticos y ecologistas escépticos como Bjørn Lomborg, argumentan que este es un método eficaz contra la malaria; afirman que gracias a ella la malaria desapareció de Europa, donde era endémica en Grecia o Italia. En Sri Lanka, los casos de malaria descendieron desde 2 800 000 casos en 1948 a 17 en 1963; en la India, de 100 millones de casos en 1935, la cifra bajó a 300 000 en 1969. Bangladés fue declarada zona libre de malaria. Incluso circula la cifra que afirma que la prohibición del DDT ha causado 50 millones de muertes.[44] Defienden su idoneidad basándose en la eficacia que le atribuyen, junto con el bajo coste de su aplicación y el hecho de que no tenga problemas de patentes. Precisamente algunos argumentan que los motivos últimos de la prohibición están en la propia industria, la cual, al acabar las patentes del DDT, quisieron imponer nuevos pesticidas con patente.
Sin embargo, los efectos del DDT en la salud humana y particularmente en trabajadores del programa de control de la malaria están ampliamente documentados. Se ha asociado a un aumento de síntomas neuropsiquiátricos y alteraciones neurológicas.[45]
Vacuna
[editar]Las vacunas para la malaria están en desarrollo, no hay disponible todavía una vacuna completamente eficaz. Los primeros estudios prometedores que muestran la posibilidad de una vacuna contra el paludismo se realizaron en 1967 por la inmunización de ratones con esporozoitos atenuados por radiación, que brindan protección a alrededor del 60 % de los ratones posterior a la inyección de esporozoitos normales y viables. Desde la década de 1970, se ha producido un considerable esfuerzo para desarrollar estrategias de vacunación similares en los seres humanos.
El primer intento de una vacuna sintética contra la malaria fue realizado en 1997 por el equipo de Manuel Elkin Patarroyo; los resultados fueron negativos en África y modestos en Suramérica, por lo cual no se justificaron pruebas adicionales.[46] En 2010, la vacuna aparecía catalogada como «inactiva» por la Organización Mundial de la Salud.[47]
Se han realizado muchos trabajos para intentar comprender los procesos inmunológicos que brindan protección después de la inmunización con esporozoitos irradiados. Tras el estudio de vacunación en ratones en 1967, se formuló la hipótesis de que los esporozoitos inyectados eran reconocidos por el sistema inmune, que a su vez creaba anticuerpos contra el parásito. Se determinó que el sistema inmunológico estaba creando anticuerpos contra la proteína circumsporozoito (CSP) que reviste a los esporozoitos. Además, los anticuerpos contra la CSP impidieron que los esporozoitos invadiesen hepatocitos. CSP, por lo tanto, fue elegida como la proteína más prometedora para desarrollar una vacuna contra la malaria. Es por estas razones históricas que las vacunas basadas en CSP son las más numerosas de todas las vacunas contra la malaria. [cita requerida]
Actualmente, existe una gran variedad de vacunas sobre la mesa. Vacunas pre-eritrocíticas (vacunas que se dirigen a los parásitos antes de que llegue a la sangre), en particular las vacunas basadas en CSP, forman el mayor grupo de investigación de la vacuna contra la malaria. En la lista de vacunas candidatas se incluyen: las que tratan de inducir inmunidad en la etapa de infección de la sangre, las que tratan de evitar las patologías más severas de la malaria evitando la adhesión del parásito a las vénulas de la sangre y a la placenta; y las vacunas que bloqueen la transmisión, que detendrían el desarrollo del parásito en el mosquito justo después de que el mosquito ha tomado sangre de una persona infectada. Es de esperar que la secuenciación del genoma de P. falciparum proporcionará objetivos para nuevos medicamentos o vacunas.[cita requerida]
En octubre de 2021, la OMS recomienda la inmunización con la vacuna RTS-S, por primera vez, habiéndola aprobado para su utilización a gran escala como método complementario de prevención.[48][49][50][51]
Inmunización con plasmodios irradiados
[editar]Se determinó que una persona puede protegerse de una infección por P. falciparum si recibe picaduras de más de 1000 mosquitos infectados por irradiación.[cita requerida]En general, se ha aceptado que no es adecuado tratar a las personas de riesgo con esta estrategia de vacunación, pero esto ha sido recientemente[¿cuándo?] cuestionado por el trabajo que está realizando el doctor Stephen Hoffman, de Sanaria, uno de los principales investigadores que originalmente secuenció el genoma de Plasmodium falciparum. Su trabajo más reciente ha girado en torno a la solución del problema de logística de la preparación y aislamiento de los parásitos equivalentes a 1000 mosquitos irradiados para el almacenamiento masivo y la inoculación de los seres humanos. La compañía ha recibido recientemente varias subvenciones multimillonarias de la Fundación Bill y Melinda Gates y el gobierno de los EE. UU. para iniciar los primeros estudios clínicos en 2007 y 2008.
El Instituto de Investigación Biomédica de Seattle (SBRI), financiado por la Iniciativa Vacuna contra la Malaria asegura a los posibles voluntarios que "los ensayos clínicos no serán un riesgo para la vida. Si bien muchos voluntarios en Seattle realmente contraerán la enfermedad, la cepa clonada utilizada en los experimentos se puede curar, y no causa una forma recurrente de la enfermedad. Algunos de los participantes obtendrá drogas experimentales o vacunas, mientras que otros recibirán placebo".
Vacunas SPf66
[editar]La primera vacuna desarrollada objeto de ensayos de campo fue la SPf66, desarrollada por el científico colombiano Manuel Elkin Patarroyo en 1987, probada en una colonia de monos de la región amazónica, los Aotus trivirgatus. Presenta una combinación de antígenos de los esporozoitos (utilizando repetición CS) y merozoitos del parásito. Durante la fase I de los ensayos se demostró una tasa de eficacia del 75 % y la vacuna pareció ser bien tolerada por el sistema inmunogénico de los sujetos. Los ensayos de las fases IIb y III fueron menos prometedores, la eficacia cayó hasta situarse entre el 38,8 % y el 60,2 %. Un ensayo llevado a cabo en Tanzania en 1993 demostró una eficacia del 31 % después de un año de seguimiento. Sin embargo, un estudio más reciente (aunque controvertido) realizado en Gambia no mostró ningún efecto. A pesar de los períodos de prueba relativamente largos y del número de estudios realizados, aún no se conoce la forma en que la vacuna SPf66 confiere inmunidad, por lo que sigue siendo una improbable solución a la malaria. El CSP fue la siguiente vacuna desarrollada que inicialmente parecía suficientemente prometedora como para someterse a los ensayos. También se basaba en las proteína circumsporozoito, pero además tenía la proteína recombinante (Asn-Ala-Pro15Asn-Val-Asp-Pro)2-Leu-Arg(R32LR) unida covalentemente a una toxina purificada de Pseudomonas aeruginosa (A9). Sin embargo, en una fase temprana se demostró una falta total de inmunidad protectora en los inoculados. El grupo de estudio utilizado en Kenia tuvo un 82 % de incidencia de parasitemia, mientras que el grupo de control solo tuvo un 89 % de incidencia. La vacuna tenía la intención de provocar una respuesta incrementada de linfocitos T en los que fueron expuestos, cosa que tampoco fue observada.[cita requerida]
La vacuna se probó en más de 41 000 voluntarios en América Latina, donde a principios de 1994 fueron inoculados 45 voluntarios que demostraron que la vacuna induce una fuerte respuesta inmunitaria (entre un 40 y un 60 % en los adultos, y hasta un 77 % en los niños) contra la malaria, sin provocar efectos colaterales. Finalmente, luego de ser evaluada en Gambia, Tanzania y Tailandia, la vacuna demostró no tener la efectividad aspirada por el doctor Patarroyo, por lo cual se detuvo el proceso de fabricación y vacunación con la SPF66. [cita requerida]
Vacuna RTS,S/AS02A
[editar]La vacuna RTS,S/AS02A fue desarrollada por una alianza entre la PATH Malaria Vaccine Initiative (un concesionario de la Fundación Gates), la empresa farmacéutica GlaxoSmithKline, y el Walter Reed Army Institute of Research. En esta vacuna, una porción de CSP ha sido fundida con el "S antígeno" inmunogénico del virus de la hepatitis B; esta proteína recombinante se inyecta junto al potente adyuvante AS02A.
En octubre de 2004, los investigadores de la RTS,S/AS02A anunciaron los resultados de un ensayo de fase IIb, indicando que la vacuna redujo el riesgo de infección en aproximadamente un 30 % y la gravedad de la infección en más de un 50 %. El estudio examinó más de 2000 niños de Mozambique. Los ensayos más recientes de la vacuna RTS,S/AS02A se han centrado en la seguridad y eficacia de su administración en la primera etapa de la infancia: En octubre de 2007, los investigadores anunciaron los resultados de los ensayos de las fases I / IIb realizados sobre 214 lactantes mozambiqueños de entre 10 y 18 meses, en los que la administración de tres dosis de vacuna llevó a un 62 % de reducción de infecciones sin efectos secundarios graves salvo algo de dolor en el punto de inyección. La investigación posterior demorará el lanzamiento comercial de esta vacuna hasta alrededor de 2012.[cita requerida]
La revista The Lancet publicó el 16 de octubre de 2004 los resultados iniciales del mayor ensayo clínico de una vacuna contra la malaria en África.
Resistencia genética
[editar]En zonas endémicas se han creado estrategias para protegerse de la infestación.
Algunas mutaciones en los genes de la Hb confieren resistencia a la malaria. Las personas heterocigotos para el rasgo de células falciformes (HbS) presentan protección frente a P. falciparum, ya que el parásito crece mal debido a las bajas concentraciones de oxígeno. La HbC reduce la proliferación parasitaria. La negatividad para el antígeno Duffy protege de la infección por P. vivax, ya que necesita unirse a este Ag para introducirse en el hematíe. El déficit G6PD provoca hemólisis debido al estrés oxidativo y está asociada al efecto protector de la malaria por P. falciparum.
El viajero que presente fiebre en los tres meses siguientes a la exposición se considera una urgencia por la posibilidad de presentar malaria. Los viajeros presentan síntomas más graves que la población local, ya que estos han desarrollado cierto grado de inmunidad al estar expuestos al parásito, que ayuda a controlar la infección y disminuye la gravedad.
Otros métodos
[editar]La técnica de los insectos estériles se está perfilando como un posible método de control de mosquitos. El progreso hacia insectos transgénicos, o genéticamente modificados, sugieren que las poblaciones de mosquitos silvestres podrían ser resistentes a la malaria. La investigación en el Imperial College de Londres creó el primer mosquito transgénico para el paludismo, con la primera especie resistente a Plasmodium, anunciado por un equipo de la Case Western Reserve University en Ohio, en 2002. El éxito de la sustitución de las poblaciones existentes con poblaciones genéticamente modificadas, se basa en un mecanismo de transmisión, como los elementos trasladables para permitir la herencia mendeliana de los genes de interés. [cita requerida]
Se está desarrollando un novedoso método que consiste en un pequeño dispositivo de 2 milímetros de diámetro que se inserta debajo de la piel. El desarrollo de este implante es el trabajo de Malaria Mission (http://www.malariamission.org/ Archivado el 29 de mayo de 2014 en Wayback Machine.), una iniciativa del grupo de investigación Salud Tropical de la Universidad de Navarra y la Clínica de Navarra, quienes actualmente buscan financiación de U$ 20 000 a través de https://www.indiegogo.com/projects/malaria-mission-help-us-fight-malaria-by-defeating-the-mosquitoes#gallery. El dispositivo consiste en un pequeño implante de silicona que libera ivermectina, una medicina segura y muy utilizada para combatir la malaria y otras infecciones parasitarias endémicas en las zonas tropicales, el medicamento se libera en pequeñas cantidades en el portador ayudándolo a combatir la enfermedad y a la vez hace que los mosquitos que pican al paciente mueran, ya que estos, no toleran los niveles de ivermictina contiene la sangre que acaban de beber de su huésped.
La educación en el reconocimiento de los síntomas de la malaria ha reducido el número de casos en algunas zonas del mundo en desarrollo hasta en un 20 %. Reconocer la enfermedad en las primeras etapas también puede evitar que cause muertes. La educación también puede informar a la gente para cubrir más áreas de aguas estancadas. Por ejemplo, los tanques de agua son caldo de cultivo ideal para el parásito y el mosquito. Por lo tanto, una forma de reducir el riesgo de la transmisión entre las personas es eliminar los recipientes o tanques con agua estancada. Se trata de poner en la práctica en la mayoría en las zonas urbanas donde hay grandes centros de población y por lo tanto la transmisión sería más probable.
Otros métodos adicionales son:
- El control de la intensificación de la irrigación, las presas y otros proyectos relacionados con el agua que contribuyen de forma importante a la carga de morbilidad del paludismo.
- El mejoramiento de la gestión de los recursos hídricos reduce la transmisión del paludismo y de otras enfermedades de transmisión vectorial.[4]
- Protección personal frente a la picadura: vestir ropas de color blanco, que cubran la mayor superficie de la piel; utilizar un repelente cutáneo (que contenga DEET); dormir con una mosquitera tratada con repelentes (permetrinas), etc.
Tratamiento
[editar]Antipalúdicos
[editar]Es menester mencionar que los esquemas antipalúdicos varían de país a país, debido a que se basan en estudios de resistencia a antimaláricos que se realizan de manera periódica, generalmente de acuerdo a un protocolo establecido por la agencia local de la Organización Mundial de la Salud.
Se han observado resistencias de los parásitos a varios antipalúdicos. Las tasas de resistencia aumentan a medida que el uso de nuevos antipalúdicos también aumenta. La microscopía es el único método fiable para controlar la eficacia del tratamiento. Algunos de los fármacos que pueden emplearse son:
- Primaquina: tiene acción potente frente a las formas intrahepáticas llamadas hipnozoítos de P. vivax y P. ovale. Se puede emplear como profiláctico, pero se debe descartar la existencia de un déficit de glucosa -6-P- deshidrogenasa, ya que produce anemias hemolíticas graves en estos casos.
- Cloroquina: presenta actividad esquizonticida rápida frente a las formas eritrocitarias, forma complejos con hemo y evita la cristalización. La cloroquina es el fármaco de elección para el tratamiento de la infección por P. vivax junto con primaquina. En Indonesia y Nueva Guinea han aparecido formas de P. vivax resistentes a la cloraquina. Los pacientes, en estos casos, pueden recibir tratamiento con otros fármacos como quinina o doxiciclina.
- Atavacuona: posee efecto sinérgico con proguanil frente a P. falciparum. Inhibe el transporte electrónico mitocondrial del protozoo.
- Derivados de artemisinina: presentan acción esquizonticida sanguínea rápida. Debido a su corta vida media se deben usar en combinación con otro antimalárico para evitar recrudescencias.
- Lumefantrine: presentan acción esquizonticida sanguínea de larga vida media. Se usa en combinación con artemeter para el tratamiento de malaria por P. falciparum.
- Quinina: presenta actividad esquizonticida hemática, forma complejos con hemo que resultan tóxicos para el parásito. Se usa en áreas palúdicas con resistencia de P. falciparum. Se le debe asociar un segundo fármaco como clindamicina o doxiciclina.
- Artemisia annua: infusiones de 1 litro diario durante 7 días curan radicalmente (ausencia de plasmodium en sangre a los 28 días) en un 96 % de los casos.
- Artemisia afra: infusiones de 1 litro diario durante 7 días curan radicalmente (ausencia de plasmodium en sangre a los 28 días) en un 89 % de los casos. Curiosamente Artemisia afra no contiene Artemisinina.
Si hay resistencias suele utilizarse atavacuona- proguanil y en la malaria grave producida por P. falciparum se emplea quinina + doxiciclina y artemeter (artemisina).
La mayoría de estos compuestos tienen como diana estadios sanguíneos de la infección, y a muchos de ellos ya se han desarrollado resistencias. Es por ello que se necesitan nuevos compuestos para tratar la malaria, siendo candidatos moléculas cuyas dianas sean estadios hepáticos, lo que evitaría el desarrollo de síntomas y, además, se podrían utilizar para eliminar los hipnozoítos de Plasmodium vivax.[52]
Investigación
[editar]La posibilidad de cultivar en el laboratorio el parásito de la malaria ha significado un gran avance en la investigación, pues permite experimentar las interacciones y la biología del parásito en relación con las células humanas (eritrocitos, principalmente) y su entorno. El método original de cultivo ex vivo del Plasmodium falciparum fue descrito por Trager y Jensen en 1976,[53] utilizando una cámara de cristal al vacío donde se podía rebajar la concentración de oxígeno. La primera cepa en poderse cultivar con éxito fue la FCR-3/Gambia, al diluir sangre infectada en el medio RPMI 1640. Este avance permitió el cultivo continuo del parásito, lo que fue fundamental para el ensayo de fármacos antimaláricos y la investigación genética del P. falciparum. Estudios posteriores mostraron que la agitación de los cultivos mejoraba su crecimiento[54] y más recientemente se ha proporcionado un método que permite una elevada sincronía del ciclo de los parásitos en cultivo y donde se pueden alcanzar altas densidades de células parasitarias en un estadio preciso.[55]
Los parásitos en el estadio hepático de forma selectiva son una diana emergente como estrategia alternativa frente a la resistencia a las últimas terapias usadas contra las etapas hemáticas del parásito.[52]
En un estudio realizado en 2019, mediante modelos experimentales de mutantes knockout (KO) de Plasmodium berguei se vieron genes que podrían ser esenciales en la etapa hepática. Además, generaron un modelo metabólico a nivel computacional de esta especie que predecía la esencialidad de genes implicados en diferentes rutas metabólicas. La combinación de ambos modelos ha permitido la identificación de siete subsistemas metabólicos que se vuelven esenciales en comparación con la etapa hemática. Dentro de estos subsistemas destaca la biosíntesis de ácidos grasos, elongación de ácidos grasos, metabolismo de ácidos tricarboxílicos, de aminoácidos, del grupo hemo, etc.[52]
Concretamente estudiaron 3 rutas: la biosíntesis de ácidos grasos, la elongación de ácidos grasos y la biosíntesis de amino azúcares. Para las dos primeras rutas demostraron una clara dependencia de la etapa hepática del metabolismo de los ácidos grasos, pues mutantes KO para enzimas implicadas en estos procesos presentaban un retraso en la maduración y en el periodo prepatente. Los mutantes KO se realizaron con los genes obtenidos en los modelos previamente mencionados.[52]
Para la ruta de biosíntesis de amino azúcares demostraron por primera vez el papel fundamental de esta ruta en las etapas hepáticas del parásito. Concretamente vieron que la captación de N – acetil – glucosamina era limitante y, por tanto, su síntesis era necesaria para el desarrollo del parásito. Mutantes KO para enzimas implicadas en la síntesis de esta molécula presentaban un retraso en la maduración y en el periodo prepatente.[52]
Estos descubrimientos, junto con el modelo computacional proporcionan una base para el futuro diseño de terapias antipalúdicas dirigidas a proteínas metabólicas.[52]
Epidemiología
[editar]
La malaria afecta a unos 200 millones de personas y provoca aproximadamente 400 000 muertes anuales,[2] lo que representa una muerte cada 90 segundos. Un estudio que analiza la evolución de la mortalidad la cuantífica en 1 238 000 (IC95% :929 000–1 685 000) en 2010.[56] La gran mayoría de los casos ocurre en niños menores de 5 años;[57] las mujeres embarazadas son también especialmente vulnerables.[58] A pesar de los esfuerzos por reducir la transmisión e incrementar el tratamiento, ha habido muy poco cambio en las zonas que se encuentran en riesgo de la enfermedad desde 1992.[59] De hecho, si la prevalencia de la malaria continúa en su curso de permanente aumento, la tasa de mortalidad puede duplicarse en los próximos veinte años.[60] Las estadísticas precisas se desconocen porque muchos casos ocurren en áreas rurales, donde las personas no tienen acceso a hospitales o a recursos para garantizar cuidados de salud. Como consecuencia, la mayoría de los casos permanece indocumentada.[60]
Aunque la coinfección de VIH con malaria ha incrementado la mortalidad, sigue siendo un problema menor que la combinación de VIH-tuberculosis.[cita requerida]
Mecanismo de transmisión y ciclo biológico de Plasmodium
[editar]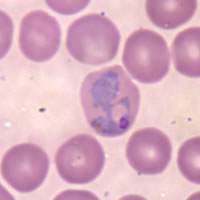
La hembra del Anopheles infectada es portadora de los esporozoítos del Plasmodium en sus glándulas salivales. Si pica a alguien, los esporozoitos entran en la persona a través de la saliva del mosquito y migran al hígado por el torrente sanguíneo, donde se multiplican rápidamente dentro de las células hepáticas (los hepatocitos) mediante una división asexual múltiple, y se transforman en merozoitos que entran en el torrente sanguíneo. En el hepatocito, de un esporozoito surgen miles de merozoitos, lo que conlleva una alta actividad metabólica, siendo un punto de vulnerabilidad en los parásitos ya que se sabe que hay diferencias metabólicas entre el parásito y el hospedador.[52]
En la sangre infectan los eritrocitos y siguen multiplicándose, dando lugar a unas formas iniciales típicamente anulares (trofozoítos), formas en división asexual múltiple (merontes) y finalmente un número variable de merozoítos según la especie de Plasmodium, lo que provoca la ruptura del eritrocito. Algunos merozoítos dejan de multiplicarse y se transforman en unas células relativamente grandes que son gametocitos femeninos y masculinos, circulares en la mayoría de las especies y con forma de banana o búmeran en P. falciparum.
Una hembra de Anopheles no infectada pica a un enfermo y adquiere los gametocitos, y así se inicia el ciclo sexual del Plasmodium. Con la maduración y unión de los gametos en su intestino, la formación de un cigoto, que es móvil, y que dará origen a un ooquiste que volverá a dividirse y dará esporozoitos listos para infectar nuevamente, al llegar a las glándulas salivales del mosquito.

En los humanos, las manifestaciones clínicas se deben a:
La ruptura de glóbulos rojos, que liberan merozoitos, que liberan sustancias que estimulan el hipotálamo, ocasionando repentinas crisis febriles, muy intensas, cada dos o tres días (al completarse el ciclo eritrocítico o asexual de Plasmodium), seguidas al cabo de unas horas de una brusca vuelta a una aparente normalidad. Este proceso va dejando al organismo exhausto, y en el caso de los niños pequeños hay una gran probabilidad de un desenlace fatal en ausencia de tratamiento.
El parásito evita el sistema inmunitario al permanecer intracelularmente en los hepatocitos y eritrocitos por enzimas existentes en la membrana celular eritrocitaria, aunque muchos eritrocitos parasitados se eliminan en el bazo. Para evitarlo, el parásito produce ciertas proteínas que se expresan en la superficie del eritrocito y causan su adherencia al endotelio vascular, especialmente en Plasmodium falciparum: este es el factor principal de las complicaciones hemorrágicas de la malaria. Dichas proteínas son además altamente variables, y por lo tanto el sistema inmunitario no puede reconocerlas de forma efectiva, ya que cuando elabora un número de anticuerpos suficiente (al cabo de dos semanas o más), estos serán inútiles porque el antígeno ha cambiado.
El ciclo continúa cuando un mosquito ingiere sangre de un enfermo o portador, y con ello algunos gametocitos. En el intestino del mosquito estos se transforman en macrogametos (femeninos) y microgametos (masculinos), que se fusionan dando un cigoto móvil u oocineto. Este finalmente formará los esporozoítos que migran a las glándulas salivares del mosquito, completando el ciclo vital.
Las mujeres gestantes son especialmente atractivas para los mosquitos y la malaria en ellas es especialmente nefasta, dada la sensibilidad del feto (que no tiene un sistema inmunitario desarrollado) a la infección.
Se necesitan dos organismos anfitriones: mosquitos para las fases de reproducción sexual, y el ser humano y animales para la reproducción asexual. Existe una excepción con Plasmodium vivax y Plasmodium ovale: cuando pica Anopheles se inyectan los esporozoitos, estos van al hígado, y algunos se quedan latentes en el interior de los hepatocitos y reciben el nombre de hipnozoítos. Hay un periodo de incubación largo, se reactivan, se replican y pueden dar clínica tras varios meses después.
P. vivax, P. ovale y P. malariae causan anemia leve, bajos niveles de parasitemia, rotura esplénica y síndrome nefrótico. P. falciparum causa niveles elevados de parasitemia, insuficiencia renal, anemia grave, etc.
España
[editar]En España la malaria fue conocida casi siempre con el nombre de "tercianas" o "fiebre terciana" (de 3 días) relativamente benigna, causada por el Plasmodium malariae; y, en menor grado, la fiebre cuartana maligna causada por el Plasmodium falciparum o el Plasmodium vivax, una fiebre intermitente de cuatro y dos días mucho más grave. Ambas fueron endémicas y se combatieron con polvo del árbol americano de la quina o quinina hasta la mitad del siglo XX, después se sumó la cloroquina y a fines de siglo también la artemisina. En 1943 se diagnosticaron unos 400 000 casos y se registraron 1307 muertes debidas a la malaria.[61]
El último caso autóctono se registró en mayo de 1961. En 1964 España fue declarada libre de malaria y recibió el certificado oficial de erradicación.[61] Sin embargo, cada año se informaba de casos procedentes principalmente de inmigrantes y turistas. El crecimiento del número de viajeros a países donde la malaria estaba presente y los viajes de inmigrantes desde donde la malaria es endémica aumentaron los casos de malaria importada. En 1967 hubo 21 casos, en 1995 hubo 263 y en 2004 hubo 351 casos.
En 2001, se produjo el primer caso autóctono tras la erradicación de los años 60.[62] Fue una infección por Plasmodium ovale, que se creía endémica de otros lugares, en Asia sobre todo, pero también de África occidental, y no se pudo determinar el origen ni la especie del vector mosquito que la trajo. En 2010 se produjo el primer caso desde la erradicación de la malaria por Plasmodium vivax, transmitida por Anopheles atroparvus, la especie de anofelino más abundante en la zona y competente para esta especie de tripanosomátido.[63] En 2014, se produce otro caso en Navarra de Plasmodium vivax, del que se logra identificar su origen, a partir de casos importados paquistaníes, y se sospecha del papel vectorial de Anopheles atroparvus.[64]
Véase también
[editar] Wikcionario tiene definiciones y otra información sobre paludismo.
Wikcionario tiene definiciones y otra información sobre paludismo.- Artemisinina
- Cloroquina
- DDT
- Enfermedades de origen hídrico
- Anemia de células falciformes
- Talasemia
- Proyecto de control de la malaria
- Malaria Atlas Project
- Fundación Bill y Melinda Gates
- Antipalúdico
- Malaria Consortium
Referencias
[editar]- ↑ Cf. A. R. «La malaria viene de los gorilas.» 22 de septiembre de 2010. El País.
- ↑ a b c «Malaria». ayudaefectiva.org.
- ↑ «Día Mundial del Paludismo». Organización Mundial de la Salud.
- ↑ Ashley, Elizabeth A; Pyae Phyo, Aung; Woodrow, Charles J (2018-04). «Malaria». The Lancet 391 (10130): 1608-1621. ISSN 0140-6736. doi:10.1016/s0140-6736(18)30324-6. Consultado el 17 de diciembre de 2024.
- ↑ Echeverri, Daniel; Barreto, Dhayra Karem; Osorio, Lyda; Cortés, Armando; Martínez, Ernesto (2012-03). «Malaria por Plasmodium vivax transmitida por transfusión de un donante asintomático a un recién nacido prematuro». Biomédica 32: 8-12. ISSN 0120-4157. Consultado el 30 de abril de 2022.
- ↑ Campbell Collaboration (2018). «Los mosquiteros gratuitos aumentan su tenencia y la educación puede aumentar su uso.». Oslo: Campbell Collaboration. Consultado el 17 de noviembre de 2019.
- ↑ Lana Augustincic Polec, Jennifer Petkovic,Vivian Welch et all. Cochrane library, ed. «Estrategias para aumentar la propiedad y el uso de mosquiteros tratados con insecticida para prevenir el paludismo».
- ↑ Joy, D., Feng, X., Mu, J., et al. (2003). «Early origin and recent expansion of Plasmodium falciparum.». Science 300 (5617): 318-21. PMID 12690197. [1]
- ↑ Escalante A, Freeland D, Collins W, Lal A (1998). «The evolution of primate malaria parasites based on the gene encoding cytochrome b from the linear mitochondrial genome.». Proc Natl Acad Sci U S A 95 (14): 8124-9. PMID 9653151. Archivado desde el original el 21 de marzo de 2008. Consultado el 16 de octubre de 2007. [2]
- ↑ Cox F (2002). «History of human parasitology.». Clin Microbiol Rev 15 (4): 595-612. PMID 12364371. [3]
- ↑ Crosby, Alfred (2003). El intercambio colombino: consecuencias biológicas y culturales de 1492 (30 aniversario edición). Connecticut, Estados Unidos: Praeger. p. 283. ISBN 978-0-27598-073-3.
- ↑ «Biography of Alphonse Laveran». The Nobel Foundation. Consultado el 15 de junio de 2007. ] Nobel foundation. Accessed 25 Oct 2006
- ↑ «Ettore Marchiafava». Consultado el 15 de junio de 2007.
- ↑ «Biography of Ronald Ross». The Nobel Foundation. Consultado el 15 de junio de 2007.
- ↑ «Ross and the Discovery that Mosquitoes Transmit Malaria Parasites». CDC Malaria website. Consultado el 15 de junio de 2007.
- ↑ Kaufman T, Rúveda E (2005). «The quest for quinine: those who won the battles and those who won the war.». Angew Chem Int Ed Engl 44 (6): 854-85. PMID 15669029.
- ↑ Kyle R, Shampe M (1974). «Discoverers of quinine». JAMA 229 (4): 462. PMID 4600403.
- ↑ Raju T (2006). «Hot brains: manipulating body heat to save the brain.». Pediatrics 117 (2): e320-1. PMID 16452338.
- ↑ Krotoski W, Collins W, Bray R, et al (1982). «Demonstration of hypnozoites in sporozoite-transmitted Plasmodium vivax infection.». Am J Trop Med Hyg 31 (6): 1291-3. PMID 6816080.
- ↑ Meis J, Verhave J, Jap P, Sinden R, Meuwissen J (1983). «Malaria parasites--discovery of the early liver form.». Nature 302 (5907): 424-6. PMID 6339945.
- ↑ «Los nazis y los mosquitos como arma biológica». vix.com.
- ↑ «The Nobel Prize in Physiology or Medicine 2015». NobelPrize.org (en inglés estadounidense). Consultado el 1 de diciembre de 2019.
- ↑ a b «La Medicina para el Viajero - Malaria». University of Virginia Health System. University of Virginia. Archivado desde el original el 3 de junio de 2007. Consultado el 19 de febrero de 2010.
- ↑ a b «Malaria». New York State Department of Health. Consultado el 19 de febrero de 2010.
- ↑ a b «Malaria o paludismo». Administración Nacional de Laboratorios e Institutos de Salud. Archivado desde el original el 6 de marzo de 2010. Consultado el 19 de febrero de 2010.
- ↑ Vekemans, Johan (2017). Immune Responses to the RTS,S/AS01 Malaria Vaccine Candidate: Lessons from Human Immunology, Parasitologic and Clinical Evaluations. Springer International Publishing. pp. 139-156. ISBN 978-3-319-45208-1. Consultado el 17 de diciembre de 2024.
- ↑ Corran, Patrick; Coleman, Paul; Riley, Eleanor; Drakeley, Chris (2007-12). «Serology: a robust indicator of malaria transmission intensity?». Trends in Parasitology 23 (12): 575-582. ISSN 1471-4922. doi:10.1016/j.pt.2007.08.023. Consultado el 17 de diciembre de 2024.
- ↑ Abba, Katharine; Kirkham, Amanda J; Olliaro, Piero L; Deeks, Jonathan J; Donegan, Sarah; Garner, Paul; Takwoingi, Yemisi (18 de diciembre de 2014). «Rapid diagnostic tests for diagnosing uncomplicated non‐falciparum or Plasmodium vivax malaria in endemic countries». The Cochrane Database of Systematic Reviews 2014 (12): CD011431. ISSN 1469-493X. PMC 4453861. PMID 25519857. doi:10.1002/14651858.CD011431. Consultado el 17 de octubre de 2021.
- ↑ «For Health Care Providers: Clinical Evaluation & Disease | Zika virus | CDC». www.cdc.gov. Archivado desde el original el 25 de diciembre de 2015. Consultado el 24 de diciembre de 2015.
- ↑ «Malaria vaccine: WHO position paper – January 2016». Weekly Epidemiological Record (en inglés) 91 (4): 33-52. 4 de noviembre de 2016. PMID 26829826.
- ↑ Kajfasz P (2009). «Malaria prevention». International Maritime Health 60 (1–2): 67-70. PMID 20205131. Archivado desde el original el 30 de agosto de 2017.
- ↑ Maia MF, Kliner M, Richardson M, Lengeler C, Moore SJ (February 2018). «Mosquito repellents for malaria prevention». The Cochrane Database of Systematic Reviews (en inglés) 2: CD011595. ISSN 1464-780X. PMC 5815492. PMID 29405263. doi:10.1002/14651858.CD011595.pub2.
- ↑ Pryce J, Richardson M, Lengeler C (November 2018). «Insecticide-treated nets for preventing malaria». The Cochrane Database of Systematic Reviews 11: CD000363. PMC 6418392. PMID 30398672. doi:10.1002/14651858.CD000363.pub3.
- ↑ a b Raghavendra K, Barik TK, Reddy BP, Sharma P, Dash AP (2011). «Malaria vector control: From past to future». Parasitology Research 108 (4): 757-79. PMID 21229263. doi:10.1007/s00436-010-2232-0.
- ↑ «Malaria». ayudaefectiva.org.
- ↑ Miller JM, Korenromp EL, Nahlen BL, W Steketee R (2007). «Estimating the number of insecticide-treated nets required by African households to reach continent-wide malaria coverage targets». Journal of the American Medical Association 297 (20): 2241-50. PMID 17519414. doi:10.1001/jama.297.20.2241.
- ↑ Noor AM, Mutheu JJ, Tatem AJ, Hay SI, Snow RW (2009). «Insecticide-treated net coverage in Africa: Mapping progress in 2000–07». Lancet 373 (9657): 58-67. PMC 2652031. PMID 19019422. doi:10.1016/S0140-6736(08)61596-2.
- ↑ Schlagenhauf-Lawlor, 2008, p. 215
- ↑ Instructions for treatment and use of insecticide-treated mosquito nets. World Health Organization. 2002. p. 34. Archivado desde el original el 6 de julio de 2015.
- ↑ Gamble C, Ekwaru JP, ter Kuile FO (April 2006). «Insecticide-treated nets for preventing malaria in pregnancy». Colaboración: Cochrane Infectious Diseases Group. The Cochrane Database of Systematic Reviews (2): CD003755. PMC 6532581. PMID 16625591. doi:10.1002/14651858.CD003755.pub2.
- ↑ Gleave K, Lissenden N, Richardson M, Choi L, Ranson H (November 2018). «Piperonyl butoxide (PBO) combined with pyrethroids in insecticide-treated nets to prevent malaria in Africa». Colaboración: Cochrane Infectious Diseases Group. The Cochrane Database of Systematic Reviews 11: CD012776. PMC 6262905. PMID 30488945. doi:10.1002/14651858.CD012776.pub2.
- ↑ Sarah Boseley (30 de agosto). «Malaria fears over planned DDT ban». The Guardian. Consultado el 27 de julio de 2008.
- ↑ Sarah Boseley (16 de septiembre de 2006). «Banned pesticide backed for malaria control» (artículo periodístico). The Guardian. Consultado el 27 de julio de 2008.
- ↑ Sarah Boseley (30 de agosto). «Malaria fears over planned DDT ban». The Guardian. Consultado el 27 de julio de 2008.
- ↑ MALAGÓN-ROJAS, Jeadran N.; GARROTE-WILCHES, Carolina Fernanda; VARONA, Marcela. Una deuda del pasado: efectos de los organoclorados en trabajadores del programa de control de vectores - Colombia. REVISTA SALUD UIS, [S.l.], v. 46, n. 3, dic. 2014. ISSN 2145-8464. Disponible en: <http://revistas.uis.edu.co/index.php/revistasaluduis/article/view/4496>.
- ↑ Cf. Graves, P. M. y Gelband, H., «Vaccines for preventing malaria (SPf66) (Review)», The Cochrane Library, 2009, (2), págs. 1-38.
- ↑ Cf. WHO, «Tables of Malaria Vaccine Projects Globally», 2010, Initiative for Vaccine Research.
- ↑ Hierro, Lola (6 de octubre de 2021). «La OMS recomienda por primera vez en la historia una vacuna contra la malaria». El País. Consultado el 17 de octubre de 2021.
- ↑ «La OMS recomienda una innovadora vacuna antipalúdica para los niños en riesgo». www.who.int. Consultado el 17 de octubre de 2021.
- ↑ «Research and Product Development by Disease». www.who.int (en inglés). Consultado el 17 de octubre de 2021.
- ↑ Wise, Jacqui (2021). «WHO hails "historic day" as it recommends malaria vaccine.». BMJ (en inglés): n2455-n2455. Consultado el 21 de octubre de 2021.
- ↑ a b c d e f g Stanway, Rebecca R.; Bushell, Ellen; Chiappino-Pepe, Anush; Roques, Magali; Sanderson, Theo; Franke-Fayard, Blandine; Caldelari, Reto; Golomingi, Murielle et al. (2019). «Genome-Scale Identification of Essential Metabolic Processes for Targeting the Plasmodium Liver Stage». Cell. doi:10.1016/j.cell.2019.10.030. Consultado el 25 de diciembre de 2020.
- ↑ Trager, William; Jensen, James B. (20 de agosto de 1976). «Human Malaria Parasites in Continuous Culture». Science (en inglés) 193 (4254): 673-675. ISSN 0036-8075. doi:10.1126/science.781840. Consultado el 27 de septiembre de 2024.
- ↑ Allen, Richard J.W.; Kirk, Kiaran (2010-01). «Plasmodium falciparum culture: The benefits of shaking». Molecular and Biochemical Parasitology (en inglés) 169 (1): 63-65. doi:10.1016/j.molbiopara.2009.09.005. Consultado el 27 de septiembre de 2024.
- ↑ Radfar, Azar; Méndez, Darío; Moneriz, Carlos; Linares, María; Marín-García, Patricia; Puyet, Antonio; Diez, Amalia; Bautista, José M (2009-12). «Synchronous culture of Plasmodium falciparum at high parasitemia levels». Nature Protocols (en inglés) 4 (12): 1899-1915. ISSN 1754-2189. doi:10.1038/nprot.2009.198. Consultado el 27 de septiembre de 2024.
- ↑ Murray, Christopher JL; Rosenfeld, Lisa C.; Lim, Stephen S.; Andrews, Kathryn G.; Foreman, Kyle J.; Haring, Diana; Fullman, Nancy; Naghavi, Mohsen et al. (4 de febrero de 2012). «Global malaria mortality between 1980 and 2010: a systematic analysis». The Lancet (en inglés) 379 (9814): 413-431. ISSN 0140-6736. PMID 22305225. doi:10.1016/S0140-6736(12)60034-8. Consultado el 23 de agosto de 2021.
- ↑ Greenwood BM, Bojang K, Whitty CJ, Targett GA (2005). «Malaria». Lancet 365: 1487-1498. PMID 15850634.
- ↑ Rodriguez-Morales AJ, Sanchez E, Vargas M, Piccolo C, Colina R, Arria M, Franco-Paredes C (2006). «Pregnancy outcomes associated with Plasmodium vivax malaria in northeastern Venezuela». Am J Trop Med Hyg 74: 755-757. PMID 16687675.
- ↑ Hay S, Guerra C, Tatem A, Noor A, Snow R (2004). «The global distribution and population at risk of malaria: past, present, and future.». Lancet Infect Dis 4 (6): 327-36. PMID 15172341.
- ↑ a b Breman J (2001). «The ears of the hippopotamus: manifestations, determinants, and estimates of the malaria burden.». Am J Trop Med Hyg 64 (1-2 Suppl): 1-11. PMID 11425172. Archivado desde el original el 22 de noviembre de 2007.
- ↑ a b Sainz-Elipe, Sandra (31 de julio de 2010). Malaria Journal, ed. «Malaria resurgence risk in southern Europe: climate assessment in an historically endemic area of rice fields at the Mediterranean shore of Spain» (en inglés). Consultado el 20 de diciembre de 2012.
- ↑ Cuadros, Juan; Calvente, Maria José; Benito, Agustin; Arévalo, Juan; Calero, Maria Angeles; Segura, Javier; Rubio, Jose Miguel. Plasmodium ovale Malaria Acquired in Central Spain - Volume 8, Number 12—December 2002 - Emerging Infectious Diseases journal - CDC (en inglés estadounidense). doi:10.3201/eid0812.020105. Consultado el 26 de abril de 2022.
- ↑ Peralta, P. Santa-Olalla; Vazquez-Torres, M. C.; Latorre-Fandós, E.; Mairal-Claver, P.; Cortina-Solano, P.; Puy-Azón, A.; Sancho, B. Adiego; Leitmeyer, K. et al. (14 de octubre de 2010). «First autochthonous malaria case due to Plasmodium vivax since eradication, Spain, October 2010». Eurosurveillance (en inglés) 15 (41): 19684. ISSN 1560-7917. doi:10.2807/ese.15.41.19684-en. Consultado el 26 de abril de 2022.
- ↑ Barrado, Laura; Ezpeleta, Carmen; Rubio, José Miguel; Martín, Carmen; Azcona, José Manuel; Arteaga, Miren; Beristain, Xabier; Navascués, Ana et al. (1 de febrero de 2017). «Source identification of autochthonous-introduced Plasmodium vivax Malaria, Spain». Infection (en inglés) 45 (1): 111-114. ISSN 1439-0973. doi:10.1007/s15010-016-0941-8. Consultado el 26 de abril de 2022.
Bibliografía
[editar]- Rodríguez Ocaña E, Ballester Añón R, Perdiguero E, Medina Doménech RM, Molero Mesa J. (2003) La acción médico-social contra el paludismo en la España metropolitana y colonial del siglo XX. Madrid: Consejo Superior de Investigaciones Científicas.
- Cueto, Marcos (2007). Cold war, deadly fevers: malaria eradication in Mexico, 1955-1975 / Marcos. Washington, D.C.: Woodrow Wilson Center Press; Baltimore: Johns Hopkins University Press, c2007.
- Robbins y Cotran (2010). Patología Estructural y funcional. 8.ª Edición. Ed. Elsevier Saunders.
- P.R Murray, K.S Rosenthal, M.A Pfaller (2009) Microbiología Médica. 6.ª Edición. Ed. Elsevier.
- Arrow, Kenneth J. (2004). «Malaria: cuando se cruzan la biología y la economía». Finanzas y desarrollo: publicación trimestral del Fondo Monetario Internacional y del Banco Mundial 41 (1): 20-.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Malaria.
Wikimedia Commons alberga una categoría multimedia sobre Malaria. Wikcionario tiene definiciones y otra información sobre malaria.
Wikcionario tiene definiciones y otra información sobre malaria. Wikcionario tiene definiciones y otra información sobre paludismo.
Wikcionario tiene definiciones y otra información sobre paludismo.
- En español
- Malaria, en MedlinePlus
- «En el corazón de la malaria», Documento de elmundo.es.
- En inglés
- Malaria en la Organización Mundial de la Salud -WHO-
- Por primera vez una vacuna ha protegido un gran número de niños contra la malaria. http://www.washingtonpost.com/national/health-science/experimental-malaria-vaccine-protects-many-children-study-shows/2011/10/17/gIQA5NyguL_story.html
- Artículos de prensa en español


 French
French Deutsch
Deutsch