Piperazina , la enciclopedia libre
| Piperazina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Piperazina | ||
| General | ||
| Otros nombres | Dietilendiamina 1,4-diazaciclohexano Hexahidropirazina Piperazidina Antiren Uvilon Dispermina Lumbrical Eraverm | |
| Fórmula semidesarrollada | (CH2)2NH(CH2)2NH | |
| Fórmula molecular | C4H10N2 | |
| Identificadores | ||
| Código ATC | P02CB01 | |
| Número CAS | 110-85-0[1] | |
| Número RTECS | TK7800000 | |
| ChEBI | 28568 | |
| ChEMBL | CHEMBL1412 | |
| ChemSpider | 13835459 | |
| DrugBank | 00592 | |
| PubChem | 4837 | |
| C1CNCCN1 | ||
| Propiedades físicas | ||
| Apariencia | Sólido. Cristales blancos o incoloros. | |
| Olor | Acre, amoniacal. | |
| Densidad | 1100 kg/m³; 1,1 g/cm³ | |
| Masa molar | 86,14 g/mol | |
| Punto de fusión | 108 °C (381 K) | |
| Punto de ebullición | 146 °C (419 K) | |
| Presión de vapor | 0,8 mmHg (20 °C) | |
| Índice de refracción (nD) | 1,446 | |
| Propiedades químicas | ||
| Acidez | 9,73 / 5,33 pKa | |
| Solubilidad en agua | 1000 g/L | |
| Solubilidad | 500 g/L (alcohol 95%) | |
| log P | -1,50 | |
| Familia | Amina | |
| Peligrosidad | ||
| Punto de inflamabilidad | 338 K (65 °C) | |
| Temperatura de autoignición | 593 K (320 °C) | |
| Límites de explosividad | 4% - 14% | |
| Compuestos relacionados | ||
| aminas heterocíclicas | Pirrolidina Piperidina Azepano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
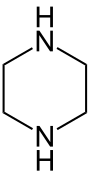
La piperazina, llamada también dietilendiamina, 1,4-diazaciclohexano, hexahidropirazina y piperazidina, es un compuesto orgánico de fórmula molecular C4H10N2. Consiste en un anillo de seis miembros, cuatro carbonos y dos nitrógenos en posiciones opuestas. Como grupo, las piperazinas forman una clase numerosa de compuestos químicos que se caracterizan por tener un anillo de piperazina; muchos de ellos poseen importantes propiedades farmacológicas.
Propiedades físicas y químicas
[editar]A temperatura ambiente, la piperazina es un sólido que forma cristales o agujas incoloras o de color blanco, que se oscurecen al ser expuestos a la luz. Posee un olor acre o amoniacal, siendo su sabor es salado.
Su punto de fusión es de 108 °C y su punto de ebullición 146 °C. Tiene una densidad mayor que la del agua (ρ = 1,1 g/cm³) y, en fase vapor, es tres veces más densa que el aire.[2][3]
Es una sustancia muy soluble en agua, así como en glicerina, diversos glicoles y cloroformo. En cambio, su solubilidad es mucho menor en disolventes apolares como benceno y heptano, dado el valor del logaritmo de su coeficiente de reparto (logP = -1,50).[3]
En disolución acuosa, la piperazina se comporta como una base (pKa = 9,73); una disolución de piperazina al 10 % posee un pH = 10,8-11,8.[3] En consecuencia, neutraliza ácidos en reacciones exotérmicas formando la sal correspondiente y agua. Por otra parte, es un compuesto higroscópico que absorbe el dióxido de carbono del aire, lo que produce la sensación de que los cristales secos comienzan a fundirse.[4]
Síntesis
[editar]La piperazina se puede sintetizar mediante la reacción entre etanolamina y amoníaco a alta presión sobre un catalizador en presencia de hidrógeno. Se obtiene una mezcla de etilenaminas —entre ellas piperazina—, además de agua. Las etilenaminas son separadas entre sí por destilación.[3]
La piperazina también puede obtenerse a partir de dicloruro de etileno, haciendo reaccionar este producto con un exceso de amoníaco a alta presión y a temperatura moderada. La solución resultante de hidrocloruro de etilenamina se neutraliza con sosa cáustica para formar piperazina y otras etilenaminas, que posteriormente se aíslan por destilación. El cloruro de sodio se forma como subproducto.[3]
Por otra parte, la piperazina también se obtiene como subproducto en la producción de etilendiamina, en particular cuando se utiliza etanolamina como material de partida. Si la etanolamina reacciona con amoníaco a 150-220 °C y 10-25 MPa, la piperazina puede ser destilada a partir de la mezcla de productos, que además contiene etanolamina sin reaccionar, etilendiamina, dietilentriamina, aminoetiletanolamina y diversas poliaminas.[5]
Otras formas de sintetizar pirazidina se basan en la ciclación de poliaminas lineales como la citada etilendiamina o trietilentetramina (TETA); en este último caso la reacción tiene lugar a 360-370 °C en presencia de un catalizador de aluminosilicato cristalino de tipo sodio.[6]
Usos
[editar]Uso como antihelmíntico
[editar]La piperazina se comenzó a usar como antihelmíntico en 1953[7] y desde entonces se han usado un amplio grupo de sus derivados con este fin, en especial para la ascariasis e infecciones por oxiuros. El modo de acción se fundamenta en la parálisis de los parásitos, lo que permite que el organismo hospedador pueda con facilidad remover o expeler al microorganismo invasor. Su acción es mediada por los efectos agonistas por el receptor inhibidor GABA (ácido γ-aminobutírico). La selectividad por los helmintos se debe a que los vertebrados solo emplean al receptor GABA en el sistema nervioso central, además de que el receptor en las membranas de los parásitos es una isoforma diferente del de los vertebrados. Las principales piperazinas son el hidrato de piperazina y el citrato de piperazina. Hay derivados de la piperazina, como al 1-fenilpiperazina (BZP) o la tricloro-fenil-piperazina (TMFPP), que son sustancias con problemas de adicción, que tienen una leve acción estimulante sobre el sistema nervioso central.[8]
Uso para captura y almacenamiento de carbono
[editar]Otra importante aplicación de la piperazina es como fluido para la depuración de CO2 y H2S en asociación con metildietanolamina. En este sentido, en métodos comerciales de captura y almacenamiento de carbono (CCS) se usan mezclas de aminas activadas por piperazina concentrada para la eliminación del CO2, pues la piperazina protege eficazmente de la degradación térmica y oxidativa del gas procedente de la combustión del carbón.
Precauciones
[editar]La piperazina es un producto inflamable. Su punto de inflamabilidad es de 65 °C y su temperatura de autoignición de 320 °C. En cuanto a su toxicidad, esta sustancia provoca quemaduras por todas las vías de exposición. Puede ocasionar síntomas de alergia o asma, tales como reacciones alérgicas en la piel.[9]
Véase también
[editar]Referencias en texto
[editar]- ↑ Número CAS
- ↑ Piperazine (ChemSpider)
- ↑ a b c d e Piperazine (PubChem)
- ↑ 1,4-Diazacyclohexane(110-85-0) (Chemical Book)
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. 6th ed.Vol 1: Federal Republic of Germany: Wiley-VCH Verlag GmbH & Co. 2003 to Present, p. V2 400 (2003)
- ↑ Method for producing triethylenediamines and piperazines (2002). Tsukasa Ogawa. Patente US 6350874 B1.
- ↑ Piperazine (DrugBank)
- ↑ Ponencia Congreso Socidroalcohol.- abril 2013. Dr. Juan Carlos López Corbalán y Dr. Luna Maldonado.
- ↑ Piperazine. Safet data sheet. (Acros)
Referencias generales
[editar]- Merck Index, 13ª Ed., 7545.


 French
French Deutsch
Deutsch