Proteínas S100 , la enciclopedia libre
Las proteínas S100 forman una familia de proteínas de bajo peso molecular. Se encuentran en vertebrados y se caracterizan por presentar dos sitios de unión de calcio que tienen una conformación de helix-bucle-helix. Hay al menos 21 tipos diferentes de proteínas S100.[1] Están codificadas por una familia de genes cuyos símbolos utilizan el prefijo S100, por ejemplo, S100A1, S100A2, S100A3.
Son también consideradas tan moléculas con patrón molecular asociado a daño (DAMPs) y Knockdown de AHR abajo regula la expresión de S100 proteínas en THP-1 células.[2]
Estructura
[editar]La mayoría de las proteínas S100 son homodiméricas, constando de dos polipéptidos idénticos, los cuales se mantienen unidos por enlaces no covalentes. Las proteínas S100 son estructuralmente similares a la calmodulina. Por otro lado, difieren de esta en otras características. Por ejemplo, su patrón de expresión es específico de determinados tipos celulares. Su expresión depende de factores ambientales. Sin embargo, la calmodulina es un receptor intracelular de Ca2+ ubicuo y universal, ampliamente expresado en muchas células.
Función
[editar]Las proteínas S100 de forma normal están presentes en las células derivadas de la cresta neuronal (células de Schwann, y melanocitos), condrocitos, adipocitos, células mioepiteliales macrófagos, células de Langerhans,[3][4][5] células dendríticas y queratinocitos. Pueden estar presentes en algunos tipos de células epiteliales mamarias.
Las proteínas S100 están implicadas en una gran cantidad de funciones intracelulares y extracelulares.[6] Están implicadas en el control de la fosforilación de proteínas, factores de transcripción, en la homeostasis de Ca2+, en la dinámica de los componentes del citoesqueleto, actividades enzimáticas, crecimiento celular y diferenciación, y en la respuesta inflamatoria. Se ha descubierto que tanto S100UA7 (psoriasina) como S100A15 actúan como citoquinas en la inflamación, particularmente en enfermedades autoinmunes de la piel como la psoriasis.[7]
Patología
[editar]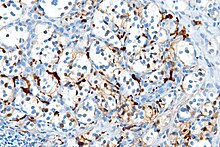
Varios miembros de la familia de proteínas S100 son útiles como marcadores para determinados tumores. Pueden ser encontradas en melanomas, en el 100% de schwannomas, 100% de neurofibromas (de forma más débil que en los schwannomas), 50% de los tumores malignos de la vaina de nervios periféricos (de forma débil y/o focal), histiocytoma y célula clara sarcomas.[8] Además, las proteínas S100 son marcadores de enfermedades inflamatorias. También puede mediar en la inflamación y actuar como antimicrobianos.[9]
Genes humanos
[editar]- S100A1, S100A2, S100A3, S100A4, S100A5, S100A6, S100A7 (psoriasina), S100A8 (calgranulina A), S100A9 (calgranulin B), S100A10, S100A11, S100A12 (calgranulina C), S100A13, S100A14, S100A15 (koebnerisina), S100A16
- S100B
- S100P
- S100Z
CRNN; FLG; FLG2; HRNR; RPTN; S100G; TCHH; THHL1;
Nomenclatura
[editar]El prefijo S100 deriva del hecho de que estas proteínas son solubles al 100%. El símbolo a menudo ha sido hyphenated, pero proteína y gen actuales nomenclatura, como HGNC nomenclatura.[10]
Véase también
[editar]- Lista de histología de manchas que ayudan en el diagnóstico de afectaciones cutáneas
- Calprotectina
Referencias
[editar]- ↑ Marenholz I, Heizmann CW, Fritz G (2004).
- ↑ Memari B, Bouttier M, Dimitrov V, Ouellette M, Behr MA, Fritz JH, White JH (2015).
- ↑ Wilson, AJ; Maddox, PH; Jenkins, D (January 1991).
- ↑ Coppola D, Fu L, Nicosia SV, Kounelis S, Jones M (1998).
- ↑ Shinzato M, Shamoto M, Hosokawa S, Kaneko C, Osada A, Shimizu M, Yoshida A (1995).
- ↑ Donato R (2003).
- ↑ Wolf R, Howard OM, Dong HF, Voscopoulos C, Boeshans K, Winston J, Divi R, Gunsior M, Goldsmith P, Ahvazi B, Chavakis T, Oppenheim JJ, Yuspa SH (2008).
- ↑ Nonaka D, Chiriboga L, Rubin BP (2008).
- ↑ Wolf R, Ruzicka T, Yuspa SH (July 2010).
- ↑ Elsevier, Dorland's Illustrated Medical Dictionary Archivado el 11 de enero de 2014 en Wayback Machine., Elsevier.
Bibliografía
[editar]- Wolf R, Voscopoulos CJ, FitzGerald PC, Goldsmith P, Cataisson C, Gunsior M, Walz M, Ruzicka T, Yuspa SH (2006). "The mouse S100A15 ortholog parallels genomic organization, structure, gene expression, and protein-processing pattern of the human S100A7/A15 subfamily during epidermal maturation". The Journal of Investigative Dermatology 126 (7): 1600–8. doi:10.1038/sj.jid.5700210. PMID 16528363.
- Wolf R, Howard OM, Dong HF, Voscopoulos C, Boeshans K, Winston J, Divi R, Gunsior M, Goldsmith P, Ahvazi B, Chavakis T, Oppenheim JJ, Yuspa SH (2008). "Chemotactic activity of S100A7 (Psoriasin) is mediated by the receptor for advanced glycation end products and potentiates inflammation with highly homologous but functionally distinct S100A15". Journal of Immunology 181 (2): 1499–506. doi:10.4049/jimmunol.181.2.1499. PMC 2435511. PMID 18606705.
- Wolf R, Voscopoulos C, Winston J, Dharamsi A, Goldsmith P, Gunsior M, Vonderhaar BK, Olson M, Watson PH, Yuspa SH (2009). "Highly homologous hS100A15 and hS100A7 proteins are distinctly expressed in normal breast tissue and breast cancer". Cancer Letters 277 (1): 101–7. doi:10.1016/j.canlet.2008.11.032. PMC 2680177. PMID 19136201.
- Wolf R, Mascia F, Dharamsi A, Howard OM, Cataisson C, Bliskovski V, Winston J, Feigenbaum L, Lichti U, Ruzicka T, Chavakis T, Yuspa SH (2010). "Gene from a psoriasis susceptibility locus primes the skin for inflammation". Science Translational Medicine 2 (61): 61ra90. doi:10.1126/scitranslmed.3001108. PMID 21148126.


 French
French Deutsch
Deutsch