Sólido amorfo , la enciclopedia libre
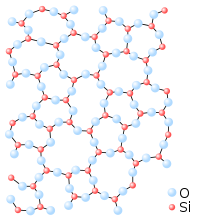

El sólido amorfo es un estado sólido de la materia, en el que las partículas que conforman el sólido no poseen una estructura ordenada. Estos sólidos carecen de formas bien definidas. Esta clasificación contrasta con la de sólidos cristalinos, cuyos átomos están dispuestos de manera regular y ordenada formando redes cristalinas.
Muchos sólidos amorfos son mezclas de moléculas de las que no se pueden distinguir bien sus componentes. Casi todos los demás se componen de moléculas grandes y complejas. Entre los sólidos amorfos más conocidos destaca el vidrio.
Un mismo compuesto superenfriado, según el proceso de solidificación, puede formar una red cristalina o un sólido amorfo. Por ejemplo, según la disposición espacial de las moléculas de sílice (SiO2), se puede obtener una estructura cristalina (el cuarzo) o un sólido amorfo (el vidrio).
Etimología
[editar]El término proviene del griego a ("sin") y morphé ("figura, forma").

Propiedades de los sólidos amorfos
[editar]Las moléculas de los sólidos amorfos están distribuidas al azar lo que se traduce en que las propiedades físicas macroscópicas del sólido son isótropas, idénticas en todas las direcciones.
Los materiales amorfos tienen una estructura interna que consta de bloques estructurales interconectados que pueden ser similares a las unidades estructurales básicas que se encuentran en la fase cristalina correspondiente del mismo compuesto.[1] Sin embargo, a diferencia de los materiales cristalinos, no existe un orden de largo alcance. Por lo tanto, los materiales amorfos no pueden definirse mediante una celda unitaria finita. Los métodos estadísticos, como la función de densidad atómica y la función de distribución radial, son más útiles para describir la estructura de sólidos amorfos.[2][3]
Los sólidos amorfos tienen una temperatura característica a la cual sus propiedades experimentan cambios importantes. Esta temperatura se conoce como temperatura de transición vítrea (Tg). La temperatura de transición a vidrio de un material amorfo puede reducirse añadiendo moléculas pequeñas, denominadas "plastificadores", que se adaptan entre las moléculas vítreas y les proporciona mayor movilidad.
Una consecuencia directa de la disposición irregular de las partículas en un sólido amorfo, es la diferencia de intensidad que toman las fuerzas intermoleculares entre las mismas, de ahí que la fusión se alcance a distintas temperaturas, según la proporción de las distintas partículas que forman la muestra. De ello se deduce que un sólido amorfo no tiene un punto de fusión definido, sino que dicha transformación acontece en un intervalo de temperatura. Cuando se calienta un sólido amorfo, la sustancia no manifiestan un punto de fusión, aunque se ablandan progresivamente aumentando su tendencia a deformarse. En contraste, la temperatura de fusión de un sólido cristalino es precisa y está bien definida. La distribución de los átomos y superficies de un sólido es variada, la distribución de los electrones provoca que las fuerzas de atracción o enlaces tengan algunas características de cada tipo de objeto.
En cuanto a sus propiedades elásticas, se puede afirmar que los sólidos amorfos manifiestan las propiedades de los cristales. Por ejemplo, al aplicar una carga a un material amorfo en un intervalo racionado de tiempo, la sustancia desarrollará una deformación pseudo-permanente, es decir, fluirá como si fuera un líquido de viscosidad muy alta.
Respecto al magnetismo, los metales amorfos presentan las propiedades magnéticas más notables, comportándose como materiales ferromagnéticos (aquellos en los que se produce un ordenamiento magnético de todos los momentos magnéticos en la misma dirección y sentido).
| Sustancia amorfa | Tipo de enlace | Tg (K) |
|---|---|---|
| SiO2 | covalente | 1430 |
| GeO2 | covalente | 820 |
| Si, Ge | metálico | - |
| Pd0.4 Ni0.4 P0.2 | iónico | 580 |
| BeF2 | covalente | 570 |
| Poliestireno | covalente | 370 |
| Se | covalente | 310 |
| Au0.8 Si0.2 | metálico | 290 |
| H2O | enlace de H | 140 |
| C2H5OH | enlace de H | 90 |
| Isopentano | Van der Waals | 65 |
| Fe, Co, Bi | metálico | - |
Aplicaciones
[editar]Debido a sus propiedades mecánicas, hay un gran número de sólidos amorfos que se emplean como materiales en la industria y la construcción.
Los óxidos amorfos, gracias a su transparencia, solidez y facilidad para darle forma en láminas grandes, se emplean profusamente como vidrio de ventana. Ciertos polímeros orgánicos, en virtud de su resistencia, peso ligero y fácil procesamiento, se emplean como materiales estructurales (plásticos). Existen semiconductores amorfos que se emplean en las memorias de ordenador y en células solares gracias a sus propiedades ópticas fotovoltaicas y en la facilidad para crear películas delgadas de gran superficie. Los metales amorfos se emplean en núcleos de transformadores gracias a su ferromagnetismo, bajas pérdidas y la posibilidad de formar cintas largas. El calcogenuro amorfo se emplea en xerografía en virtud de su fotoconductividad y la posibilidad de formar películas de gran área.
Diferencias con los sólidos cristalinos
[editar]La principal diferencia entre un sólido cristalino y un sólido amorfo es su estructura. En un sólido cristalino existe un orden de los átomos a largo alcance, mientras que en los sólidos amorfos no se puede predecir donde se encontrará el próximo átomo. En este hecho se basan los diferentes métodos de diferenciación entre ambos tipos de sólido, que en algunos casos no es fácil de establecer a simple vista. Dichos métodos de diferenciación incluyen:
Difracción
[editar]
La difracción consiste en enviar un haz de radiación sobre el sólido y tomar medidas a diferentes ángulos en un amplio rango angular, con el objetivo de deducir la disposición de los átomos en el sólido objeto de estudio. Los picos que aparecen en el diagrama de difracción (difractograma), corresponden a la diferencia constructiva del haz de radiación con un plano atómico, es decir, cuando se cumple la ley de Bragg (permite estudiar las direcciones en las que la difracción de rayos X sobre la superficie de un cristal produce interferencias constructivas).
Existen diferentes métodos de difracción, que dependen del tipo de sonda enviada hacia la muestra. Los tres tipos de sonda más utilizados en difracción son los rayos X, los de neutrones y los de electrones. Las diferencias entre ellos se establecen en la longitudes de onda y el mecanismo de interacción. De estos tres tipos de difracción, la más habitual para el estudio de los sólidos es la de rayos X.
En un sólido cristalino la disposición de sus átomos guarda una simetría. Por esa razón, su diagrama de difracción por rayos X muestra varios picos muy bien definidos a unos ángulos determinados. Con los datos de la intensidad y de la posición angular, así como las fórmulas de interacción entre rayos X y el sólido, se puede calcular la posición de los átomos en ese sólido.
En un sólido amorfo, los átomos están colocados al azar, debido a lo cual, en su diagrama de difracción se observan pocos picos, en general uno, que se caracteriza por una gran anchura angular. Analizando la anchura angular del pico junto con la intensidad y el tipo de interacción, se puede obtener la función de distribución radial, que da la distancia a primeros vecinos de encontrar un nuevo átomo.
Calorimetría
[editar]La calorimetría consiste en medir la cantidad de calor captado o cedido por el sólido estudiado en el momento de solidificación. En un sólido amorfo, la disposición irregular de sus átomos hace que posea una alta entropía (alto desorden) con respecto al sólido cristalino, que está perfectamente ordenado. A la hora de la cristalización, esta alta entropía hace que la variación de calor sea muy suave y por lo tanto esté muy extendido en un gran rango de temperaturas. Sin embargo, el calor específico del sólido cristalino durante la cristalización muestra un pico estrecho bien definido a una temperatura concreta, que corresponde a la temperatura de cristalización.
Obtención de sólidos amorfos
[editar]Los sólidos amorfos se pueden formar, en condiciones naturales, si crecen en condiciones donde no existe suficiente movilidad de los átomos. En el año 1969, David Turnbull escribió que "probablemente todos los materiales pueden, si se enfrían con la suficiente rapidez y lejanía de la temperatura crítica, ser trasformados en sólidos amorfos".[4]
Artificialmente, existen varios métodos de obtención de sólidos amorfos. El método más antiguo y más empleado es el de la fundición templada, del que se conocen algunas variedades:
Bloque congelado
[editar]Esta técnica necesita de un alto rango de temperaturas para el enfriamiento y formar una aleación metálica. Un chorro de metal fundido es propulsado contra la superficie de un cilindro de cobre, el cual se encuentra en rápida rotación, lo que obliga al líquido a enfriarse (a temperatura ambiente o menor). Dentro de la técnica del bloque congelado, se distingue entre splat-cooling y el templado giratorio de extracción.
Templado con líquido
[editar]Esta técnica puede ser utilizada para el enfriamiento de líquidos, utilizando baños de hielo en los cuales se introducen pequeñas cantidades de fundido; permite enfriar con rangos de velocidad altas.
Templado al aire
[editar]Esta técnica puede ser utilizada para materiales con tendencia a la formación de sólidos amorfos. Se puede obtener la fundición con enfriamiento lento, lo cual se consigue apagando el horno. Sólidos amorfos obtenidos mediante este método son SiO2, As2S3 y poliestireno.
Condensación del vapor
[editar]Esta técnica comienza cuando el vapor formado en una cámara de vacío, por la evaporación del material, choca con una superficie fría, obteniéndose una sustancia amorfa.
Polímeros
[editar]Los polímeros son compuestos macromoleculares de cadena larga, constituidos principalmente por carbono (C), hidrógeno (H) y oxígeno (O), aunque a veces pueden presentar F, N, P y S. Son resultado de la unión de monómeros mediante la unión de una reacción química llamada polimerización. La polimerización puede llevarse a cabo de forma natural, como sucede con las proteínas, o bien de forma artificial, obteniéndose materiales plásticos.
Estas macromoléculas pueden presentar muchas configuraciones y conformaciones. La configuración se refiere a diferencias estructurales de corto alcance y no se puede modificar de forma reversible. Los polímeros tienen estructuras poco compactas debido al enrollamiento de las cadenas y de la presencia de grupos atómicos laterales.
Todo lo que contribuye a un pobre empaquetamiento, favorece la formación de una estructura forma, por ejemplo, cadenas moleculares muy largas y ramificadas, distribución al azar de grupos laterales grandes a lo largo de las cadenas, cadenas copoliméricas (formadas por combinación de dos o más monómeros), así como la presencia de aditivos plastificantes que separan las cadenas unas de otras y se añaden a los plásticos para mejorar sus propiedades. Los polímeros, cuyos monómeros son ciertamente sencillos, desarrollan cierto grado de ordenamiento según como se han enfriado, pero no todo el material cristaliza.
Ejemplo de materiales plásticos parcialmente cristalinos son el polietileno, polipropileno isotáctico, nailon, y el politereftalato de etileno (PET).
Los materiales cambian sus propiedades mecánicas según se encuentren por encima o por debajo de la temperatura de reblandecimiento. Por encima, se deforman fácilmente al pasar de una a otra conformación, mientras que por debajo están fijos. En el material amorfo, las cadenas están más separadas que en la estructura laminar. Ello se refleja en una disminución de la densidad.
Según sus propiedades, se distinguen varios tipos de polímeros:
- Polímeros termoplásticos, que fluyen (pasan al estado líquido) al calentarlos y se vuelven a endurecer al enfriarlos. Su estructura molecular presenta pocos (o ningún) entrecruzamiento.
- Polímeros termoestables, que no fluyen, y lo único que se consigue al calentarlos es que se descompongan químicamente. Este comportamiento se debe a una estructura con muchos entrecruzamientos, que impiden los desplazamientos relativos de las moléculas
- Elastómeros, que muestran un comportamiento elástico. Suelen ser termoestables, pero también termoplásticos debido a que el enlace covalente proporciona la capacidad de que los monómeros vuelvan a la posición original una vez se deja de aplicar la fuerza
- Polímeros expandidos (espumas). Se caracterizan por ser porosos y tener baja densidad. Se obtienen por dispersión de un gas en un polímero antes de que se endurezca, bien sea termoestable o termoplástico.
Vidrio
[editar]El vidrio es un sólido amorfo con la estructura de un líquido. Técnicamente, un vidrio es un producto inorgánico de la fusión que se ha enfriado a una velocidad demasiado elevada para permitir la formación de cristales.
Aunque popularmente se llama cristal y vidrio a un mismo material, existe una diferencia esencial entre ambos. El cristal hace referencia a un estado de ordenación de la materia que se encuentra en la naturaleza en diferentes formas (por ejemplo, cuarzo o cristal de roca). El vidrio, sin embargo, es el resultado de la fusión de ciertos ingredientes (sílice, sosa y cal). Existen, sin embargo, vidrios creados por la naturaleza, como la obsidiana que se forma por el calor generado en el interior de los volcanes. Se llama erróneamente cristal al vidrio de plomo o vidrio óptico, pues su transparencia imita al cristal de roca natural; esta imitación había sido siempre la meta principal de los vidrieros.
La transición vítreo-líquido, o transición vítrea, es la transición gradual y reversible en materiales amorfos (o en regiones amorfas dentro de materiales semicristalinos), desde un estado "vítreo" duro y relativamente quebradizo a un estado viscoso o gomoso a medida que aumenta la temperatura.[5] Un sólido amorfo con una transición vítrea se denomina vidrio. La transición vítrea se considera uno de los problemas más importantes y no resueltos de la física.
La transición inversa, que se logra al enfriar un líquido viscoso al estado de vidrio, se denomina vitrificación.
Materiales nanoestructurados
[editar]Los materiales amorfos tendrán cierto grado de orden de corto alcance en la escala de longitud atómica debido a la naturaleza del enlace químico intermolecular. Además, en cristales muy pequeños, el orden de corto alcance abarca una gran fracción de los átomos; sin embargo, la relajación en la superficie, junto con los efectos interfaciales, distorsiona las posiciones atómicas y disminuye el orden estructural. Incluso las técnicas de caracterización estructural más avanzadas, como la difracción de rayos X y la microscopía electrónica de transmisión, tienen dificultades para distinguir estructuras amorfas y cristalinas en escalas de longitud corta.[6]
Caracterización de sólidos amorfos
[editar]Debido a la falta de orden de largo alcance, las técnicas cristalográficas estándar suelen ser inadecuadas para determinar la estructura de los sólidos amorfos.[7] Se han utilizado diversas técnicas basadas en electrones, rayos X y computación para caracterizar materiales amorfos. El análisis multimodal es muy común para materiales amorfos.
Entre los métodos que se pueden citar están:
- Difracción de rayos X y neutrones
- Espectroscopia de rayos X
- Tomografía electrónica atómica
- Microscopía electrónica de fluctuación
- Técnicas computacionales
Véase también
[editar]Referencias
[editar]- ↑ Mavračić, Juraj; Mocanu, Felix C.; Deringer, Volker L.; Csányi, Gábor; Elliott, Stephen R. (2018). «Similarity Between Amorphous and Crystalline Phases: The Case of TiO2». J. Phys. Chem. Lett. 9 (11): 2985-2990. PMID 29763315. doi:10.1021/acs.jpclett.8b01067.
- ↑ Thorpe., M.F.; Tichy, L. (2001). Properties and Applications of Amorphous Materials (1st edición). Springer Dordrecht. pp. 1-11. ISBN 978-0-7923-6811-3.
- ↑ Zaccone, A. (2023). Theory of Disordered Solids (1st edición). Springer. ISBN 978-3-031-24705-7. doi:10.1007/978-3-031-24706-4.
- ↑ D. Turnbull, "Under what conditions can a glass be formed?," Contemporary Physics 10:473-488 (1969)
- ↑ ISO 11357-2: Plásticos – Calorimetría de barrido diferencial – Parte 2: Determinación de temperatura de transición del vaso (1999).
- ↑ Goldstein, Joseph I.; Newbury, Dale E.; Michael, Joseph R.; Ritchie, Nicholas W. M.; Scott, John Henry J.; Joy, David C. (2018). Scanning Electron Microscopy and X-ray Microanalysis (Fourth edición). New York, NY. ISBN 978-1493966745.
- ↑ Yang, Yao; Zhou, Jihan; Zhu, Fan; Yuan, Yakun; Chang, Dillan J.; Kim, Dennis S.; Pham, Minh; Rana, Arjun; Tian, Xuezeng; Yao, Yonggang; Osher, Stanley J.; Schmid, Andreas K.; Hu, Liangbing; Ercius, Peter; Miao, Jianwei (31 de marzo de 2021). «Determining the three-dimensional atomic structure of an amorphous solid». Nature (en inglés) 592 (7852): 60-64. Bibcode:2021Natur.592...60Y. ISSN 1476-4687. PMID 33790443. S2CID 214802235. arXiv:2004.02266. doi:10.1038/s41586-021-03354-0.


 French
French Deutsch
Deutsch