آنفلوانزا - ویکیپدیا، دانشنامهٔ آزاد
| آنفلوآنزا | |
|---|---|
| نامهای دیگر | flu, grippe |
 | |
| ویروس آنفلوآنزا | |
| تخصص | بیماریهای عفونی |
| نشانهها | تب، آبریزش بینی، گلودرد، درد عضلانی، سردرد، سرفه، خستگی |
| دورهٔ معمول آغاز | ۱–۴ روز پس از تماس |
| دورهٔ بیماری | ۲–۸ روز |
| علت | ویروسهای آنفلوآنزا |
| پیشگیری | شستن دستها، واکسن آنفلوانزا |
| دارو | داروهای ضدویروسی مانند اسلتامیویر |
| فراوانی | ۳ تا ۵ میلیون مورد شدید در سال[۱][۲] |
| مرگها | بیش از ۲۹۰ هزار تا ۶۵۰ هزار مرگ در سال[۳][۴] |
| طبقهبندی و منابع بیرونی | |
| پیشنت پلاس | آنفلوآنزا |
آنفلوآنزا (انگلیسی: Influenza) یک بیماری عفونی است که توسط ویروسهای آنفلوآنزا ایجاد میشود. علائم از خفیف تا شدید متغیر است و اغلب شامل تب، آبریزش بینی، گلودرد، درد عضلانی، سردرد، سرفه و خستگی است. این علائم یک تا چهار (معمولاً دو) روز پس از قرار گرفتن در معرض ویروس شروع شده و حدود دو تا هشت روز طول میکشد. اسهال و استفراغ به خصوص در کودکان ممکن است رخ دهد. آنفلوآنزا ممکن است به پنومونی (pneumonia) ویروسی یا عفونت باکتریایی بعدی تبدیل شود. سایر عوارض عبارتند از سندرم دیسترس تنفسی حاد، مننژیت، آنسفالیت و بدتر شدن مشکلات سلامتی زمینهای مانند آسم و بیماریهای قلبی عروقی.
چهار نوع ویروس آنفلوآنزا وجود دارد: A, B، C و D. پرندگان آبزی منبع اولیه ویروس آنفلوآنزای A (Influenza A virus; IAV) هستند که در پستانداران مختلف از جمله انسان و خوک نیز گسترده است. ویروس آنفلوآنزای B (Influenza B virus; IBV) و ویروس آنفلوآنزای C (Influenza C virus; ICV) در درجهٔ اول انسان را آلوده میکنند و ویروس آنفلوآنزای D (Influenza D virus; IDV) در گاو و خوک یافت میشود. IAV و IBV در انسان گردش کرده و باعث اپیدمیهای فصلی میشوند و ICV باعث عفونت خفیف، عمدتاً در کودکان میشود. IDV میتواند انسان را آلوده کند اما مشخص نیست که باعث بیماری شود. در انسان، ویروس آنفلوآنزا در درجه اول از طریق قطرات تنفسی ناشی از سرفه و عطسه منتقل میشود. انتقال از طریق ذرات معلق در هوا و سطوح آلوده به ویروس نیز رخ میدهد.
شستن مکرر دستها و پوشاندن دهان و بینی هنگام سرفه و عطسه باعث کاهش انتقال میشود. واکسیناسیون سالانه میتواند به محافظت در برابر آنفلوآنزا کمک کند. ویروسهای آنفلوآنزا، به ویژه IAV، به سرعت تکامل مییابند، بنابراین واکسنهای آنفلوآنزا بهطور منظم بهروز میشوند تا با گونههای آنفلوآنزا که در گردش هستند، منطبق شوند. واکسنها در برابر زیرگروههای IAV H1N1 و H3N2 و یک یا دو زیرگروه IBV ایمنی ایجاد میکنند. عفونت آنفلوآنزا با روشهای آزمایشگاهی مانند آزمایش آنتیبادی یا آنتیژن و واکنش زنجیرهای پلیمراز (polymerase chain reaction; PCR) برای شناسایی اسید نوکلئیک ویروسی تشخیص داده میشود. این بیماری را میتوان با اقدامات حمایتی و در موارد شدید با داروهای ضد ویروسی مانند اسلتامیویر (oseltamivir) درمان کرد. در افراد سالم، آنفلوآنزا بهطور معمول خود محدود شونده و به ندرت کشنده است، اما در گروههای پرخطر میتواند کشنده باشد.
در یک سال معمولی، ۵ تا ۱۵ درصد از جمعیت به آنفلوآنزا مبتلا میشوند. سالانه سه تا پنج میلیون مورد شدید وجود دارد که سالانه بالغ بر ۶۵۰۰۰۰ مرگ ناشی از تنفس در سراسر جهان رخ میدهد. مرگ و میرها بیشتر در گروههای پرخطر، از جمله کودکان خردسال، سالمندان و افراد مبتلا به بیماریهای مزمن رخ میدهد. در مناطق معتدل جهان، تعداد موارد آنفلوآنزا در زمستان به اوج خود میرسد، در حالی که در مناطق گرمسیری، آنفلوآنزا میتواند در تمام طول سال رخ دهد. از اواخر دهه ۱۸۰۰، هر ۱۰ تا ۵۰ سال یکبار شیوع بزرگی از سویههای جدید آنفلوآنزا که در سطح جهانی گسترش مییابند و به نام پاندمی شناخته میشوند، رخ میدهد. از سال ۱۹۰۰ پنج پاندمی آنفلوآنزا رخ داده است: آنفلوآنزای اسپانیایی از ۱۹۱۸ تا ۱۹۲۰، که شدیدترین آنها بود؛ آنفلوآنزای آسیایی در سال ۱۹۵۷؛ آنفلوآنزای هنگ کنگ در سال ۱۹۶۸؛ آنفلوآنزای روسیه در سال ۱۹۷۷؛ و پاندمی آنفلوآنزای خوکی در سال ۲۰۰۹.
علائم و نشانهها
[ویرایش]
علائم آنفلوآنزا شبیه علائم سرماخوردگی است، اگرچه معمولاً شدیدتر است و احتمال آبریزش بینی کمتر است.[۸][۹] فاصلهٔ زمانی بین قرار گرفتن در معرض ویروس و بروز علائم (دوره کمون) یک تا چهار روز بوده که معمولاً یک تا دو روز است. بسیاری از عفونتها بدون علامت هستند.[۱۰] شروع علائم ناگهانی است و علائم اولیه عمدتاً غیراختصاصی، شامل تب، لرز، سردرد، درد عضلانی، بی حالی، از دست دادن اشتها، کمبود انرژی و گیجی هستند. این علائم معمولاً با علائم تنفسی مانند سرفه خشک، گلودرد یا خشکی گلو، صدای خشن و گرفتگی یا آبریزش بینی همراه است. سرفه شایعترین علامت است.[۱] علائم گوارشی، از جمله تهوع، استفراغ، اسهال،[۱۱] و گاستروانتریت،[۱۲] به ویژه در کودکان نیز ممکن است رخ دهد. علائم استاندارد آنفلوآنزا معمولاً دو تا هشت روز طول میکشد.[۱۳] مطالعهای در سال ۲۰۲۱ نشان میدهد که آنفلوآنزا میتواند علائم طولانیمدتی مشابه کووید طولانی ایجاد کند.[۱۴]
عفونتهای علامتدار معمولاً خفیف و محدود به دستگاه تنفسی فوقانی هستند، اما پیشرفت به پنومونی نسبتاً شایع است. پنومونی ممکن است در اثر عفونت ویروسی اولیه یا عفونت باکتریایی ثانویه ایجاد شود. پنومونی اولیه با پیشرفت سریع تب، سرفه، تنفس سخت و سطوح پایین اکسیژن که باعث آبی شدن پوست شده، مشخص میشود. این بیماری به ویژه در میان کسانی که یک بیماری قلبی عروقی زمینهای مانند بیماری روماتیسمی قلب دارند، شایع است. پنومونی ثانویه معمولاً یک دوره بهبود علائم را برای یک تا سه هفته دارد[۱۵] و به دنبال آن تب مکرر، تولید خلط و تجمع مایع در ریهها[۱] رخ داده، اما میتواند تنها چند روز پس از ظاهر شدن علائم آنفلوآنزا نیز رخ دهد.[۱۵] حدود یک سوم موارد پنومونی اولیه با پنومونی ثانویه همراه میشود که اغلب توسط باکتریهای استرپتوکوکوس پنومونیه و استافیلوکوکوس اورئوس ایجاد میشوند.[۱][۱۰]
ویروسشناسی
[ویرایش]انواع ویروس
[ویرایش]
ویروسهای آنفلوآنزا از چهار گونه تشکیل شدهاند که هر کدام تنها عضو جنس خود هستند. چهار جنس آنفلوآنزا شامل چهار جنس از هفت جنس در خانواده Orthomyxoviridae است. آنها عبارتند از:[۱][۱۶]
- ویروس آنفلوآنزای A (IAV)، جنس Alphainfluenzavirus
- ویروس آنفلوآنزای B (IBV)، جنس Betainfluenzavirus
- ویروس آنفلوآنزای C (ICV)، جنس Gammainfluenzavirus
- ویروس آنفلوآنزای D (IDV)، جنس Deltainfluenzavirus
IAV مسئول اکثر موارد بیماری شدید و همچنین اپیدمیهای فصلی و پاندمیهای گاهبهگاه است. این بیماری افراد در هر سنی را مبتلا میکند، اما بهطور نامتناسبی باعث ایجاد بیماری شدید در افراد مسن، افراد بسیار جوان و کسانی که مشکلات سلامتی مزمن دارند، میشود. پرندگان مخزن اولیه IAV هستند، به ویژه پرندگان آبزی مانند اردک، غاز، پرندگان ساحلی و مرغ دریایی،[۱۷][۱۸] اما ویروس در بین پستانداران از جمله خوک، اسب و پستانداران دریایی نیز در گردش است. IAV بر اساس پروتئینهای ویروسی هماگلوتینین (H) و نورآمینیداز (N) به زیرگروههایی طبقهبندی میشود.[۱۹] تا سال ۲۰۱۹، ۱۸ زیرگروه H و ۱۱ زیرگروه N شناسایی شده است. بیشتر ترکیبات بالقوه در پرندگان گزارش شده است، اما H17-18 و N10-11 فقط در خفاشها یافت شده است. تنها زیرگروههای H شامل H1-3 و N شامل زیرگروههای N1-2 شناخته شدهاند که در انسانها در گردش هستند.[۱۹] زیرگروههای IAV در گردش از سال ۲۰۱۸، H1N1 و H3N2 هستند.[۲] IAV را میتوان به طور خاص بر اساس گونههای میزبان طبیعی، منشأ جغرافیایی، سال جداسازی و تعداد سویه، مانند H1N1/A/duck/Alberta/35/76 طبقهبندی کرد.[۱][۱۱]
IBV عمدتاً انسانها را آلوده میکند اما در فکها، اسبها، سگها و خوکها نیز شناسایی شده است.[۱۹] IBV زیرمجموعههایی مانند IAV ندارد، اما دارای دو دودمان متمایز از نظر آنتیژنی است که دودمانهای شبه B/Victoria/2/1987 و شبه[۱] B/Yamagata/16/1988، یا به سادگی شبه (B/)Victoria و شبه (B/)Yamagata نامیده میشوند.[۲][۱۹] هر دو دودمان در انسانها در گردش بوده[۱] و با نسبتهای متفاوتی بر کودکان تأثیر میگذارند.[۱۱] IBVها در کنار IAVها به همهگیریهای فصلی کمک میکنند اما هرگز با یک پاندمی مرتبط نبودهاند.[۱۹]
ICV، مانند IBV، عمدتاً در انسان یافت میشود، اگرچه در خوکها، سگهای وحشی، شترهای یککوهانه، گاو و سگ نیز دیده شده است.[۱۲][۱۹] عفونت ICV در درجه اول کودکان را تحت تأثیر قرار داده و معمولاً بدون علامت است[۱][۱۱] یا علائم خفیف شبیه سرماخوردگی دارد، اگرچه علائم شدیدتری مانند گاستروانتریت و پنومونی ممکن است رخ دهد.[۱۲] برخلاف IAV و IBV, ICV کانون اصلی تحقیقات مربوط به داروهای ضد ویروسی، واکسنها و سایر اقدامات علیه آنفلوآنزا نبوده است.[۱۹] ICV به شش دودمان ژنتیکی/آنتیژنی طبقهبندی میشود.[۱۲][۲۰]
IDV از خوکها و گاوها جدا شده که دومی مخزن طبیعی است. همچنین، عفونت در انسان، اسب، شتر یککوهانه و نشخوارکنندگان کوچک مانند بز و گوسفند مشاهده شده است.[۱۹][۲۰] ارتباط دور با ICV دارد. در حالی که کسانی که با گاوها کار میکنند گاهیً آزمایش عفونت قبلی IDV مثبت داشتهاند، مشخص نیست که این عفونت در انسان ایجاد بیماری کند.[۱][۱۱][۱۲] ICV و IDV نسبت به IAV و IBV سرعت تکامل آنتیژنی کمتری را تجربه میکنند. به دلیل این ثبات آنتیژنی، دودمانهای جدید نسبتاً کمی پدیدار میشوند.[۲۰]
ژنوم و ساختار
[ویرایش]
ویروسهای آنفلوآنزا دارای یک ژنوم آرانای تک رشتهای با سنس منفی هستند که قطعه بندی شده است. سنس منفی ژنوم به این معنی است که میتوان از آن به عنوان الگویی برای تولید آرانای پیامرسان (messenger RNA; mRNA) استفاده کرد.[۱۰] IAV و IBV دارای هشت بخش ژنومی هستند که ۱۰ پروتئین اصلی را کد میکنند. ICV و IDV دارای هفت بخش ژنومی هستند که نه پروتئین اصلی را کد میکنند.[۱۲] سه بخش، سه زیرواحد از یک کمپلکس آرانای پلیمراز وابسته به آرانای (RdRp) را رمزگذاری میکنند: PB1، یک رونوشت، PB2، که 5' caps را تشخیص میدهد، و PA (P3 برای ICV و IDV)، یک اندونوکلئاز.[۲۱] پروتئین ماتریکس (M1) و پروتئین غشایی (M2) مانند پروتئین غیر ساختاری (NS1) و پروتئین صادراتی هسته ای (NEP) یک بخش مشترک دارند.[۱] برای IAV و IBV، هماگلوتینین (HA) و نورآمینیداز (NA) هر کدام در یک بخش کدگذاری میشوند، در حالی که ICV و IDV یک پروتئین همجوشی هماگلوتینین استراز (HEF) را در یک بخش رمزگذاری میکنند که عملکردهای HA و NA را ادغام میکند. بخش نهایی ژنوم، نوکلئوپروتئین ویروسی (NP) را کد میکند.[۲۱] ویروسهای آنفلوآنزا همچنین پروتئینهای جانبی مختلفی مانند PB1-F2 و PA-X را کد میکنند که از طریق جایگزین فریمهای خواندن باز (open reading frames) بیان میشوند[۱][۲۲] و در سرکوب دفاعی میزبان، ویرولانس و بیماریزایی مهم هستند.[۲۳]
ذره ویروس که ویریون نامیده میشود، پلئومورفیک است و دارای شکلهای متفاوتی مانند رشتهای، میلهای یا کروی است. ایزولههای بالینی تمایل به پلئومورفیک دارند، در حالی که سویههای سازگار با رشد آزمایشگاهی بهطور معمول ویریونهای کروی تولید میکنند. ویریونهای رشتهای حدود ۲۵۰ نانومتر در ۸۰ نانومتر، باسیل ۱۲۰–۲۵۰ در ۹۵ نانومتر و کروی به قطر ۱۲۰ نانومتر هستند.[۲۴] ویریون شامل هر بخش از ژنوم متصل به نوکلئوپروتئینها در کمپلکسهای ریبونوکلئوپروتئین (RNP) جداگانه برای هر بخش است که همهٔ آنها توسط یک غشای دولایهٔ لیپیدی به نام پوشش ویروسی احاطه شدهاند. یک کپی از RdRp وجود دارد که همه زیرواحدها شامل هر RNP هستند. پوشش از نظر ساختاری توسط پروتئینهای ماتریسی در داخل که RNPs را در بر میگیرد، تقویت شده[۳] و پوشش حاوی پروتئینهای HA و NA (یا HEF)[۲۰] است که از سطح بیرونی پوشش به سمت خارج گسترش مییابند. پروتئینهای HA و[۲۰] HEF ساختار «سر» و «پایه» مشخصی دارند. پروتئینهای M2 کانالهای یونی پروتون را از طریق پوشش ویروسی تشکیل میدهند که برای ورود و خروج ویروس لازم است. IBVها حاوی پروتئین سطحی به نام NB هستند که در پوشش لنگر انداخته است، اما عملکرد آن ناشناخته است.[۱]
چرخهٔ زندگی
[ویرایش]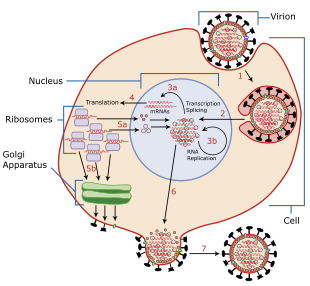
چرخهٔ زندگی ویروسی با اتصال به سلول هدف آغاز میشود. اتصال توسط پروتئینهای HA ویروسی در سطح پوشش انجام میشود که به سلولهای حاوی گیرندههای اسید سیالیک در سطح غشای سلولی متصل میشوند.[۱][۳][۱۷] برای زیرگروههای N1 با جهش "G147R" و زیرگروههای N2، پروتئین NA میتواند ورود را آغاز کند. قبل از اتصال، پروتئینهای NA با تخریب مخاط، دسترسی به سلولهای هدف را افزایش میدهند که به حذف گیرندههای فریب خارج سلولی که دسترسی به سلولهای هدف را مختل میکنند، کمک میکند.[۳] پس از اتصال، ویروس توسط یک آندوزوم که حاوی ویریون درون آن است، وارد سلول میشود. آندوزوم توسط vATPase سلولی[۲۲] اسیدی شده تا pH پایینتری داشته باشد که باعث ایجاد یک تغییر ساختاری در HA شده که اجازه میدهد پوشش ویروسی با غشای آندوزوم ترکیب شود.[۲۳] در همان زمان، یونهای هیدروژن از طریق کانالهای یونی M2 به داخل ویریون منتشر میشوند و برهمکنشهای داخلی پروتئین-پروتئین را مختل میکنند تا RNPها را در سیتوزول سلول میزبان آزاد کنند. پوسته پروتئین M1 احاطه کننده RNPها تخریب شده و RNPها را بهطور کامل در سیتوزول جدا میکند.[۳][۲۲]
سپس RNPها با کمک سیگنالهای موضعی ویروسی به هسته وارد میشوند. در آنجا، آرانای پلیمراز ویروسی با استفاده از رشته سنس منفی ژنومی به عنوان یک الگو، mRNA را رونویسی میکند. پلیمراز کلاهکهای ۵' را برای mRNA ویروسی از آرانای سلولی به سنتز mRNA اولیه میرباید و انتهای 3' mRNA در پایان رونویسی پلی آدنیله میشود.[۲۱] هنگامی که mRNA ویروس رونویسی شد، از هسته خارج شده و توسط ریبوزومهای میزبان به روشی وابسته به کلاهک برای سنتز پروتئینهای ویروسی ترجمه میشود.[۲۲] RdRp، همچنین رشتههای سنس مثبت مکمل ژنوم ویروسی را در یک کمپلکس مکمل RNP سنتز کرده که سپس به عنوان الگو توسط پلیمرازهای ویروسی برای سنتز کپیهایی از ژنوم سنس منفی استفاده میشود.[۱][۳] در طی این فرایندها، RdRps ویروسهای آنفلوانزای پرندگان (avian influenza viruses; AIVs) در دمای بالاتر نسبت به ویروسهای آنفلوانزای پستانداران بهطور بهینه عمل میکنند.[۱۳]
زیرواحدهای پلیمراز ویروسی جدید سنتز شده و پروتئینهای NP به هسته وارد میشوند تا سرعت تکثیر ویروس را بیشتر کنند و RNPها را تشکیل دهند.[۲۱] پروتئینهای HA, NA و M2 با کمک پروتئینهای M1 و[۲۳] NEP از طریق جسم گلژی[۲۱] به غشای سلولی منتقل شده و به آن وارد میشوند. پروتئینهای غیر ساختاری ویروسی از جمله NS1، PB1-F2، و PA-X فرایندهای سلولی میزبان را تنظیم میکنند تا پاسخهای ضد ویروسی را غیرفعال کنند.[۱][۳][۲۳] PB1-F2 همچنین با PB1 تعامل دارد تا پلیمرازها را برای مدت طولانیتری در هسته نگه دارد.[۱۸] پروتئینهای M1 و NEP در مراحل بعدی عفونت در هسته قرار میگیرند، به RNPهای ویروسی متصل میشوند و واسطه بیرون رفتن آنها به سیتوپلاسم هستند، جایی که با کمک آندوزومهای بازیافتی به غشای سلولی مهاجرت میکنند و در بخشهای ژنوم قرار میگیرند.[۱][۳]
ویروسهای حاصل با جوانه زدن از غشای سلولی که با تجمع پروتئینهای M1 در سمت سیتوپلاسمی غشاء آغاز میشود، سلول را ترک میکنند. ژنوم ویروسی درون یک پوشش ویروسی مشتق شده از بخشهایی از غشای سلولی که دارای پروتئینهای HA, NA و M2 هستند، گنجانده شده است. در پایان جوانه زدن، پروتئینهای HA به اسید سیالیک سلولی متصل میمانند تا زمانی که توسط فعالیت سیالیداز، پروتئینهای NA بریده شوند. سپس ویریون از سلول آزاد میشود. فعالیت سیالیداز NA همچنین هر گونه باقیمانده اسید سیالیک را از سطح ویروس جدا کرده که به جلوگیری از تجمع ویروسهای تازه ترکیب شده در نزدیکی سطح سلول و بهبود عفونتزایی کمک میکند.[۱][۳] مشابه دیگر جنبههای تکثیر آنفلوآنزا، فعالیت بهینهٔ NA وابسته به دما و pH است.[۱۳] در نهایت، وجود مقادیر زیادی از آرانای ویروسی در سلول باعث آپوپتوز (مرگ برنامهریزی شده سلولی) شده که توسط عوامل سلولی برای محدود کردن تکثیر ویروس آغاز میشود.[۲۲]
شیفت و دریفت آنتیژنی
[ویرایش]
دو فرایند کلیدی که ویروسهای آنفلوآنزا از طریق آنها تکامل مییابند، دریفت آنتیژنی و شیفت آنتیژنی هستند. دریفت آنتیژنی زمانی است که آنتیژنهای ویروس آنفلوآنزا به دلیل تجمع تدریجی جهش در ژن آنتیژن (HA یا NA) تغییر میکند.[۱۷] این میتواند در پاسخ به فشار تکاملی اعمال شده توسط پاسخ ایمنی میزبان رخ دهد. دریفت آنتیژنی به ویژه برای پروتئین HA رایج است که در آن فقط چند تغییر اسید آمینه در ناحیه سر میتواند باعث ایجاد دریفت آنتیژنی شود.[۲][۲۰] نتیجهٔ آن، تولید سویههای جدیدی است که میتوانند از ایمنی ناشی از آنتیبادی از قبل موجود فرار کنند.[۱][۱۱] دریفت آنتیژنی در تمام گونههای آنفلوآنزا رخ میدهد، اما در B کندتر از A و در C و D کندترین است.[۲۰] دریفت آنتیژنی عامل اصلی آنفلوآنزای فصلی است[۲۶] و مستلزم آن است که واکسنهای آنفلوآنزا سالانه به روز شوند. HA جزء اصلی واکسنهای غیرفعال است، بنابراین، پایشها، بر دریفت آنتیژنی این آنتیژن در میان سویههای در حال گردش، نظارت میکنند. به نظر میرسد تکامل آنتیژنی ویروسهای آنفلوآنزای انسان سریعتر از ویروسهای آنفلوآنزا در خوک و اسب است. در پرندگان وحشی، تنوع آنتیژنی درون زیرگروهی محدود به نظر میرسد اما در ماکیان مشاهده شده است.[۱][۱۱]
شیفت آنتیژنی تغییر ناگهانی و شدید در آنتیژن ویروس آنفلوآنزا، معمولاً HA، است. در طول شیفت آنتیژنی، سویههای مختلف آنتیژنی که سلول یکسانی را آلوده میکنند، میتوانند بخشهای ژنوم را با یکدیگر ترکیب کنند و نتاج هیبریدی تولید کنند. از آنجایی که همهٔ ویروسهای آنفلوآنزا دارای ژنوم تقسیمبندی شدهاند، همه قادر به دستهبندی مجدد هستند.[۱۲][۲۰] با این حال، شیفت آنتیژنی فقط در بین ویروسهای آنفلوآنزا از همان جنس رخ میدهد[۲۱] و بیشتر در بین IAVها رخ میدهد. بهطور خاص، دستهبندی مجدد در AIVها بسیار رایج است و تنوع زیادی از ویروسهای آنفلوآنزا را در پرندگان ایجاد میکند، اما در دودمان انسان، اسب و سگ غیر معمول است.[۲۷] خوکها، خفاشها و بلدرچینها گیرندههایی برای IAVهای پستانداران و پرندگان دارند، بنابراین آنها «رگهای اختلاط» ("mixing vessels") بالقوه برای دستهبندی مجدد هستند.[۱۹] اگر سویهٔ حیوانی با سویهٔ انسانی مجدداً ترکیب شود،[۲] آنگاه یک سویهٔ جدید میتواند پدیدار شود که قابلیت انتقال از انسان به انسان را داشته باشد. این امر باعث ایجاد پاندمیها شده است، اما فقط تعداد محدودی داشتهاند، بنابراین پیشبینی زمان بعدی دشوار است.[۱][۱۱]
سازوکار
[ویرایش]انتقال
[ویرایش]افرادی که آلوده میشوند میتوانند ویروس آنفلوآنزا را از طریق تنفس، صحبت کردن، سرفه و عطسه منتقل کنند که قطرات تنفسی و آئروسلهای حاوی ذرات ویروس را در هوا پخش میکند. یک فرد مستعد ابتلا به عفونت میتواند با تماس با این ذرات به آنفلوآنزا مبتلا شود.[۱۵][۲۸] قطرات تنفسی نسبتاً بزرگ هستند و کمتر از دو متر قبل از سقوط بر روی سطوح مجاور حرکت میکنند. ذرات معلق در هوا کوچکتر هستند و مدت بیشتری در هوا معلق میمانند، بنابراین فرود آمدن آنها بیشتر طول کشیده و میتوانند بیشتر از قطرات تنفسی حرکت کنند.[۴][۲۸] استنشاق ذرات معلق در هوا میتواند منجر به عفونت شود،[۲۹] اما بیشتر انتقال در ناحیه حدود دو متری اطراف فرد آلوده از طریق قطرات تنفسی[۱۰] است که با مخاط دستگاه تنفسی فوقانی تماس دارند.[۲۹] انتقال از طریق تماس با یک فرد، مایعات بدن، یا اشیاء میانی (فومیتها) نیز ممکن است رخ دهد،[۱۰][۲۸] زیرا ویروسهای آنفلوآنزا میتوانند ساعتها بر روی سطوح غیر متخلخل زنده بمانند[۴] اگر دستهای فرد آلوده باشد، دست زدن به صورت میتواند باعث عفونت شود.[۳۰]
آنفلوآنزا معمولاً از یک روز قبل از شروع علائم تا ۵ تا ۷ روز پس از آن قابل انتقال است.[۱۱] در بزرگسالان سالم، ویروس تا ۳ تا ۵ روز از بین میرود. در کودکان و افراد دچار نقص ایمنی، ویروس ممکن است برای چند هفته قابل انتقال باشد.[۱۰] کودکان ۲ تا ۱۷ ساله به عنوان اصلیترین و کارآمدترین ناقلان آنفلوآنزا در نظر گرفته میشوند.[۱][۱۱] کودکانی که قبلاً چندین بار در معرض ویروسهای آنفلوآنزا قرار نگرفتهاند، ویروس را در مقادیر بیشتر و برای مدت طولانیتری نسبت به سایر کودکان پخش میکنند.[۱] افرادی که در معرض خطر قرار گرفتن در معرض آنفلوآنزا هستند عبارتند از کارکنان مراقبتهای بهداشتی، کارکنان مراقبتهای اجتماعی و کسانی که با افراد آسیبپذیر به آنفلوآنزا زندگی کرده یا از آنها مراقبت میکنند. در مراکز مراقبت طولانی مدت، آنفلوآنزا میتواند پس از ورود، به سرعت گسترش یابد.[۱۱] عوامل مختلفی به احتمال زیاد انتقال آنفلوآنزا را تقویت میکنند، از جمله دمای پایینتر، رطوبت مطلق و نسبی کمتر، تابش اشعهٔ فرابنفش کمتر از خورشید[۲۹][۳۱] و ازدحام.[۲۸] ویروسهای آنفلوآنزا مانند H1N1 که دستگاه تنفسی فوقانی را آلوده میکنند، خفیفتر اما قابل انتقالتر هستند، در حالی که ویروسهایی مانند H5N1 که دستگاه تنفسی تحتانی را آلوده میکنند، معمولاً باعث بیماری شدیدتر میشوند اما کمتر مسری هستند.[۱۰]
پاتوفیزیولوژی
[ویرایش]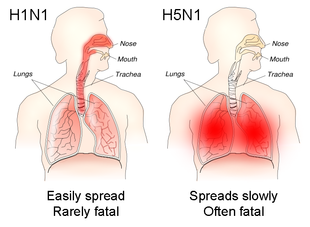
در انسان، ویروسهای آنفلوآنزا ابتدا با آلوده کردن سلولهای اپیتلیال در دستگاه تنفسی باعث عفونت میشوند. بیماری در حین عفونت در درجه اول نتیجه التهاب ریه و به خطر افتادن ناشی از عفونت و مرگ سلولهای اپیتلیال، همراه با التهاب ناشی از پاسخ سیستم ایمنی به عفونت است. اندامهای غیر تنفسی ممکن است درگیر شوند، اما مکانیسمهای درگیر شدن آنفلوآنزا در این موارد ناشناخته است. بیماری شدید تنفسی میتواند توسط مکانیسمهای متعدد و غیر انحصاری، از جمله انسداد راههای هوایی، از دست دادن ساختار آلوئولی، از دست دادن یکپارچگی اپیتلیال ریه به دلیل عفونت و مرگ سلولهای اپیتلیال و تخریب ماتریکس خارج سلولی که ساختار ریه را حفظ میکند، ایجاد شود. بهطور خاص، عفونت سلول آلوئول به نظر میرسد علائم شدیدی را ایجاد میکند زیرا این امر، منجر به اختلال در تبادل گاز شده و ویروسها را قادر میسازد تا سلولهای اندوتلیال را که مقادیر زیادی سیتوکینهای پیش التهابی تولید میکنند را آلوده کنند.[۱۵]
پنومونی ناشی از ویروسهای آنفلوآنزا با سطوح بالایی از تکثیر ویروسی در دستگاه تنفسی تحتانی مشخص شده که با یک پاسخ پیش التهابی قوی به نام طوفان سیتوکینی همراه است.[۱] عفونت با H5N1 یا H7N9 به ویژه سطوح بالایی از سیتوکینهای پیش التهابی را تولید میکند.[۱۷] در عفونتهای باکتریایی، تخلیه زودهنگام ماکروفاژها در طول آنفلوآنزا، محیط مساعدی را در ریهها برای رشد باکتری ایجاد میکند، زیرا این گلبولهای سفید در پاسخ به عفونت باکتریایی مهم هستند. مکانیسمهای میزبان برای تشویق ترمیم بافت ممکن است بهطور ناخواسته اجازه عفونت باکتریایی را بدهد. عفونت همچنین باعث تولید گلوکوکورتیکوئیدهای سیستمیک میشود که میتوانند التهاب را برای حفظ یکپارچگی بافت کاهش دهند، اما رشد باکتری را افزایش دهند.[۱۵]
پاتوفیزیولوژی آنفلوآنزا بهطور قابل توجهی تحت تأثیر گیرندههایی است که ویروسهای آنفلوآنزا در طول ورود به سلولها به آنها متصل میشوند. ویروسهای آنفلوآنزای پستانداران ترجیحاً به اسیدهای سیالیک متصل به بقیه الیگوساکاریدها توسط یک پیوند α-۲٬۶ متصل میشوند،[۱][۳][۱۷] که بیشتر در سلولهای تنفسی مختلف مانند سلولهای اپیتلیال تنفسی و شبکیه یافت میشود.[۲۲] AIVها اسیدهای سیالیک را با پیوند α-۲٬۳ ترجیح میدهند که در پرندگان در سلولهای اپیتلیال دستگاه گوارش[۱][۳][۱۷] و در انسان در دستگاه تنفسی تحتانی رایج است.[۳۲] علاوه بر این، برش پروتئین HA به HA1، زیرواحد اتصال و HA2، زیرواحد همجوشی، توسط پروتئازهای مختلف انجام میشود که بر روی سلولهایی که میتوانند آلوده شوند، تأثیر میگذارد. برای ویروسهای آنفلوآنزای پستانداران و AIVهای با قدرت پاتوژنی کمتر، برش خارج سلولی است، که عفونت را به سلولهایی که دارای پروتئازهای مناسب هستند محدود میکند، در حالی که برای AIVهای بسیار بیماریزا، برش درون سلولی است و توسط پروتئازهای موجود در همهجا انجام میشود که امکان عفونت انواع بیشتری از سلولها را فراهم کرده و در نتیجه، به بیماری شدیدتر کمک میکند.[۱][۲۷][۳۳]
ایمنیشناسی
[ویرایش]سلولها دارای حسگرهایی برای تشخیص آرانای ویروسی هستند که میتواند تولید اینترفرون را القا کند. اینترفرونها واسطه بیان پروتئینهای ضد ویروسی و پروتئینهایی هستند که سلولهای ایمنی را به محل عفونت جذب میکنند و همچنین سلولهای غیر عفونی مجاور را از عفونت مطلع میکنند. برخی از سلولهای آلوده، سیتوکینهای پیش التهابی را آزاد میکنند که سلولهای ایمنی را به محل عفونت جذب میکند. سلولهای ایمنی با کشتن سلولهای آلوده و فاگوسیت کردن ذرات ویروسی و سلولهای آپوپتوز شده، عفونت ویروسی را کنترل میکنند. تشدید پاسخ ایمنی میتواند از طریق طوفان سیتوکینی به ارگانیسم میزبان آسیب برساند.[۱][۱۳][۲۲] برای مقابله با پاسخ ایمنی، ویروسهای آنفلوآنزا پروتئینهای غیرساختاری مختلفی از جمله NS1، NEP, PB1-F2 و PA-X را رمزگذاری میکنند که در محدود کردن پاسخ ایمنی میزبان با سرکوب تولید اینترفرون و بیان ژن میزبان نقش دارند.[۱][۲۳]
سلولهای B، نوعی گلبول سفید، آنتیبادیهایی تولید میکنند که به آنتیژنهای آنفلوآنزای HA و NA (یا HEF)[۲۰] و سایر پروتئینها، به میزان کمتری متصل میشوند. پس از اتصال به این پروتئینها، آنتیبادیها از اتصال ویریونها به گیرندههای سلولی جلوگیری کرده و ویروس را خنثی میکنند. در انسان، پاسخ آنتیبادی قابل توجهی حدود ۱ هفته پس از قرار گرفتن در معرض ویروس رخ میدهد.[۳۴] این پاسخ آنتیبادی معمولاً قوی و طولانی مدت است، به ویژه برای ICV و IDV.[۱][۲۰] به عبارت دیگر، افرادی که در دوران کودکی در معرض یک سویه خاص قرار گرفتهاند، هنوز در مراحل بعدی زندگی، آنتیبادیهایی علیه آن سویه در سطح معقولی دارند که میتواند تا حدودی از سویههای مرتبط محافظت کند.[۱] با این حال، یک «گناه آنتیژنی اصلی» ("original antigenic sin") وجود دارد که در آن اولین زیرگروه HA که فرد در معرض آن قرار میگیرد، بر پاسخ ایمنی مبتنی بر آنتیبادی به عفونتها و واکسنهای آینده تأثیر میگذارد.[۲]
پیشگیری
[ویرایش]واکسیناسیون
[ویرایش]
واکسیناسیون سالانه اصلیترین و مؤثرترین راه برای جلوگیری از آنفلوآنزا و عوارض مرتبط با آنفلوآنزا، به ویژه برای گروههای پرخطر است.[۱][۱۰][۳۵] واکسنهای ضد آنفلوآنزا، سه ظرفیتی یا چهار ظرفیتی هستند و در برابر سویه H1N1، سویه H3N2 و یک یا دو سویه IBV مربوط به دو دودمان IBV محافظت میکنند.[۲][۱۰] دو نوع واکسن در حال استفاده است: واکسنهای غیرفعال که حاوی ویروسهای «کشته» (یعنی غیرفعالشده) هستند و واکسنهای زنده ضعیفشده آنفلوانزا (LAIVs live attenuated influenza vaccines;) که حاوی ویروسهای ضعیفشده هستند.[۱] سه نوع واکسن غیرفعال وجود دارد: ویروس کامل، ویروس تقسیم شده، که در آن ویروس توسط یک پاک کننده مختل میشود، و واحد فرعی که فقط حاوی آنتیژنهای ویروسی HA و NA است.[۳۶] اکثر واکسنهای آنفلوآنزا غیرفعال شده و از طریق تزریق عضلانی تجویز میشوند. LAIVها به داخل حفره بینی اسپری میشوند.[۱]
توصیههای واکسیناسیون بسته به کشور متفاوت است. برخی واکسیناسیون را برای همه افراد بالای یک سن خاص، مانند ۶ ماهگی، توصیه میکنند،[۳۵] در حالی که سایر کشورها توصیهها را به گروههای پرخطر محدود میکنند.[۱][۱۱] نوزادان خردسال به دلایل ایمنی نمیتوانند واکسن آنفلوآنزا دریافت کنند، اما اگر واکسنهای غیرفعال در دوران بارداری به مادر تزریق شود، میتوانند ایمنی غیرفعال را از مادر خود به ارث ببرند.[۳۷] واکسیناسیون آنفلوآنزا به کاهش احتمال دستهبندی مجدد کمک میکند.[۱۳]

بهطور کلی، واکسنهای آنفلوآنزا تنها زمانی مؤثر هستند که تطابق آنتیژنی بین سویههای واکسن و سویههای در گردش وجود داشته باشد.[۲][۱۰] علاوه بر این، بیشتر واکسنهای تجاری موجود آنفلوآنزا از طریق انتشار ویروسهای آنفلوآنزا در تخم مرغ جنیندار تولید میشوند که ۶ تا ۸ ماه طول میکشد.[۲] فصلهای آنفلوآنزا در نیمکرهٔ شمالی و جنوبی متفاوت است، بنابراین سازمان جهانی بهداشت دو بار در سال، یکی برای هر نیمکره، تشکیل جلسه میدهد تا بر اساس مشاهده از روشهای مهار HA، در مورد سویههایی که باید در واکسهای آنفلوآنزا گنجانده شوند، بحث کند.[۳][۱۰] روشهای دیگر تولید شامل واکسن غیرفعال مبتنی بر کشت سلولی MDCK و واکسن زیرواحد نوترکیب تولید شده از بیان بیش از حد باکولوویروس در سلولهای حشرات است.[۲][۳۸]
کموپروفیلاکسی ضد ویروسی
[ویرایش]آنفلوآنزا را میتوان با پیشگیری پس از مواجهه با داروهای ضد ویروسی اسلتامیویر، که میتواند به صورت خوراکی توسط افراد حداقل سهماهه مصرف کنند، و زانامیویر (zanamivir)، که میتواند توسط افراد بالای هفت سال استنشاق شود، پیشگیری کرد یا کاهش داد. کموپروفیلاکسی برای افرادی که در معرض خطر ابتلا به عوارض هستند و کسانی که به دلیل موارد منع مصرف یا عدم اثربخشی نمیتوانند واکسن آنفلوآنزا را دریافت کنند بسیار مفید است.[۱۰] کموپروفیلاکسی پس از مواجهه تنها در صورتی توصیه میشود که اسلتامیویر ظرف ۴۸ ساعت پس از تماس با یک مورد تأیید شده یا مشکوک آنفلوآنزا و زانامیویر در عرض ۳۶ ساعت مصرف شود.[۱۰][۱۱] کموپروفیلاکسی برای افرادی که هنوز برای فصل جاری آنفلوآنزا واکسن دریافت نکردهاند و کمتر از دو هفته از تماس، واکسن دریافت کردهاند، در صورت عدم تطابق قابل توجه بین واکسن و سویههای در گردش، یا در طول طغیان بیماری در یک محیط بسته بدون توجه به سابقه واکسیناسیون، پیشنهاد میشود.[۱۱]
کنترل عفونت
[ویرایش]بهداشت دست در کاهش شیوع آنفلوآنزا مهم است. این، شامل شستن مکرر دستها با آب و صابون، استفاده از ضدعفونی کنندههای حاوی الکل، و دست نزدن به چشمها، بینی و دهان خود با دست است. پوشاندن بینی و دهان هنگام سرفه یا عطسه مهم است.[۳۹] روشهای دیگر برای محدود کردن انتقال آنفلوآنزا عبارتند از: ماندن در خانه هنگام بیماری،[۱] اجتناب از تماس با دیگران تا یک روز پس از پایان علائم،[۱۱] و ضدعفونی کردن سطوحی که احتمالاً توسط ویروس آلوده شدهاند.[۱]
در مورد استفاده از ماسک تردید وجود دارد زیرا تحقیقات تاکنون کاهش قابل توجهی در آنفلوآنزای فصلی با استفاده از ماسک زدن، نشان نداده است. به همین ترتیب، اثربخشی غربالگری در نقاط ورودی به کشورها به خوبی مورد تحقیق قرار نگرفته است.[۳۹] اقدامات فاصله گذاری اجتماعی مانند تعطیلی مدارس، اجتناب از تماس با افراد آلوده از طریق انزوا یا قرنطینه و محدود کردن تجمعات جمعی ممکن است انتقال را کاهش دهد،[۱][۳۹] اما این اقدامات اغلب گران، نامطلوب و دشوار است. در نتیجه، روشهای رایج کنترل عفونت، آداب تنفسی، بهداشت دست و استفاده از ماسک هستند که ارزان و آسان هستند. اقدامات دارویی مؤثر هستند اما ممکن است در مراحل اولیه طغیان بیماری در دسترس نباشند.[۴۰]
در محیطهای مراقبتهای بهداشتی، افراد آلوده ممکن است به صورت گروهی یا به اتاقهای جداگانه اختصاص داده شوند. هنگام تماس با افراد آلوده در صورت وجود خطر قرار گرفتن در معرض مایعات آلودهٔ بدن، لباسهای محافظ مانند ماسک، دستکش و روپوش توصیه میشود. نگه داشتن بیماران در اتاقهای فشار منفی و اجتناب از فعالیتهای تولید آئروسل ممکن است کمک کند،[۱۰] اما سیستمهای تهویهٔ هوا برای جلوگیری از گسترش آنفلوآنزا در هوا ضروری نیستند.[۴] در خانههای مسکونی، پذیرشهای جدید ممکن است نیاز به بسته شدن داشته باشند تا زمانی که شیوع آنفلوآنزا کنترل شود. هنگام ترخیص بیماران به خانههای مراقبت، در صورتی که طغیان بیماری وجود دارد، باید مراقبتهای لازم انجام شود.[۱۱]
از آنجایی که ویروسهای آنفلوآنزا در حیواناتی مانند پرندگان و خوکها در گردش هستند، پیشگیری از انتقال از این حیوانات مهم است. تصفیه آب، پرورش حیوانات در فضای سربسته، قرنطینه حیوانات بیمار، واکسیناسیون و امنیت زیستی اقدامات اولیه مورد استفاده هستند. قرار دادن مرغداریها و خوکخانهها در زمینهای مرتفع و دور از مزارع پرتراکم، مزارع، بازارهای مرغ زنده و حجمهای آبی به کاهش دادن تماس با پرندگان وحشی کمک میکنند.[۱] به نظر میرسد بسته شدن بازارهای مرغ زنده مؤثرترین اقدام باشد[۱۷] و نشان داده است که در کنترل شیوع H5N1، H7N9 و H9N2 مؤثر است.[۱۸] سایر اقدامات ایمنی زیستی عبارتند از تمیز کردن و ضد عفونی کردن تجهیزات و وسایل نقلیه، ممنوعیت بازدید از مرغداریها، عدم بازگرداندن پرندگان در نظر گرفته شده برای کشتار به مزارع،[۴۱] تعویض لباس، ضد عفونی کردن حمام پا و تصفیه آب و غذا.[۱]
اگر بازارهای مرغ زنده تعطیل نباشند، «روزهای پاک» که مرغهای فروخته نشده حذف میشوند و تأسیسات ضدعفونی میشوند و میتوان از سیاستهای «عدم حمل و نقل» برای از بین بردن مواد عفونی قبل از رسیدن طیور جدید برای کاهش شیوع ویروسهای آنفلوآنزا استفاده کرد. اگر یک ویروس آنفلوآنزای جدید اقدامات ایمنی زیستی ذکر شده را نقض کرده باشد، تشخیص سریع برای از بین بردن آن از طریق قرنطینه، آلودگی زدایی و حذف، ممکن است برای جلوگیری از بومی شدن ویروس ضروری باشد.[۱] واکسنهایی برای زیرگروههای H5، H7 و H9 پرندگان وجود دارد که در برخی کشورها استفاده میشود.[۱۷] برای مثال، در چین، واکسیناسیون پرندگان اهلی علیه H7N9 با موفقیت گسترش آن را محدود کرد که نشان میدهد که واکسیناسیون ممکن است یک استراتژی مؤثر باشد[۲۷] در صورتی که در ترکیب با سایر اقدامات برای محدود کردن انتقال استفاده شود.[۱] در خوکها و اسبها، مدیریت آنفلوآنزا به واکسیناسیون با امنیت زیستی بستگی دارد.[۱]
تشخیص
[ویرایش]
تشخیص بر اساس علائم در افراد سالم در طول اپیدمیهای فصلی نسبتاً دقیق است و باید در موارد پنومونی، سندرم دیسترس تنفسی حاد (acute respiratory distress syndrome; ARDS)، سپسیس، یا در صورت بروز آنسفالیت، میوکاردیت یا شکستگی بافت عضلانی شک کرد.[۱۵] از آنجایی که آنفلوآنزا مشابه سایر بیماریهای ویروسی دستگاه تنفسی است، تشخیص آزمایشگاهی برای تأیید ضروری است. روشهای متداول جمعآوری نمونه برای آزمایش عبارتند از سواب بینی و گلو[۱] اگر عفونت دستگاه تنفسی فوقانی اما نه دستگاه تنفسی تحتانی را پاک کرده باشد، ممکن است از دستگاه تنفسی تحتانی نمونه برداری شود. آزمایش آنفلوآنزا برای افرادی که در فصل آنفلوآنزا با علائمی شبیه آنفلوآنزا در بیمارستان بستری میشوند یا کسانی که با یک مورد آنفلوآنزا تماس داشتهاند، توصیه میشود. برای موارد شدید، تشخیص زودهنگام، نتیجهٔ بیمار را بهبود میبخشد.[۳۵] روشهای تشخیصی که میتوانند آنفلوآنزا را شناسایی کنند شامل کشتهای ویروسی، آزمایشهای تشخیص آنتیبادی و آنتیژن و آزمایشهای مبتنی بر اسید نوکلئیک هستند.[۴۲]
ویروسها را میتوان در کشت سلولهای پستانداران یا تخمهای جنینی به مدت ۳ تا ۱۰ روز برای نظارت بر اثر سیتوپاتیک رشد داد. سپس تأیید نهایی را میتوان از طریق رنگ آمیزی آنتیبادی، جذب خون با استفاده از گلبولهای قرمز یا میکروسکوپ ایمونوفلورسانس انجام داد. کشتهای ویال پوستهای، میتواند عفونت را از طریق رنگآمیزی ایمنی قبل از ظاهر شدن یک اثر سیتوپاتیک شناسایی کرده و نسبت به کشتهای سنتی حساستر است و در عرض ۱–۳ روز نتیجه را میدهد.[۱][۳۵][۴۲] کشتها را میتوان برای توصیف ویروسهای جدید، مشاهده حساسیت به داروهای ضد ویروسی و نظارت بر دریفت آنتیژنی استفاده کرد، اما آنها نسبتاً کند هستند و به مهارتها و تجهیزات تخصصی نیاز دارند.[۱]
از سنجشهای سرولوژیکی میتوان برای تشخیص پاسخ آنتیبادی به آنفلوآنزا پس از عفونت طبیعی یا واکسیناسیون استفاده کرد. سنجشهای سرولوژیکی رایج عبارتند از سنجشهای مهار هماگلوتیناسیون که آنتیبادیهای اختصاصی HA را شناسایی میکنند، سنجشهای خنثیسازی ویروس که بررسی میکنند آیا آنتیبادیها ویروس را خنثی کردهاند و الایزا (ELISA; enzyme-linked immunoabsorbant assays). این روشها نسبتاً ارزان و سریع هستند اما نسبت به آزمایشهای مبتنی بر اسید نوکلئیک کمتر قابل اعتماد هستند.[۱][۴۲]
آزمایشهای آنتیبادی فلورسنت مستقیم یا ایمونوفلورسانس (DFA/IFA; Direct fluorescent or immunofluorescent antibody) شامل رنگآمیزی سلولهای اپیتلیال تنفسی در نمونهها با آنتیبادیهای خاص آنفلوآنزا نشاندار شده با فلورسنت است و به دنبال آن بررسی زیر میکروسکوپ فلورسنت انجام میشود. آنها میتوانند بین IAV و IBV تمایز قائل شوند اما نمیتوانند زیرگروه IAV باشند.[۴۲] تستهای تشخیصی سریع آنفلوآنزا (RIDTs) یک راه ساده برای به دست آوردن نتایج سنجش هستند، کم هزینه بوده و نتایج را به سرعت در کمتر از ۳۰ دقیقه ارائه میکنند، بنابراین، معمولاً مورد استفاده قرار میگیرند، اما نمیتوانند بین IAV و IBV یا بین زیرگروههای IAV تمایز قائل شوند و به اندازه تستهای مبتنی بر اسید نوکلئیک حساس نیستند.[۱][۴۲]
تستهای مبتنی بر اسید نوکلئیک (NATs; Nucleic acid-based tests) اسید نوکلئیک ویروسی را تقویت و شناسایی میکنند. بیشتر این آزمایشها چند ساعت طول میکشد،[۴۲] اما سنجشهای مولکولی سریع، به اندازه RIDT سریع هستند.[۳۵] در میان NATها، واکنش زنجیره ای پلیمراز رونویسی معکوس (RT-PCR; reverse transcription polymerase chain reaction) سنتیترین و استاندارد طلایی برای تشخیص آنفلوآنزا است[۴۲] زیرا سریع است و میتواند زیرگروه IAV را شناسایی کند، اما نسبتاً گران است و نسبت به کشت، بیشتر مستعد مثبت کاذب است.[۱] سایر NATهایی که استفاده شدهاند عبارتند از: سنجش مبتنی بر تقویت همدما با واسطه حلقه (loop-mediated isothermal amplification-based assays) و سنجش مبتنی بر تقویت ساده و تقویت مبتنی بر توالی اسید نوکلئیک. روشهای تعیین توالی اسید نوکلئیک میتواند عفونت را با بهست آوردن توالی اسید نوکلئیک نمونههای ویروسی برای شناسایی ویروس و مقاومت دارویی ضد ویروسی شناسایی کنند. روش سنتی، توالی یابی سانگر (Sanger sequencing) است، اما تا حد زیادی با روشهای نسل بعدی که سرعت و توان عملیاتی توالی یابی بیشتری دارند، جایگزین شده است.[۴۲]
درمان
[ویرایش]درمان آنفلوآنزا در موارد بیماری خفیف یا متوسط، حمایتی است و شامل داروهای ضد تب مانند استامینوفن و ایبوپروفن،[۴۳] مصرف مایعات کافی برای جلوگیری از کمآبی بدن و استراحت در خانه است.[۱۱] قطرههای سرفه و اسپریهای گلو ممکن است برای گلودرد مفید باشند. توصیه میشود در هنگام ابتلا به آنفلوآنزا از مصرف الکل و تنباکو خودداری شود.[۴۳] آسپرین برای درمان آنفلوآنزا در کودکان به دلیل افزایش خطر ابتلا به سندرم ری توصیه نمیشود.[۴۴] کورتیکواستروئیدها نیز به همین ترتیب توصیه نمیشوند، مگر در مواردی که شوک سپتیک یا یک بیماری زمینهای پزشکی، مانند بیماری انسدادی مزمن ریوی یا تشدید آسم را درمان میکنند، زیرا با افزایش مرگومیر مرتبط هستند.[۳۵] اگر عفونت باکتریایی ثانویه رخ دهد، ممکن است درمان با آنتیبیوتیک ضروری باشد.[۱۱]
داروهای ضد ویروسی
[ویرایش]| دارو | روش مصرف | سن تأیید شده برای استفاده |
|---|---|---|
| Oseltamivir | خوراکی | حداقل دو هفتگی |
| Zanamivir | استنشاق | حداقل پنج سالگی |
| Peramivir | تزریق داخل وریدی | حداقل ۱۸ سالگی |
| Laninamivir | استنشاق[۱] | دوز ۴۰ میلیگرم برای افراد حداقل ۱۰ سال و ۲۰ میلیگرم برای افراد زیر ۱۰ سال[۴۵] |
| Baloxavir marboxil | خوراکی[۴] | حداقل ۱۲ سالگی[۳۵] |
داروهای ضد ویروسی عمدتاً برای درمان بیماران شدید، به ویژه آنهایی که سیستم ایمنی ضعیفی دارند، استفاده میشود. داروهای ضد ویروسی زمانی مؤثر هستند که در ۴۸ ساعت اول پس از ظهور علائم شروع شوند. تجویز بعدی ممکن است هنوز برای کسانی که نقص ایمنی زمینهای دارند، کسانی که علائم شدیدتر دارند یا کسانی که در صورت دفع ویروس هنوز در معرض خطر ابتلا به عوارض هستند، مفید باشد. همچنین، اگر فردی مشکوک به آنفلوآنزا در بیمارستان بستری شود، به جای منتظر ماندن برای بازگشت نتایج آزمایش و در صورت بدتر شدن علائم، درمان ضد ویروسی توصیه میشود.[۱][۳۵] اکثر داروهای ضد ویروسی علیه آنفلوآنزا به دو دسته تقسیم میشوند: مهارکنندههای نورآمینیداز (NA) و مهارکنندههای M2.[۱۳] Baloxavir marboxil یک استثنا قابل توجه است که فعالیت اندونوکلئاز آرانای پلیمراز ویروسی را هدف قرار میدهد و میتواند به عنوان جایگزینی برای مهارکنندههای NA و M2 برای IAV و IBV استفاده شود.[۴][۱۰][۱۷]
مهارکنندههای NA، فعالیت آنزیمی گیرندههای NA را هدف قرار میدهند، و با تقلید از اتصال اسید سیالیک در محل فعال NA روی ویریونهای IAV و IBV[۱] انتشار ویروس از سلولهای آلوده و سرعت تکثیر ویروس مختل میشود.[۱۱] مهارکنندههای NA شامل اسلتامیویر است که به صورت خوراکی به شکل پیش دارو مصرف میشود و در کبد به شکل فعال آن تبدیل میشود و زانامیویر که پودری است که از طریق بینی استنشاق میشود. اسلتامیویر و زانامیویر برای پیشگیری و پیشگیری پس از مواجهه مؤثر هستند و تحقیقات کلی نشان میدهد که مهارکنندههای NA در کاهش میزان عوارض، بستری شدن در بیمارستان و مرگومیر[۱] و طول مدت بیماری مؤثر هستند.[۴][۱۳][۳۵] علاوه بر این، هرچه مهارکنندههای NA زودتر ارائه شوند، نتیجه بهتری حاصل میشود،[۴] اگرچه تجویز دیرهنگام همچنان میتواند در موارد شدید مفید باشد.[۱][۳۵] سایر مهارکنندههای NA شامل لانینامیویر[۱] و پرامیویر هستند که دومی میتواند به عنوان جایگزینی برای اسلتامیویر برای افرادی که قادر به تحمل یا جذب آن نیستند استفاده شود.[۳۵]
آدامانتان آمانتادین (adamantanes amantadine) و ریمانتادین (rimantadine) داروهای خوراکی هستند که کانال یونی M2 ویروس آنفلوآنزا را مسدود کرده[۱] و از برداشته شدن پوشش ویروسی جلوگیری میکنند.[۴] این داروها فقط در برابر IAV عمل میکنند[۳۵] اما به دلیل مقاومت گسترده در بین IAVها به آنها، دیگر برای استفاده توصیه نمیشوند.[۴] مقاومت به آدامانتان برای اولین بار در H3N2 در سال ۲۰۰۳ ظاهر شد و تا سال ۲۰۰۸ در سراسر جهان گسترش یافت. مقاومت به اسلتامیویر دیگر گسترده نیست زیرا سویه H1N1 همهگیر سال ۲۰۰۹ (H1N1 pdm09)، که به آدامانتانها مقاوم است، ظاهراً جایگزین گونههایهای مقاوم در گردش شد. از زمان همهگیری ۲۰۰۹، مقاومت به اسلتامیویر عمدتاً در بیمارانی که تحت درمان قرار میگیرند، مشاهده شده است،[۱] بهویژه کودکان ضعیف و کمسنسال.[۴] مقاومت به اسلتامیویر معمولاً در H1N1 گزارش شده است، اما در H3N2 و IBV کمتر گزارش شده است.[۱] به همین دلیل، اسلتامیویر به عنوان اولین داروی انتخابی برای افراد دارای سیستم ایمنی مناسب توصیه میشود، در حالی که برای افراد دارای نقص ایمنی، اسلتامیویر در برابر H3N2 و IBV و زانامیویر در برابر H1N1 pdm09 توصیه میشود. مقاومت به زانامیویر کمتر مشاهده میشود و مقاومت به پرامیویر و بالوکساویر ماربوکسیل ممکن است.[۴]
پیشآگهی
[ویرایش]در افراد سالم، عفونت آنفلوآنزا معمولاً خود محدود شونده و به ندرت کشنده است.[۱۰][۱۱] علائم معمولاً ۲ تا ۸ روز طول میکشد.[۱۳] آنفلوآنزا میتواند باعث غیبت افراد از محل کار یا مدرسه شود و با کاهش عملکرد شغلی و در بزرگسالان با کاهش استقلال همراه است. خستگی و کسالت ممکن است چند هفته پس از بهبودی ادامه داشته باشد و بزرگسالان سالم ممکن است ناهنجاریهای ریوی را تجربه کنند که رفع آن ممکن است چند هفته طول بکشد. عوارض و مرگومیر در درجه اول در جمعیتهای پرخطر و کسانی که در بیمارستان بستری هستند رخ میدهد. بیماری شدید و مرگومیر معمولاً به پنومونی ناشی از عفونت ویروسی اولیه یا عفونت باکتریایی ثانویه نسبت داده میشود،[۱][۱۱] که میتواند به ARDS پیشرفت کند.[۱۳]
سایر عوارض تنفسی که ممکن است رخ دهد عبارتند از سینوزیت، برونشیت، برونشیولیت، تجمع مایع اضافی در ریهها و تشدید برونشیت مزمن و آسم. عفونت گوش میانی و کروپ ممکن است رخ دهد که بیشتر در کودکان است.[۱][۱۰] مشاهده شده است که عفونت ثانویه با استافیلوکوکوس اورئوس، عمدتاً در کودکان، باعث ایجاد سندرم شوک توکسیک (toxic shock syndrome) پس از آنفلوآنزا، همراه با افت فشار خون، تب و قرمزی و لایه برداری پوست است.[۱] عوارضی که بر سیستم قلبی عروقی تأثیر میگذارد نادر است و شامل پریکاردیت، میوکاردیت برق آسا با ضربان قلب سریع، آهسته یا نامنظم و تشدید بیماری قلبی عروقی از قبل موجود است.[۱۰][۱۱] التهاب یا تورم عضلات همراه با تجزیه بافت عضلانی به ندرت رخ میدهد، و معمولاً در کودکان است که به صورت حساسیت شدید و درد عضلانی در پاها و بی میلی به راه رفتن به مدت ۲ تا ۳ روز ظاهر میشود.[۱][۱۱][۱۵]
آنفلوآنزا میتواند بر بارداری تأثیر بگذارد، از جمله باعث کوچکتر شدن اندازه نوزاد، افزایش خطر زایمان زودرس و افزایش خطر مرگ کودک در مدت کوتاهی قبل یا بعد از تولد شود.[۱۱] عوارض عصبی در موارد نادر با آنفلوآنزا همراه بوده است، از جمله مننژیت آسپتیک، آنسفالیت، آنسفالومیلیت منتشر، میلیت عرضی و سندرم گیلن باره.[۱۵] علاوه بر این، تشنج ناشی از تب و سندرم ری میتواند رخ دهد، که بیشتر در کودکان رخ میدهد.[۱][۱۱] انسفالوپاتی مرتبط با آنفلوآنزا میتواند مستقیماً از عفونت سیستم عصبی مرکزی ناشی از حضور ویروس در خون رخ دهد و به صورت شروع ناگهانی تب همراه با تشنج و به دنبال آن پیشرفت سریع به کما نشان داده شود.[۱۰] شکل غیر معمول آنسفالیت به نام انسفالیت بیحالی که با سردرد، خواب آلودگی و کما مشخص میشود، به ندرت ممکن است زمانی پس از عفونت رخ دهد.[۱] در بازماندگان انسفالوپاتی مرتبط با آنفلوآنزا، نقایص عصبی ممکن است رخ دهد.[۱۰] در درجه اول در کودکان، در موارد شدید، سیستم ایمنی به ندرت ممکن است بهطور چشمگیری گلبولهای سفید خونی را که سیتوکینها را آزاد میکنند، بیش از حد تولید کند و باعث التهاب شدید شود.[۱۰]
افرادی که حداقل ۶۵ سال سن دارند،[۱۱] به دلیل ضعف سیستم ایمنی ناشی از افزایش سن یا یک بیماری مزمن، مانند کودکان زیر یک سال و کودکانی که این بیماری را ندارند و قبلاً چندین بار در معرض ویروس آنفلوآنزا قرار گرفتهاند، گروهی پرخطر برای ایجاد عوارض هستند. زنان باردار در معرض خطر بالایی هستند، که در سهماهه[۱] افزایش یافته و تا دو هفته پس از زایمان ادامه مییابد.[۱۱][۳۵] چاقی، به ویژه شاخص توده بدنی بیشتر از ۳۵–۴۰، با مقادیر بیشتری از تکثیر ویروسی، افزایش شدت عفونت باکتریایی ثانویه و کاهش اثربخشی واکسیناسیون همراه است. افرادی که دارای بیماریهای زمینهای هستند نیز در معرض خطر در نظر گرفته میشوند، از جمله افرادی که دارای مشکلات قلبی مادرزادی یا مزمن یا ریوی (مانند آسم)، کلیه، کبد، اختلالات خونی، عصبی یا متابولیک (مثلا دیابت) هستند،[۱][۱۰][۱۱] مانند افرادی که به دلیل شیمی درمانی، نداشتن طحال، درمان طولانی مدت استروئیدی، اختلال عملکرد طحال، یا عفونت HIV دچار نقص ایمنی شدهاند.[۱۱] استفاده از تنباکو، از جمله مصرف گذشته، فرد را در معرض خطر قرار میدهد.[۳۵] نقش ژنتیک در آنفلوآنزا به خوبی بررسی نشده است،[۱] اما ممکن است عاملی در مرگومیر آنفلوآنزا باشد.[۱۳]
همهگیرشناسی
[ویرایش]
آنفلوآنزا معمولاً با اپیدمیهای فصلی و پاندمیهای پراکنده مشخص میشود. بیشترین بار آنفلوآنزا ناشی از فصول آنفلوآنزا و ناشی از IAV و IBV است. در میان زیرگروههای IAV, H1N1 و H3N2 در انسان در گردش هستند و مسئول آنفلوآنزای فصلی هستند. موارد بهطور نامتناسبی در کودکان رخ میدهد، اما شدیدترین علل در میان افراد مسن، بسیار جوان،[۱] نقص ایمنی است.[۴] در یک سال معمولی، ویروسهای آنفلوآنزا، ۵ تا ۱۵ درصد از جمعیت جهان را آلوده میکنند،[۳][۴۲] که سالانه باعث ۳ تا ۵ میلیون مورد بیماری شدید میشود[۱][۲] و هر سال ۲۹۰۰۰۰ تا ۶۵۰۰۰۰ مرگومیر ناشی از آن به دلیل بیماری تنفسی را شامل میشود.[۳][۴][۴۷] ۵ تا ۱۰ درصد از بزرگسالان و ۲۰ تا ۳۰ درصد از کودکان هر سال به آنفلوآنزا مبتلا میشوند[۱۹] تعداد گزارش شده موارد آنفلوآنزا معمولاً بسیار کمتر از تعداد واقعی موارد است.[۱][۳۷]
در طول اپیدمیهای فصلی، تخمین زده میشود که حدود ۸۰٪ از افراد سالم که سرفه یا گلودرد دارند، به آنفلوآنزا مبتلا هستند.[۱] تقریباً ۳۰ تا ۴۰ درصد از افرادی که به دلیل آنفلوآنزا در بیمارستان بستری میشوند به پنومونی مبتلا میشوند و حدود ۵ درصد از کل موارد پنومونی شدید در بیمارستانها، به دلیل آنفلوآنزا است که همچنین شایعترین علت ARDS در بزرگسالان است. در کودکان، آنفلوآنزا یکی از دو علت شایع ARDS است که دیگری ویروس سنسیشیال تنفسی است.[۱۵] حدود ۳ تا ۵ درصد از کودکان هر سال به دلیل آنفلوآنزا به عفونت گوش میانی مبتلا میشوند.[۱۰] بزرگسالانی که به دلیل آنفلوآنزا دچار نارسایی ارگان میشوند و کودکانی که دارای امتیاز PIM و نارسایی حاد کلیه هستند، میزان مرگومیر بالاتری دارند.[۱۵] در طول آنفلوآنزای فصلی، مرگومیر در افراد بسیار جوان و مسن متمرکز است، در حالی که در طول پاندمی آنفلوآنزا، بزرگسالان جوان اغلب با نرخ بالایی تحت تأثیر قرار میگیرند.[۱۳]

در مناطق معتدل، تعداد موارد آنفلوآنزا از فصلی به فصل دیگر متفاوت است. سطوح پایین ویتامین D، احتمالاً به دلیل نور کمتر خورشید،[۳۱] رطوبت کمتر، درجه حرارت پایینتر، و تغییرات جزئی در پروتئینهای ویروس ناشی از دریفت آنتیژنی، به اپیدمیهای سالانه کمک میکند که در طول فصل زمستان به اوج خود میرسد. در نیمکره شمالی، این از اکتبر تا مه (بهطور محدودتر از دسامبر تا آوریل[۱۳]), و در نیمکره جنوبی، از ماه مه تا اکتبر (بهطور محدودتر از ژوئن تا سپتامبر است[۱۳]). بنابراین، هر سال دو فصل مجزای آنفلوآنزا در مناطق معتدل وجود دارد، یکی در نیمکره شمالی و دیگری در نیمکره جنوبی.[۱][۲][۱۱] در مناطق گرمسیری و نیمه گرمسیری، روند فصلی پیچیدهتر است و به نظر میرسد تحت تأثیر عوامل مختلف آب و هوایی مانند حداقل دما، ساعات آفتابی، حداکثر بارندگی و رطوبت بالا قرار میگیرد.[۱][۴۸] بنابراین ممکن است آنفلوآنزا در تمام طول سال در این مناطق رخ دهد.[۱۳] اپیدمیهای آنفلوآنزا در دوران مدرن تمایل به شروع در نیمکره شرقی یا جنوبی دارند،[۴۸] که آسیا مخزن اصلی ویروسهای آنفلوآنزا است.[۱۳]
IAV و IBV با هم گردش میکنند، بنابراین این دو الگوهای انتقال یکسانی دارند.[۱] با این حال، فصلی بودن ICV، به خوبی درک نشده است. عفونت ICV در کودکان زیر دو سال شایعتر است و در بزرگسالی بیشتر افراد در معرض آن قرار گرفتهاند. بستری شدن در بیمارستان مرتبط با ICV بیشتر در کودکان زیر سه سال اتفاق میافتد و اغلب با عفونت همزمان با یک ویروس یا یک باکتری دیگر همراه است که ممکن است شدت بیماری را افزایش دهد. هنگامی که تمام بستری شدن در بیمارستان برای بیماریهای تنفسی در میان کودکان خردسال را در نظر میگیریم، به نظر میرسد ICV تنها درصد کمی از این موارد را تشکیل میدهد. طغیانهای بزرگ عفونت ICV ممکن است رخ دهد، بنابراین بروز بهطور قابل توجهی متفاوت است.[۱۲]
طغیانهای آنفلوآنزا ناشی از ویروسهای جدید آنفلوآنزا شایع هستند.[۲۱] بسته به سطح ایمنی از قبل موجود در جمعیت، ویروسهای جدید آنفلوآنزا میتوانند به سرعت پخش شوند و باعث پاندمی با میلیونها مرگ شوند. این پاندمیها، برخلاف آنفلوآنزای فصلی، ناشی از تغییرات آنتیژنی شامل ویروسهای آنفلوآنزای حیوانی است. تا به امروز، همهٔ پاندمیهای شناخته شدهٔ آنفلوآنزا توسط IAVها ایجاد شدهاند، و آنها از همان الگوی انتشار از یک نقطه مبدأ به بقیه جهان در طول موجهای متعدد در یک سال پیروی میکنند.[۱][۱۱][۳۵] سویههای پاندمی تمایل دارند با نرخ بالاتر پنومونی در افراد سالم مرتبط باشند.[۱۵] بهطور کلی پس از هر پاندمی آنفلوآنزا، سویهٔ پاندمی به عنوان عامل آنفلوآنزای فصلی به گردش خود ادامه داده و جایگزین گونههای قبلی میشود.[۱] از سال ۱۷۰۰ تا ۱۸۸۹، پاندمیهای آنفلوآنزا تقریباً هر ۵۰ تا ۶۰ سال یک بار رخ میدهد. از آن زمان، پاندمیها تقریباً هر ۱۰ تا ۵۰ سال یک بار رخ میدهند، بنابراین ممکن است در طول زمان بیشتر شوند.[۴۸]
تاریخچه
[ویرایش]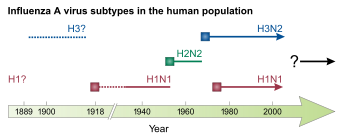
T اولین اپیدمی آنفلوآنزا ممکن است حدود ۶۰۰۰ سال قبل از میلاد در چین رخ داده باشد[۵۰] و توصیفات احتمالی آنفلوآنزا در نوشتههای یونانی از قرن پنجم قبل از میلاد وجود دارد.[۴۸][۵۱] در هر دو سال ۱۱۷۳–۱۱۷۴ پس از میلاد و ۱۳۸۷ پس از میلاد، اپیدمیهایی در سراسر اروپا رخ داد که «آنفلوآنزا» نامیده شد. اینکه آیا این اپیدمیها یا سایر اپیدمیها توسط آنفلوآنزا ایجاد شدهاند، مشخص نیست زیرا در آن زمان هیچ الگوی نامگذاری ثابتی برای بیماریهای تنفسی همهگیر وجود نداشت و «آنفلوآنزا» تا قرنها بعد به وضوح با بیماری تنفسی مرتبط نشد.[۵۲] آنفلوآنزا ممکن است در اوایل سال ۱۴۹۳ به قاره آمریکا آورده شده باشد، زمانی که یک بیماری همه گیر شبیه آنفلوآنزا باعث مرگ بیشتر جمعیت آنتیل شد.[۵۳][۵۴]
اولین رکورد قانع کننده از پاندمی آنفلوآنزا در سال ۱۵۱۰ بود. این بیماری در شرق آسیا و سپس به شمال آفریقا و سپس اروپا گسترش یافت.[۵۵] به دنبال این پاندمی، آنفلوآنزای فصلی با پاندمیهای بعدی در سالهای ۱۵۵۷ و ۱۵۸۰ رخ داد.[۵۲] پاندمی آنفلوآنزا در سال ۱۵۵۷ بهطور بالقوه اولین باری بود که آنفلوآنزا با سقط جنین و مرگ زنان باردار مرتبط شد.[۵۶] پاندمی آنفلوآنزای ۱۵۸۰ در تابستان در آسیا سرچشمه گرفت، به آفریقا، سپس اروپا و در نهایت آمریکا گسترش یافت.[۴۸] در پایان قرن شانزدهم، آنفلوآنزا به عنوان یک بیماری خاص و قابل تشخیص با اشکال همه گیر و بومی شناخته شد.[۵۲] در سال ۱۶۴۸، کشف شد که اسبها نیز آنفلوآنزا را تجربه میکنند.[۵۵]
دادههای آنفلوآنزای بعد از سال ۱۷۰۰ دقیقتر است، بنابراین تشخیص پاندمی آنفلوآنزا پس از این مرحله آسانتر است.[۵۷] اولین پاندمی آنفلوآنزا در قرن هجدهم در سال ۱۷۲۹ در روسیه در بهار آغاز شد و در طول سه سال با امواج متمایز در سراسر جهان گسترش یافت که امواج بعدی کشندهتر بودند. یکی دیگر از پاندمیهای آنفلوآنزا در سالهای ۱۷۸۱–۱۷۸۲ رخ داد که در پاییز در چین شروع شد.[۴۸] از این پاندمی، آنفلوآنزا با شیوع ناگهانی بیماری تب همراه شد.[۵۷] پاندمی بعدی آنفلوآنزا از سال ۱۸۳۰ تا ۱۸۳۳ بود که در زمستان در چین آغاز شد. این پاندمی نرخ حمله بالایی داشت، اما میزان مرگومیر پایین بود.[۲۶][۴۸]
یک پاندمی جزئی آنفلوآنزا از سال ۱۸۴۷ تا ۱۸۵۱ همزمان با سومین پاندمی وبا رخ داد و اولین پاندمی آنفلوآنزا بود که با آمارهای حیاتی ثبت شد، بنابراین مرگومیر آنفلوآنزا برای اولین بار به وضوح ثبت شد.[۵۷] آنفلوآنزای فوق حاد پرندگان در سال ۱۸۷۸ شناسایی شد[۵۷] و به زودی با انتقال به انسان مرتبط شد.[۵۵] در زمان پاندمی ۱۸۸۹، که ممکن است توسط یک سویه H2N2 ایجاد شده باشد،[۵۸] آنفلوآنزا به یک بیماری به راحتی قابل تشخیص تبدیل شده بود.[۵۵]
عامل میکروبی مسئول آنفلوآنزا در سال ۱۸۹۲ توسط R. F. J. Pfeiffer به عنوان گونه باکتری Haemophilus influenzae شناسایی شد که «آنفلوآنزا» را در نام خود حفظ کرده است.[۵۵][۵۷] از سال ۱۹۰۱ تا ۱۹۰۳، محققان ایتالیایی و اتریشی توانستند با استفاده از فیلترهایی با منافذ بسیار کوچک برای عبور باکتریها نشان دهند که آنفلوآنزای پرندگان، که در آن زمان «طاعون مرغی» نامیده میشد،[۲۷] توسط عامل میکروسکوپی کوچکتر از باکتریها ایجاد میشود. با این حال، تفاوتهای اساسی بین ویروسها و باکتریها هنوز بهطور کامل شناخته نشده بود.[۵۷]

از سال ۱۹۱۸ تا ۱۹۲۰، پاندمی آنفلوآنزای اسپانیایی به مخربترین پاندمی آنفلوآنزا و یکی از مرگبارترین پاندمیهای تاریخ تبدیل شد. این پاندمی که احتمالاً توسط H1N1 ایجاد شده است، احتمالاً در ایالات متحده آغاز شده است، قبل از اینکه از طریق سربازان در طول جنگ جهانی اول و پس از آن در سراسر جهان گسترش یابد. موج اولیه در نیمه اول سال ۱۹۱۸ نسبتاً جزئی بود و شبیه پاندمیهای آنفلوآنزای گذشته بود، اما موج دوم در اواخر همان سال نرخ مرگومیر بسیار بالاتری داشت.[۴۸] موج سوم با مرگومیر کمتر چند ماه پس از موج دوم در بسیاری از نقاط رخ داد.[۲۶] تا پایان سال ۱۹۲۰، تخمین زده میشود که حدود یک سوم[۱۳] تا نیمی از مردم جهان به این بیماری مبتلا شدهاند، با دهها میلیون مرگ، که بهطور نامتناسبی در بزرگسالان جوان هستند.[۴۸] در طول همهگیری ۱۹۱۸، راه تنفسی انتقال به وضوح شناسایی شد[۲۶] و نشان داده شد که آنفلوآنزا توسط یک «عبور فیلتر» ایجاد میشود، نه یک باکتری، اما عدم توافق در مورد علت آنفلوآنزا برای یک دهه دیگر وجود داشت و تحقیقات در مورد آن کاهش یافت.[۵۷] پس از پاندمی، H1N1 در انسان به شکل فصلی[۱] تا پاندمی بعدی در گردش بود.[۵۷]
در سال ۱۹۳۱، ریچارد شاپ سه مقاله منتشر کرد که یک ویروس را به عنوان عامل آنفلوآنزای خوکی، یک بیماری تازه شناخته شده در میان خوکها که در طول موج دوم پاندمی ۱۹۱۸ مشخص شد، شناسایی کرد.[۵۶][۵۷] تحقیقات Shope به تحقیقات در مورد آنفلوآنزای انسانی تجدید قوا کرد و بسیاری از پیشرفتها در ویروسشناسی، سرولوژی، ایمونولوژی، مدلهای حیوانی آزمایشی، واکسنشناسی و ایمونوتراپی از آن زمان از تحقیقات آنفلوآنزا به وجود آمده است.[۵۷] تنها دو سال پس از کشف ویروسهای آنفلوآنزا، در سال ۱۹۳۳، IAV به عنوان عامل مسئول آنفلوآنزای انسانی شناخته شد.[۵۶][۶۰] انواع فرعی IAV در طول دهه ۱۹۳۰ کشف،[۵۷] و IBV در سال ۱۹۴۰ کشف شد.[۱۹]
در طول جنگ جهانی دوم، دولت ایالات متحده روی توسعه واکسنهای غیرفعال برای آنفلوآنزا کار کرد که در نتیجه اولین واکسن آنفلوآنزا در سال ۱۹۴۵ در ایالات متحده مجوز گرفت.[۱] ICV دو سال بعد در سال ۱۹۴۷ کشف شد.[۱۹] در سال ۱۹۵۵، تأیید شد که آنفلوآنزای مرغی توسط IAV ایجاد میشود.[۲۷] از زمان جنگ جهانی دوم، چهار پاندمی آنفلوآنزا رخ داده است. اولین مورد، آنفلوآنزای آسیایی از سال ۱۹۵۷ تا ۱۹۵۸ بود که توسط یک سویه H2N2 ایجاد شد[۱][۴۰] و در استان یوننان چین شروع شد. تعداد مرگ و میرها احتمالاً از یک میلیون نفر فراتر رفته است و بیشتر در میان افراد بسیار جوان و بسیار مسن رخ داده است.[۴۸] این اولین پاندمی آنفلوآنزا بود که در حضور یک سیستم نظارت جهانی و آزمایشگاههایی که قادر به مطالعه ویروس جدید آنفلوآنزا بودند رخ داد.[۲۶] پس از این پاندمی، H2N2 زیرگروه IAV بود که مسئول آنفلوآنزای فصلی بود.[۱] اولین داروی ضد ویروسی علیه آنفلوآنزا، آمانتادین، در سال ۱۹۶۶ تأیید شد که با داروهای ضد ویروسی اضافی که از دهه ۱۹۹۰ بودند، استفاده میشد.[۴]
در سال ۱۹۶۸، H3N2 از طریق بازآرایی بین سویه H3N2 پرندگان و سویه H2N2 که در انسان در گردش بود به انسان وارد شد. سویه جدید H3N2 در هنگ کنگ پدیدار شد و در سراسر جهان گسترش یافت و باعث پاندمی آنفلوآنزای هنگ کنگ شد که منجر به مرگ ۵۰۰ هزار تا ۲ میلیون نفر شد. این اولین پاندمی بود که بهطور قابل توجهی توسط سفرهای هوایی گسترش یافت.[۳][۲۶] H2N2 و H3N2 پس از پاندمی تا سال ۱۹۷۱ که شیوع H2N2 کاهش یافت و بهطور کامل با H3N2 جایگزین شد، بهطور مشترک در گردش بودند.[۳] در سال ۱۹۷۷، H1N1 دوباره در انسان ظاهر شد، احتمالاً پس از اینکه در یک تصادف آزمایشگاهی از فریزر آزاد شد و باعث یک شبه پاندمی شد.[۲۶][۵۷] این سویه H1N1 از نظر آنتیژنی شبیه به سویههای H1N1 بود که قبل از سال ۱۹۵۷ در گردش بودند. از سال ۱۹۷۷، هر دو H1N1 و H3N2 به عنوان بخشی از آنفولانزا فصلی در انسان پخش شدهاند.[۱] در سال ۱۹۸۰، سیستم طبقهبندی مورد استفاده برای زیرشاخه ویروسهای آنفلوآنزا معرفی شد.[۶۱]

در برخی موارد، IBV به دو سویه، به نامهای دودمانهای شبه B/Victoria و B/Yamagata که هر دو از سال ۱۹۸۳ در انسانها در گردش بودهاند، تقسیم میشود.[۱۹] در سال ۱۹۹۶، HPAI H5N1 در گوانگدونگ، چین[۲۷] شناسایی شد و یک سال بعد در طیور در هنگ کنگ ظهور کرد و به تدریج از آنجا در سراسر جهان گسترش یافت. در آن زمان، یک شیوع کوچک H5N1 در انسان در هنگ کنگ رخ داد،[۳۳] و موارد پراکندهٔ انسانی از سال ۱۹۹۷ رخ داده است که میزان مرگومیر بالایی را به همراه دارد.[۱۷][۴۲] جدیدترین پاندمی آنفلوآنزا، پاندمی آنفلوآنزای خوکی در سال ۲۰۰۹ بود که در مکزیک سرچشمه گرفت و منجر به مرگ صدها هزار نفر شد.[۲۶] این بیماری توسط یک سویه جدید H1N1 ایجاد شد که مجموعهای از ویروسهای آنفلوانزای انسانی، خوکی و پرندگان بود.[۴][۱۸] پاندمی سال ۲۰۰۹ باعث جایگزینی سویههای قبلی H1N1 در گردش با سویه جدید، اما نه هر ویروس آنفلوآنزای دیگری، شد. در نتیجه، H1N1، H3N2، و هر دو دودمان IBV به شکل فصلی از زمان همهگیری سال ۲۰۰۹ در گردش بودهاند.[۱][۲۶][۲۷]
در سال ۲۰۱۱، IDV در خوکها در اوکلاهما، ایالات متحده آمریکا کشف شد و گاوها بعداً به عنوان مخزن اولیه IDV شناسایی شدند.[۱۲][۱۹] در همان سال،[۴۲] H7N9 پرندگان در چین شناسایی شد و در سال ۲۰۱۳ شروع به ایجاد عفونتهای انسانی کرد که از شانگهای و آنهوئی شروع شد و بیشتر در چین باقی ماند. HPAI H7N9 زمانی در سال ۲۰۱۶ ظاهر شد و گاهی انسان را بهطور تصادفی آلوده میکند. سایر AIVها از جمله H5N6، H6N1، H7N2-4، H7N7، و H10N7-8، از دهه ۱۹۹۰ کمتر انسان را آلوده کرده،[۱۷] و زیرگروههای HPAI H مانند H5N1-3، H5N5-6 و H5N8 در بسیاری از نقاط جهان از سال ۲۰۱۰، شروع به گسترش کردهاند. پاندمیهای آیندهٔ آنفلوآنزا که ممکن است توسط یک ویروس آنفلوآنزا با منشأ پرندگان ایجاد شود، ,[۲۷] تقریباً اجتنابناپذیر تلقی میشوند و جهانی شدن افزایش یافته گسترش ویروسهای جدید را آسانتر کرده است،[۲۶] بنابراین تلاشهای مستمری برای آماده شدن برای پاندمیهای آینده نیاز است[۵۶] تا پیشگیری و درمان آنفلوآنزا را بهبود بخشد.[۱]
ریشهشناسی
[ویرایش]کلمه آنفلوآنزا از کلمه ایتالیایی influenza از قرون وسطی لاتین influentia گرفته شده است که در اصل به معنای «بازدید» یا «نفوذ» است. اصطلاحاتی مانند influenza di freddo، به معنای «نفوذ سرما»، و influenza di stelle، به معنای «تأثیر ستارگان» از قرن چهاردهم به اثبات رسیده است. دومی به علت بیماری اشاره کرد که در آن زمان برخی آن را به شرایط نامطلوب نجومی نسبت دادند. در اوایل سال ۱۵۰۴، آنفلوآنزا به معنای «بازدید» یا «شیوع» هر بیماری بود که افراد زیادی را در یک مکان واحد در آن مبتلا میکند. در طول شیوع آنفلوآنزا در سال ۱۷۴۳ که در ایتالیا شروع شد و در سراسر اروپا گسترش یافت، این کلمه به زبان انگلیسی رسید و در تلفظ آن انگلیسی شد. از اواسط دهه ۱۸۰۰، آنفلوآنزا نیز برای اشاره به سرماخوردگی شدید مورد استفاده قرار گرفته است.[۶۲][۶۳][۶۴] شکل کوتاه شده کلمه، «آنفلوآنزا» برای اولین بار در سال ۱۸۳۹ به عنوان flue تأیید شد و املای flu در سال ۱۸۹۳ تأیید شد.[۶۵] نامهای دیگری که برای آنفلوآنزا به کار رفتهاند عبارتند از: epidemic catarrh, la grippe از فرانسوی، بیماری عرق کردن (sweating sickness)، و بهویژه وقتی به سویه پاندمی ۱۹۱۸ اشاره میشود و تب اسپانیایی (Spanish fever).[۶۶]
پژوهشها
[ویرایش]
تحقیقات آنفلوآنزا شامل تلاشهایی برای درک چگونگی ورود ویروسهای آنفلوآنزا به میزبان، رابطه بین ویروسهای آنفلوآنزا و باکتریها، چگونگی پیشرفت علائم آنفلوآنزا و اینکه چرا برخی از ویروسهای آنفلوآنزا از بقیه کشندهتر هستند، میشود.[۶۷] پروتئینهای غیرساختاری کدگذاری شده توسط ویروسهای آنفلوآنزا بهطور دورهای کشف میشوند و عملکرد آنها بهطور مستمر تحت تحقیق است.[۲۳] پاندمیهای گذشته و بهویژه پاندمی ۱۹۱۸، موضوع تحقیقات زیادی برای درک همهگیری آنفلوآنزا هستند.[۴۸] به عنوان بخشی از آمادگی برای پاندمی، سیستم نظارت و پاسخ جهانی آنفلوآنزا یک شبکه جهانی از آزمایشگاهها است که انتقال و اپیدمیولوژی آنفلوآنزا را نظارت میکند[۶۸] زمینههای تحقیقاتی اضافی شامل راههایی برای بهبود تشخیص، درمان و پیشگیری از آنفلوآنزا است.
روشهای تشخیصی موجود دارای محدودیتهای مختلفی همراه با مزایایی هستند. به عنوان مثال، NATها حساسیت و ویژگی بالایی دارند، اما در مناطقی که منابع کمتری دارند، به دلیل هزینه بالا، پیچیدگی، نگهداری و آموزش مورد نیاز، غیرعملی هستند. RIDTهای کم هزینه و قابل حمل میتوانند به سرعت آنفلوآنزا را تشخیص دهند، اما حساسیت بسیار متغیری دارند و قادر به ایجاد زیرگروه IAV نیستند. در نتیجه این محدودیتها و سایر محدودیتها، تحقیق در مورد روشهای تشخیصی جدید حول محور تولید روشهای جدید است که مقرونبهصرفه، فشردهتر و پیچیدهتر از روشهای موجود هستند و در عین حال میتوانند گونههای آنفلوآنزا و زیرگروههای IAV را متمایز کنند. یکی از رویکردهای توسعه، آزمایشگاه روی تراشه است که دستگاههای تشخیصی هستند که از انواع آزمایشهای تشخیصی مانند RT-PCR و سنجشهای سرولوژیکی به شکل ریزتراشه استفاده میکنند. این تراشهها دارای مزایای بالقوه زیادی، از جمله بازدهی واکنش بالا، مصرف انرژی پایین و تولید ضایعات کم، است.[۴۲]
داروهای ضد ویروسی جدید نیز به دلیل حذف آدامانتینها به عنوان داروهای قابل دوام و نگرانی در مورد مقاومت اسلتامیویر، در حال توسعه هستند. اینها عبارتند از: مهارکنندههای NA که میتوانند به صورت داخل وریدی تزریق شوند، مانند فرمولاسیون داخل وریدی زانامیویر. فاویپیراویر (favipiravir) که یک مهارکننده پلیمراز است که علیه چندین ویروس آرانای استفاده میشود. پیمودیویر (pimodivir) که از اتصال کلاهک مورد نیاز در هنگام رونویسی ویروسی جلوگیری میکند و نیتازوکسانید (nitazoxanide)، که بلوغ HA را مهار میکند.[۱][۱۳] کاهش التهاب اضافی در دستگاه تنفسی نیز در معرض تحقیقات زیادی است زیرا این یکی از مکانیسمهای اولیه پاتولوژی آنفلوآنزا است.[۱۳][۱۵] سایر اشکال درمان در حال توسعه عبارتند از آنتیبادیهای مونوکلونال و پلیکلونال که پروتئینهای ویروسی را هدف قرار میدهند، پلاسمای افراد بهبود یافته، رویکردهای مختلف برای اصلاح پاسخ ضد ویروسی میزبان،[۳۵][۶۹] و درمانهای مبتنی بر سلولهای بنیادی برای ترمیم آسیب ریه.[۱۳]
تحقیقات زیادی روی LAIVها بر شناسایی توالیهای ژنومی تمرکز دارد که میتوانند حذف شوند تا ویروسهای بیضرر آنفلوآنزا در واکسنهایی ایجاد شود که همچنان مصونیت ایجاد میکنند.[۲۳] با این حال، تنوع بالا و تکامل سریع آنتیژنهای ویروس آنفلوآنزا، مانع اصلی در توسعه واکسنهای مؤثر است. علاوه بر این، پیشبینی اینکه کدام سویهها در فصل آنفلوآنزای بعدی در گردش خواهند بود، دشوار است که این، تولید مقدار کافی واکسن آنفلوآنزا برای فصل آینده را دشوار میکند. ,[۲] LAIVها کارایی محدودی دارند و واکسیناسیون سالانه مکرر بهطور بالقوه کارایی را کاهش داده است.[۱] به این دلایل، واکسنهای «واکنش گسترده» یا «جهانی» آنفلوآنزا در حال تحقیق هستند که میتوانند در برابر بسیاری یا همه ویروسهای آنفلوآنزا، ایمنی ایجاد کنند. روشهای ساخت چنین واکسنی شامل روشهای مختلفی است که عبارتند از: روشهای مبتنی بر پایه HA مانند واهیهایی است که پایههای مشابهی دارند اما سرهای متفاوتی دارند، روشهای مبتنی بر سر HA مانند آنتیژنهای خنثیکننده گسترده محاسباتی، آنتیبادیهای ضد ایدوتیپی (anti-idiotypic antibodies) و واکسنهایی برای برانگیختن پاسخهای ایمنی به شدت بالا به پروتئینهای ویروسی حفاظت شده.[۲][۶۹] واکسنهای mRNA برای محافظت در برابر آنفلوآنزا نیز تحت تحقیق هستند.[۷۰]
در سالهای اخیر، بحثهایی بر سر توجیههای اخلاقی برای برخی مطالعات «کسب عملکرد» (GOF; gain-of-function) در مورد آنفلوآنزا به وجود آمده است.[۷۱]
در حیوانات
[ویرایش]پرندگان
[ویرایش]پرندگان آبزی مانند اردکها، غازها، پرندگان ساحلی و مرغان دریایی مخزن اصلی IAVها هستند.[۱۷][۱۸] پرندگان مهاجر میتوانند آنفلوآنزا را در فواصل طولانی پخش کنند. یک نمونه از این موارد زمانی بود که یک سویه H5N1 در سال ۲۰۰۵ پرندگان را در دریاچهٔ چینگهای چین که محل توقف و تکثیر بسیاری از پرندگان مهاجر است، آلوده کرده و متعاقباً ویروس را به بیش از ۲۰ کشور در سراسر آسیا، اروپا و خاورمیانه گسترش داد.[۱۷][۲۷] AIVها میتوانند از پرندگان وحشی به اردکهای اهلی و به نوبهٔ خود از طریق آب آلوده، ذرات معلق در هوا و فومیتها به طیور منتقل شوند.[۱] بنابراین، اردکها به عنوان واسطههای کلیدی بین پرندگان وحشی و اهلی عمل میکنند.[۲۷] انتقال به طیور معمولاً در مزارع و بازارهای حیوانات زنده رخ میدهد که در آن گونههای مختلف با یکدیگر تعامل دارند. از آنجا، AIVها میتوانند در صورت عدم وجود امنیت زیستی کافی، به مرغداریها سرایت کنند. در بین طیور، انتقال HPAI از طریق ذرات معلق در هوا و مدفوع آلوده،[۱] cقفس، خوراک و حیوانات مرده اتفاق میافتد.[۱۷] انتقال مجدد ویروس HPAI از طیور به پرندگان وحشی رخ داده است و در مرگهای جمعی و گسترش بین قارهای نقش دارد.[۱۸]
AIVها گهگاه انسان را از طریق ذرات معلق در هوا، فومیتها و آب آلوده، آلوده کردهاند.[۱] انتقال مستقیم از پرندگان وحشی نادر است.[۲۷] در عوض، بیشتر انتقال شامل طیور اهلی، عمدتاً جوجهها، اردکها، و غازها و همچنین انواع پرندگان دیگر مانند مرغ دریایی، کبک، قرقاول و بلدرچین است.[۱۸] عامل خطر اولیه برای عفونت با AIVها قرار گرفتن در معرض پرندگان در مزارع و بازارهای مرغ زنده است.[۱۷] بهطور معمول، عفونت با AIV یک دوره نهفتگی ۳–۵ روزه دارد اما میتواند تا ۹ روز باشد. H5N1 و H7N9 باعث بیماری شدید دستگاه تنفسی تحتانی میشوند، در حالی که سایر AIVها مانند H9N2 باعث بیماری خفیفتر دستگاه تنفسی فوقانی، معمولاً با التهاب ملتحمه (conjunctivitis) میشوند.[۱] انتقال محدود زیرگروههای H2، H5-7، H9 و H10 پرندگان از یک فرد به فرد دیگر از طریق قطرات تنفسی، ذرات معلق در هوا و فومیتها رخ داده است،[۱][۲] اما انتقال پایدار از انسان به انسان AIVها رخ نداده است. قبل از سال ۲۰۱۳، H5N1 شایعترین AIV بود که انسان را آلوده میکرد. از آن زمان، H7N9 مسئول بیشتر موارد انسانی بوده است.[۱۷]
خوکها
[ویرایش]
آنفلوآنزا در خوکها یک بیماری تنفسی مشابه آنفلوآنزا در انسان است و در سراسر جهان یافت میشود. عفونتهای بدون علامت شایع هستند. علائم معمولاً ۱ تا ۳ روز پس از عفونت ظاهر شده و شامل تب، بی حالی، بی اشتهایی، کاهش وزن، تنفس سخت، سرفه، عطسه و ترشحات بینی میشود. در خروسها، بارداری ممکن است سقط شود. عوارض شامل عفونتهای ثانویه و برونکوپنومونی بالقوه کشنده است. خوکها در عرض یک روز پس از عفونت مسری شده و بهطور معمول ویروس را به مدت ۷ تا ۱۰ روز پخش میکنند که میتواند به سرعت در یک گله پخش شود. خوکها معمولاً در عرض ۳ تا ۷ روز پس از ظاهر شدن علائم از عفونت بهبود مییابند. اقدامات پیشگیری و کنترل شامل واکسنهای غیرفعال و از بین بردن گلههای آلوده است. ویروسهای آنفلوآنزای مسئول آنفلوآنزای خوکی معمولاً زیرگروههای IAV H1N1، H1N2 و H3N2 هستند.[۷۲]
برخی از IAVها میتوانند از طریق ذرات معلق در هوا از خوک به انسان و بالعکس منتقل شوند.[۱] علاوه بر این، خوکها، همراه با خفاشها و بلدرچینها،[۱۹] aبهعنوان مخزن اختلاط ویروسهای آنفلوآنزا شناخته میشوند، زیرا آنها هر دو گیرندههای اسید سیالیک α-۲٬۳ و α-۲٬۶ در دستگاه تنفسی خود دارند. به همین دلیل، هر دو ویروس آنفلوآنزای پرندگان و پستانداران میتوانند خوکها را آلوده کنند. اگر عفونت همزمان اتفاق بیفتد، در این صورت طبقهبندی مجدد امکانپذیر است.[۱۸] یک مثال قابل توجه از این، دستهبندی مجدد یک ویروس آنفلوآنزای خوکی، پرندگان و انسانی در سال ۲۰۰۹ بود که منجر به یک سویه جدید H1N1 شد که باعث همهگیری آنفلوآنزای ۲۰۰۹ شد.[۴][۱۸] با این حال، به نظر میرسد که رویدادهای سرریز (spillover events) از انسان به خوک بیشتر از خوکها به انسان باشد.[۱۸]
سایر حیوانات
[ویرایش]ویروس آنفلوآنزا در بسیاری از حیوانات دیگر از جمله گاو، اسب، سگ، گربه و پستانداران دریایی یافت شده است. تقریباً همه IAVها ظاهراً از ویروسهای اجدادی در پرندگان منشأ میگیرند. استثنا، ویروسهای آنفلوآنزای خفاش هستند که منشأ نامشخصی دارند. این ویروسهای خفاش دارای زیرگروههای HA و NA H17، H18، N10 و N11 هستند. H17N10 و H18N11 قادر به تطبیق مجدد با سایر IAVها نیستند، اما همچنان قادر به تکثیر در پستانداران دیگر هستند.[۱] AIVها گاهی به پستانداران منتقل میشوند. به عنوان مثال، در اواخر سال ۲۰۱۶ تا اوایل سال ۲۰۱۷، یک سویه پرندگان H7N2 گربهها را در نیویورک آلوده میکرد.[۱]
IAVهای اسب شامل H7N7 و دو دودمان[۱] از H3N8 هستند. با این حال، H7N7 از اواخر دهه ۱۹۷۰ در اسبها شناسایی نشده است،[۲۱] نابراین ممکن است در اسبها منقرض شده باشد.[۱۸] H3N8 در اسبها از طریق ذرات معلق در هوا پخش شده و باعث بیماری تنفسی میشود.[۱] H3N8 اسب بهطور مبتکرانه به اسیدهای سیالیک α-۲٬۳ متصل میشود، بنابراین اسبها معمولاً میزبانهای بنبست در نظر گرفته میشوند، اما انتقال به سگها و شترها رخ داده است، و این نگرانیها را افزایش میدهد که اسبها ممکن است به عنوان رگهای اختلاط باشند. در سگها، تنها IAVهای موجود در گردش H3N8 مشتق شده از اسب و H3N2 مشتق شده از پرندگان هستند. H3N8 سگ، مشاهده نشده است که دوباره با زیرگروههای دیگر ترکیب شود. H3N2 دارای دامنه میزبان بسیار گستردهتری است و میتواند با H1N1 و H5N1 مجدداً ترکیب شود. یک مورد مجزا از H6N1 که احتمالاً از یک مرغ بود، در یک سگ یافت شد، بنابراین سایر AIVها ممکن است در سگها ظاهر شوند.[۱۸]
سایر پستاندارانی که توسط IAV آلوده میشوند عبارتند از H7N7 و H4N5 در فکها، H1N3 در نهنگها و H10N4 و H3N2 در راسوها.[۲۱] جهشهای مختلفی شناسایی شدهاند که با سازگاری AIVها با پستانداران مرتبط است. از آنجایی که پروتئینهای HA در اینکه در کدامیک از اسیدهای سیالیک به آن متصل میشوند، متفاوت است، جهش در محل اتصال گیرنده HA میتواند به AIVها اجازه دهد پستانداران را آلوده کنند. جهشهای دیگر شامل جهشهایی است که بر جدا شدن پروتئینهای NA اسیدهای سیالیک تأثیر میگذارند و یک جهش در زیرواحد پلیمراز PB2 که تحمل دماهای پایینتر را در مجاری تنفسی پستانداران بهبود میبخشد و با تثبیت اتصال NP و PB2، تجمع RNP را افزایش میدهد.[۱۸]
IBV عمدتاً در انسان یافت میشود، اما در خوکها، سگها، اسبها و فوکها نیز دیده شده است.[۱۹] به همین ترتیب، ICV در درجه اول انسانها را آلوده میکند، اما در خوکها، سگها، گاوها و شترهای تککوهانه هم مشاهده شده است.[۱۲][۱۹] IDV باعث ایجاد یک بیماری آنفلوآنزا مانند در خوکها میشود، اما تأثیر آن در مخزن طبیعی آن، یعنی گاو، نسبتاً ناشناخته است. ممکن است به خودی خود باعث بیماری تنفسی شبیه آنفلوآنزای انسانی شود، یا ممکن است بخشی از یک مجموعه بیماری تنفسی گاوی (BRD; bovine respiratory disease) با سایر پاتوژنها در طول عفونت همزمان باشد. BRD یک نگرانی برای صنعت گاو است، بنابراین مشارکت احتمالی IDV در BRD منجر به تحقیق بر روی واکسنهایی برای گاو شده است که میتواند محافظت در برابر IDV را فراهم کند.[۱۹][۲۰] دو دودمان آنتیژنی در گردش هستند: D/swine/Oklahoma/1334/2011 (D/OK) و D/bovine/Oklahoma/660/2013 (D/660).[۱۹]
منابع
[ویرایش]- ↑ ۱٫۰۰ ۱٫۰۱ ۱٫۰۲ ۱٫۰۳ ۱٫۰۴ ۱٫۰۵ ۱٫۰۶ ۱٫۰۷ ۱٫۰۸ ۱٫۰۹ ۱٫۱۰ ۱٫۱۱ ۱٫۱۲ ۱٫۱۳ ۱٫۱۴ ۱٫۱۵ ۱٫۱۶ ۱٫۱۷ ۱٫۱۸ ۱٫۱۹ ۱٫۲۰ ۱٫۲۱ ۱٫۲۲ ۱٫۲۳ ۱٫۲۴ ۱٫۲۵ ۱٫۲۶ ۱٫۲۷ ۱٫۲۸ ۱٫۲۹ ۱٫۳۰ ۱٫۳۱ ۱٫۳۲ ۱٫۳۳ ۱٫۳۴ ۱٫۳۵ ۱٫۳۶ ۱٫۳۷ ۱٫۳۸ ۱٫۳۹ ۱٫۴۰ ۱٫۴۱ ۱٫۴۲ ۱٫۴۳ ۱٫۴۴ ۱٫۴۵ ۱٫۴۶ ۱٫۴۷ ۱٫۴۸ ۱٫۴۹ ۱٫۵۰ ۱٫۵۱ ۱٫۵۲ ۱٫۵۳ ۱٫۵۴ ۱٫۵۵ ۱٫۵۶ ۱٫۵۷ ۱٫۵۸ ۱٫۵۹ ۱٫۶۰ ۱٫۶۱ ۱٫۶۲ ۱٫۶۳ ۱٫۶۴ ۱٫۶۵ ۱٫۶۶ ۱٫۶۷ ۱٫۶۸ ۱٫۶۹ ۱٫۷۰ ۱٫۷۱ ۱٫۷۲ ۱٫۷۳ ۱٫۷۴ ۱٫۷۵ ۱٫۷۶ ۱٫۷۷ ۱٫۷۸ ۱٫۷۹ ۱٫۸۰ ۱٫۸۱ ۱٫۸۲ ۱٫۸۳ ۱٫۸۴ ۱٫۸۵ ۱٫۸۶ ۱٫۸۷ ۱٫۸۸ ۱٫۸۹ ۱٫۹۰ ۱٫۹۱ ۱٫۹۲ ۱٫۹۳ ۱٫۹۴ Krammer F, Smith GJ, Fouchier RA, Peiris M, Kedzierska K, Doherty PC, et al. (June 2018). "Influenza". Nature Reviews. Disease Primers. 4 (1): 3. doi:10.1038/s41572-018-0002-y. PMC 7097467. PMID 29955068.
- ↑ ۲٫۰۰ ۲٫۰۱ ۲٫۰۲ ۲٫۰۳ ۲٫۰۴ ۲٫۰۵ ۲٫۰۶ ۲٫۰۷ ۲٫۰۸ ۲٫۰۹ ۲٫۱۰ ۲٫۱۱ ۲٫۱۲ ۲٫۱۳ ۲٫۱۴ Sautto GA, Kirchenbaum GA, Ross TM (January 2018). "Towards a universal influenza vaccine: different approaches for one goal". Virology Journal. 15 (1): 17. doi:10.1186/s12985-017-0918-y. PMC 5785881. PMID 29370862.
- ↑ ۳٫۰۰ ۳٫۰۱ ۳٫۰۲ ۳٫۰۳ ۳٫۰۴ ۳٫۰۵ ۳٫۰۶ ۳٫۰۷ ۳٫۰۸ ۳٫۰۹ ۳٫۱۰ ۳٫۱۱ ۳٫۱۲ ۳٫۱۳ ۳٫۱۴ ۳٫۱۵ Allen JD, Ross TM (2018). "H3N2 influenza viruses in humans: Viral mechanisms, evolution, and evaluation". Human Vaccines & Immunotherapeutics. 14 (8): 1840–1847. doi:10.1080/21645515.2018.1462639. PMC 6149781. PMID 29641358.
- ↑ ۴٫۰۰ ۴٫۰۱ ۴٫۰۲ ۴٫۰۳ ۴٫۰۴ ۴٫۰۵ ۴٫۰۶ ۴٫۰۷ ۴٫۰۸ ۴٫۰۹ ۴٫۱۰ ۴٫۱۱ ۴٫۱۲ ۴٫۱۳ ۴٫۱۴ ۴٫۱۵ ۴٫۱۶ Lampejo T (July 2020). "Influenza and antiviral resistance: an overview". European Journal of Clinical Microbiology & Infectious Diseases. 39 (7): 1201–1208. doi:10.1007/s10096-020-03840-9. PMC 7223162. PMID 32056049.
- ↑ "Flu Symptoms & Diagnosis". Centers for Disease Control and Prevention (CDC). 10 July 2019. Retrieved 24 January 2020.
- ↑ "Flu Symptoms & Complications". Centers for Disease Control and Prevention (CDC). 26 February 2019. Retrieved 6 July 2019.
- ↑ Call SA, Vollenweider MA, Hornung CA, Simel DL, McKinney WP (February 2005). "Does this patient have influenza?". JAMA. 293 (8): 987–997. doi:10.1001/jama.293.8.987. PMID 15728170.
- ↑ Allan GM, Arroll B (February 2014). "Prevention and treatment of the common cold: making sense of the evidence". CMAJ. 186 (3): 190–9. doi:10.1503/cmaj.121442. PMC 3928210. PMID 24468694.
- ↑ "Cold Versus Flu". 11 August 2016. Archived from the original on 6 January 2017. Retrieved 5 January 2017.
- ↑ ۱۰٫۰۰ ۱۰٫۰۱ ۱۰٫۰۲ ۱۰٫۰۳ ۱۰٫۰۴ ۱۰٫۰۵ ۱۰٫۰۶ ۱۰٫۰۷ ۱۰٫۰۸ ۱۰٫۰۹ ۱۰٫۱۰ ۱۰٫۱۱ ۱۰٫۱۲ ۱۰٫۱۳ ۱۰٫۱۴ ۱۰٫۱۵ ۱۰٫۱۶ ۱۰٫۱۷ ۱۰٫۱۸ ۱۰٫۱۹ ۱۰٫۲۰ ۱۰٫۲۱ ۱۰٫۲۲ Dharmapalan D (October 2020). "Influenza". Indian Journal of Pediatrics. 87 (10): 828–832. doi:10.1007/s12098-020-03214-1. PMC 7091034. PMID 32048225.
- ↑ ۱۱٫۰۰ ۱۱٫۰۱ ۱۱٫۰۲ ۱۱٫۰۳ ۱۱٫۰۴ ۱۱٫۰۵ ۱۱٫۰۶ ۱۱٫۰۷ ۱۱٫۰۸ ۱۱٫۰۹ ۱۱٫۱۰ ۱۱٫۱۱ ۱۱٫۱۲ ۱۱٫۱۳ ۱۱٫۱۴ ۱۱٫۱۵ ۱۱٫۱۶ ۱۱٫۱۷ ۱۱٫۱۸ ۱۱٫۱۹ ۱۱٫۲۰ ۱۱٫۲۱ ۱۱٫۲۲ ۱۱٫۲۳ ۱۱٫۲۴ ۱۱٫۲۵ ۱۱٫۲۶ ۱۱٫۲۷ ۱۱٫۲۸ ۱۱٫۲۹ ۱۱٫۳۰ Ghebrehewet S, MacPherson P, Ho A (December 2016). "Influenza". BMJ. 355: i6258. doi:10.1136/bmj.i6258. PMC 5141587. PMID 27927672.
- ↑ ۱۲٫۰۰ ۱۲٫۰۱ ۱۲٫۰۲ ۱۲٫۰۳ ۱۲٫۰۴ ۱۲٫۰۵ ۱۲٫۰۶ ۱۲٫۰۷ ۱۲٫۰۸ ۱۲٫۰۹ Sederdahl BK, Williams JV (January 2020). "Epidemiology and Clinical Characteristics of Influenza C Virus". Viruses. 12 (1): 89. doi:10.3390/v12010089. PMC 7019359. PMID 31941041.
- ↑ ۱۳٫۰۰ ۱۳٫۰۱ ۱۳٫۰۲ ۱۳٫۰۳ ۱۳٫۰۴ ۱۳٫۰۵ ۱۳٫۰۶ ۱۳٫۰۷ ۱۳٫۰۸ ۱۳٫۰۹ ۱۳٫۱۰ ۱۳٫۱۱ ۱۳٫۱۲ ۱۳٫۱۳ ۱۳٫۱۴ ۱۳٫۱۵ ۱۳٫۱۶ ۱۳٫۱۷ ۱۳٫۱۸ ۱۳٫۱۹ Peteranderl C, Herold S, Schmoldt C (August 2016). "Human Influenza Virus Infections". Seminars in Respiratory and Critical Care Medicine. 37 (4): 487–500. doi:10.1055/s-0036-1584801. PMC 7174870. PMID 27486731.
- ↑ People also suffer 'long flu', study shows BBC
- ↑ ۱۵٫۰۰ ۱۵٫۰۱ ۱۵٫۰۲ ۱۵٫۰۳ ۱۵٫۰۴ ۱۵٫۰۵ ۱۵٫۰۶ ۱۵٫۰۷ ۱۵٫۰۸ ۱۵٫۰۹ ۱۵٫۱۰ ۱۵٫۱۱ Kalil AC, Thomas PG (July 2019). "Influenza virus-related critical illness: pathophysiology and epidemiology". Critical Care. 23 (1): 258. doi:10.1186/s13054-019-2539-x. PMC 6642581. PMID 31324202.
- ↑ "Virus Taxonomy: 2019 Release". International Committee on Taxonomy of Viruses. Retrieved 9 March 2021.
- ↑ ۱۷٫۰۰ ۱۷٫۰۱ ۱۷٫۰۲ ۱۷٫۰۳ ۱۷٫۰۴ ۱۷٫۰۵ ۱۷٫۰۶ ۱۷٫۰۷ ۱۷٫۰۸ ۱۷٫۰۹ ۱۷٫۱۰ ۱۷٫۱۱ ۱۷٫۱۲ ۱۷٫۱۳ ۱۷٫۱۴ ۱۷٫۱۵ Li YT, Linster M, Mendenhall IH, Su YC, Smith GJ (December 2019). "Avian influenza viruses in humans: lessons from past outbreaks". British Medical Bulletin. 132 (1): 81–95. doi:10.1093/bmb/ldz036. PMC 6992886. PMID 31848585.
- ↑ ۱۸٫۰۰ ۱۸٫۰۱ ۱۸٫۰۲ ۱۸٫۰۳ ۱۸٫۰۴ ۱۸٫۰۵ ۱۸٫۰۶ ۱۸٫۰۷ ۱۸٫۰۸ ۱۸٫۰۹ ۱۸٫۱۰ ۱۸٫۱۱ ۱۸٫۱۲ Joseph U, Su YC, Vijaykrishna D, Smith GJ (January 2017). "The ecology and adaptive evolution of influenza A interspecies transmission". Influenza and Other Respiratory Viruses. 11 (1): 74–84. doi:10.1111/irv.12412. PMC 5155642. PMID 27426214.
- ↑ ۱۹٫۰۰ ۱۹٫۰۱ ۱۹٫۰۲ ۱۹٫۰۳ ۱۹٫۰۴ ۱۹٫۰۵ ۱۹٫۰۶ ۱۹٫۰۷ ۱۹٫۰۸ ۱۹٫۰۹ ۱۹٫۱۰ ۱۹٫۱۱ ۱۹٫۱۲ ۱۹٫۱۳ ۱۹٫۱۴ ۱۹٫۱۵ ۱۹٫۱۶ ۱۹٫۱۷ ۱۹٫۱۸ Asha K, Kumar B (February 2019). "Emerging Influenza D Virus Threat: What We Know so Far!". Journal of Clinical Medicine. 8 (2): 192. doi:10.3390/jcm8020192. PMC 6406440. PMID 30764577.
- ↑ ۲۰٫۰۰ ۲۰٫۰۱ ۲۰٫۰۲ ۲۰٫۰۳ ۲۰٫۰۴ ۲۰٫۰۵ ۲۰٫۰۶ ۲۰٫۰۷ ۲۰٫۰۸ ۲۰٫۰۹ ۲۰٫۱۰ Su S, Fu X, Li G, Kerlin F, Veit M (November 2017). "Novel Influenza D virus: Epidemiology, pathology, evolution and biological characteristics". Virulence. 8 (8): 1580–1591. doi:10.1080/21505594.2017.1365216. PMC 5810478. PMID 28812422.
- ↑ ۲۱٫۰ ۲۱٫۱ ۲۱٫۲ ۲۱٫۳ ۲۱٫۴ ۲۱٫۵ ۲۱٫۶ ۲۱٫۷ ۲۱٫۸ McCauley JW, Hongo S, Kaverin NV, Kochs G, Lamb RA, Matrosovich MN, Perez DR, Palese P, Presti PM, Rimstad E, Smith GJ (2011). "Orthomyxoviridae". International Committee on Taxonomy of Viruses. Retrieved 9 March 2021.
- ↑ ۲۲٫۰ ۲۲٫۱ ۲۲٫۲ ۲۲٫۳ ۲۲٫۴ ۲۲٫۵ ۲۲٫۶ Shim JM, Kim J, Tenson T, Min JY, Kainov DE (August 2017). "Influenza Virus Infection, Interferon Response, Viral Counter-Response, and Apoptosis". Viruses. 9 (8): 223. doi:10.3390/v9080223. PMC 5580480. PMID 28805681.
- ↑ ۲۳٫۰ ۲۳٫۱ ۲۳٫۲ ۲۳٫۳ ۲۳٫۴ ۲۳٫۵ ۲۳٫۶ Hao W, Wang L, Li S (October 2020). "Roles of the Non-Structural Proteins of Influenza A Virus". Pathogens. 9 (10): 812. doi:10.3390/pathogens9100812. PMC 7600879. PMID 33023047.
- ↑ Dadonaite B, Vijayakrishnan S, Fodor E, Bhella D, Hutchinson EC (August 2016). "Filamentous influenza viruses". The Journal of General Virology. 97 (8): 1755–1764. doi:10.1099/jgv.0.000535. PMC 5935222. PMID 27365089.
- ↑ ۲۵٫۰ ۲۵٫۱ Yoo E (February 2014). "Conformation and Linkage Studies of Specific Oligosaccharides Related to H1N1, H5N1, and Human Flu for Developing the Second Tamiflu". Biomolecules & Therapeutics. 22 (2): 93–99. doi:10.4062/biomolther.2014.005. PMC 3975476. PMID 24753813.
- ↑ ۲۶٫۰۰ ۲۶٫۰۱ ۲۶٫۰۲ ۲۶٫۰۳ ۲۶٫۰۴ ۲۶٫۰۵ ۲۶٫۰۶ ۲۶٫۰۷ ۲۶٫۰۸ ۲۶٫۰۹ Saunders-Hastings PR, Krewski D (December 2016). "Reviewing the History of Pandemic Influenza: Understanding Patterns of Emergence and Transmission". Pathogens. 5 (4): 66. doi:10.3390/pathogens5040066. PMC 5198166. PMID 27929449.
- ↑ ۲۷٫۰۰ ۲۷٫۰۱ ۲۷٫۰۲ ۲۷٫۰۳ ۲۷٫۰۴ ۲۷٫۰۵ ۲۷٫۰۶ ۲۷٫۰۷ ۲۷٫۰۸ ۲۷٫۰۹ ۲۷٫۱۰ Lycett SJ, Duchatel F, Digard P (June 2019). "A brief history of bird flu". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 374 (1775): 20180257. doi:10.1098/rstb.2018.0257. PMC 6553608. PMID 31056053.
- ↑ ۲۸٫۰ ۲۸٫۱ ۲۸٫۲ ۲۸٫۳ Kutter JS, Spronken MI, Fraaij PL, Fouchier RA, Herfst S (February 2018). "Transmission routes of respiratory viruses among humans". Current Opinion in Virology. 28: 142–151. doi:10.1016/j.coviro.2018.01.001. PMC 7102683. PMID 29452994.
- ↑ ۲۹٫۰ ۲۹٫۱ ۲۹٫۲ Killingley B, Nguyen-Van-Tam J (September 2013). "Routes of influenza transmission". Influenza and Other Respiratory Viruses. 7 (Suppl 2): 42–51. doi:10.1111/irv.12080. PMC 5909391. PMID 24034483.
- ↑ Weber TP, Stilianakis NI (November 2008). "Inactivation of influenza A viruses in the environment and modes of transmission: a critical review". The Journal of Infection. 57 (5): 361–373. doi:10.1016/j.jinf.2008.08.013. PMC 7112701. PMID 18848358.
- ↑ ۳۱٫۰ ۳۱٫۱ Moriyama M, Hugentobler WJ, Iwasaki A (September 2020). "Seasonality of Respiratory Viral Infections" (PDF). Annual Review of Virology. 7 (1): 83–101. doi:10.1146/annurev-virology-012420-022445. PMID 32196426.
- ↑ Shao W, Li X, Goraya MU, Wang S, Chen JL (August 2017). "Evolution of Influenza A Virus by Mutation and Re-Assortment". International Journal of Molecular Sciences. 18 (8): 1650. doi:10.3390/ijms18081650. PMC 5578040. PMID 28783091.
- ↑ ۳۳٫۰ ۳۳٫۱ Steinhauer DA (May 1999). "Role of hemagglutinin cleavage for the pathogenicity of influenza virus". Virology. 258 (1): 1–20. doi:10.1006/viro.1999.9716. PMID 10329563.
- ↑ Einav T, Gentles LE, Bloom JD (July 2020). "SnapShot: Influenza by the Numbers". Cell. 182 (2): 532–532.e1. doi:10.1016/j.cell.2020.05.004. PMID 32707094. S2CID 220715148.
- ↑ ۳۵٫۰۰ ۳۵٫۰۱ ۳۵٫۰۲ ۳۵٫۰۳ ۳۵٫۰۴ ۳۵٫۰۵ ۳۵٫۰۶ ۳۵٫۰۷ ۳۵٫۰۸ ۳۵٫۰۹ ۳۵٫۱۰ ۳۵٫۱۱ ۳۵٫۱۲ ۳۵٫۱۳ ۳۵٫۱۴ ۳۵٫۱۵ Chow EJ, Doyle JD, Uyeki TM (June 2019). "Influenza virus-related critical illness: prevention, diagnosis, treatment". Critical Care. 23 (1): 214. doi:10.1186/s13054-019-2491-9. PMC 6563376. PMID 31189475.
- ↑ Tregoning JS, Russell RF, Kinnear E (March 2018). "Adjuvanted influenza vaccines". Human Vaccines & Immunotherapeutics. 14 (3): 550–564. doi:10.1080/21645515.2017.1415684. PMC 5861793. PMID 29232151.
- ↑ ۳۷٫۰ ۳۷٫۱ Principi N, Esposito S (March 2018). "Protection of children against influenza: Emerging problems". Human Vaccines & Immunotherapeutics. 14 (3): 750–757. doi:10.1080/21645515.2017.1279772. PMC 5861800. PMID 28129049.
- ↑ Barr IG, Donis RO, Katz JM, McCauley JW, Odagiri T, Trusheim H, et al. (9 October 2018). "Cell culture-derived influenza vaccines in the severe 2017-2018 epidemic season: a step towards improved influenza vaccine effectiveness". npj Vaccines. 3: 44. doi:10.1038/s41541-018-0079-z. PMC 6177469. PMID 30323955.
- ↑ ۳۹٫۰ ۳۹٫۱ ۳۹٫۲ Jefferson T, Dooley L, Ferroni E, Al-Ansary LA, van Driel ML, Bawazeer GA, et al. (January 2023). "Physical interventions to interrupt or reduce the spread of respiratory viruses". The Cochrane Database of Systematic Reviews. 1 (1): CD006207. doi:10.1002/14651858.CD006207.pub6. PMC 9885521. PMID 36715243.
- ↑ ۴۰٫۰ ۴۰٫۱ Saunders-Hastings P, Crispo JA, Sikora L, Krewski D (September 2017). "Effectiveness of personal protective measures in reducing pandemic influenza transmission: A systematic review and meta-analysis". Epidemics. 20: 1–20. doi:10.1016/j.epidem.2017.04.003. hdl:10393/38995. PMID 28487207.
- ↑ "Avian Influenza (AI)". U.S. Department of Agriculture, Animal and Plant Health Inspection Service. Retrieved 9 March 2021.
- ↑ ۴۲٫۰۰ ۴۲٫۰۱ ۴۲٫۰۲ ۴۲٫۰۳ ۴۲٫۰۴ ۴۲٫۰۵ ۴۲٫۰۶ ۴۲٫۰۷ ۴۲٫۰۸ ۴۲٫۰۹ ۴۲٫۱۰ ۴۲٫۱۱ Vemula SV, Zhao J, Liu J, Wang X, Biswas S, Hewlett I (April 2016). "Current Approaches for Diagnosis of Influenza Virus Infections in Humans". Viruses. 8 (4): 96. doi:10.3390/v8040096. PMC 4848591. PMID 27077877.
- ↑ ۴۳٫۰ ۴۳٫۱ "Flu: MedlinePlus Medical Encyclopedia". U.S. National Library of Medicine. Archived from the original on 14 February 2010. Retrieved 7 February 2010.
- ↑ Banday AZ, Arul A, Vignesh P, Singh MP, Goyal K, Singh S (July 2021). "Kawasaki disease and influenza-new lessons from old associations". Clinical Rheumatology. 40 (7): 2991–2999. doi:10.1007/s10067-020-05534-1. PMC 7778392. PMID 33387094.
- ↑ "Laninamivir". National Center for Advancing Translational Sciences. Retrieved 9 March 2021.
- ↑ "Estimated Influenza Illnesses, Medical visits, Hospitalizations, and Deaths in the United States – 2018–2019 influenza season". Centers for Disease Control and Prevention (CDC). 9 January 2020. Retrieved 5 March 2020.
- ↑ "Up to 650 000 people die of respiratory diseases linked to seasonal flu each year". Geneva: World Health Organization. 13 December 2017. Retrieved 16 June 2021.
- ↑ ۴۸٫۰۰ ۴۸٫۰۱ ۴۸٫۰۲ ۴۸٫۰۳ ۴۸٫۰۴ ۴۸٫۰۵ ۴۸٫۰۶ ۴۸٫۰۷ ۴۸٫۰۸ ۴۸٫۰۹ ۴۸٫۱۰ Potter CW (October 2001). "A history of influenza". Journal of Applied Microbiology. 91 (4): 572–579. doi:10.1046/j.1365-2672.2001.01492.x. PMID 11576290. S2CID 26392163.
- ↑ Palese P (December 2004). "Influenza: old and new threats". Nature Medicine. 10 (12 Suppl): S82–S87. doi:10.1038/nm1141. PMID 15577936. S2CID 1668689.
- ↑ Mordini E, Green M, eds. (2013). Internet-Based Intelligence in Public Health Emergencies: Early Detection and Response in Disease Outbreak Crises. IOS Press. p. 67. ISBN 978-1-61499-175-5.
- ↑ Martin PM, Martin-Granel E (June 2006). "2,500-year evolution of the term epidemic". Emerging Infectious Diseases. 12 (6): 976–980. doi:10.3201/eid1206.051263. PMC 3373038. PMID 16707055.
- ↑ ۵۲٫۰ ۵۲٫۱ ۵۲٫۲ Morens DM, North M, Taubenberger JK (December 2010). "Eyewitness accounts of the 1510 influenza pandemic in Europe". Lancet. 376 (9756): 1894–1895. doi:10.1016/S0140-6736(10)62204-0. PMC 3180818. PMID 21155080.
- ↑ Guerra F (1988). "The earliest American epidemic. The influenza of 1493". Social Science History. 12 (3): 305–325. doi:10.2307/1171451. JSTOR 1171451. PMID 11618144.
- ↑ Guerra F (1993). "The European-American exchange". History and Philosophy of the Life Sciences. 15 (3): 313–327. PMID 7529930.
- ↑ ۵۵٫۰ ۵۵٫۱ ۵۵٫۲ ۵۵٫۳ ۵۵٫۴ Morens DM, Taubenberger JK, Folkers GK, Fauci AS (December 2010). "Pandemic influenza's 500th anniversary". Clinical Infectious Diseases. 51 (12): 1442–1444. doi:10.1086/657429. PMC 3106245. PMID 21067353.
- ↑ ۵۶٫۰ ۵۶٫۱ ۵۶٫۲ ۵۶٫۳ Institute of Medicine (US) Forum on Microbial Threats (2005). "1: The Story of Influenza". In Knobler S, Mack A, Mahmoud A, Lemon S (eds.). The Threat of Pandemic Influenza: Are We Ready? Workshop Summary (2005). Washington, DC: The National Academies Press. pp. 60–61. doi:10.17226/11150. ISBN 978-0-309-09504-4. PMID 20669448.
- ↑ ۵۷٫۰۰ ۵۷٫۰۱ ۵۷٫۰۲ ۵۷٫۰۳ ۵۷٫۰۴ ۵۷٫۰۵ ۵۷٫۰۶ ۵۷٫۰۷ ۵۷٫۰۸ ۵۷٫۰۹ ۵۷٫۱۰ ۵۷٫۱۱ Taubenberger JK, Hultin JV, Morens DM (2007). "Discovery and characterization of the 1918 pandemic influenza virus in historical context". Antiviral Therapy. 12 (4 Pt B): 581–591. doi:10.1177/135965350701200S02.1. PMC 2391305. PMID 17944266.
- ↑ Vijgen L, Keyaerts E, Moës E, Thoelen I, Wollants E, Lemey P, et al. (February 2005). "Complete genomic sequence of human coronavirus OC43: molecular clock analysis suggests a relatively recent zoonotic coronavirus transmission event". Journal of Virology. 79 (3): 1595–1604. doi:10.1128/JVI.79.3.1595-1604.2005. PMC 544107. PMID 15650185.
- ↑ Taubenberger JK, Morens DM (January 2006). "1918 Influenza: the mother of all pandemics". Emerging Infectious Diseases. 12 (1): 15–22. doi:10.3201/eid1201.050979. PMC 3291398. PMID 16494711.
- ↑ Smith W, Andrewes CH, Laidlaw PP (1933). "A virus obtained from influenza patients". Lancet. 2 (5732): 66–68. doi:10.1016/S0140-6736(00)78541-2.
- ↑ Heinen PP (15 September 2003). "Swine influenza: a zoonosis". Veterinary Sciences Tomorrow. ISSN 1569-0830. Archived from the original on 11 February 2007. Retrieved 28 December 2016.
- ↑ Vázquez-Espinosa E, Laganà C, Vázquez F (October 2020). "The Spanish flu and the fiction literature". Revista Espanola de Quimioterapia. 33 (5): 296–312. doi:10.37201/req/049.2020. PMC 7528412. PMID 32633114.
- ↑ "influenza (n.)". Online Etymology Dictionary. Retrieved 9 March 2021.
- ↑ "influenza". Oxford English Dictionary. Archived from the original on 16 October 2021. Retrieved 9 March 2021.
- ↑ "flu (n.)". Online Etymology Dictionary. Retrieved 20 July 2021.
- ↑ Calisher CH (August 2009). "Swine flu". Croatian Medical Journal. 50 (4): 412–415. doi:10.3325/cmj.2009.50.412. PMC 2728380. PMID 19673043.
- ↑ "Influenza Basic Research". National Institute of Allergy and Infectious Diseases. 13 March 2017. Retrieved 24 March 2021.
- ↑ "Global Influenza Surveillance and Response System (GISRS)". World Health Organization. Archived from the original on 3 October 2011. Retrieved 24 March 2021.
- ↑ ۶۹٫۰ ۶۹٫۱ Nachbagauer R, Krammer F (April 2017). "Universal influenza virus vaccines and therapeutic antibodies". Clinical Microbiology and Infection. 23 (4): 222–228. doi:10.1016/j.cmi.2017.02.009. PMC 5389886. PMID 28216325.
- ↑ Rosa SS, Prazeres DM, Azevedo AM, Marques MP (April 2021). "mRNA vaccines manufacturing: Challenges and bottlenecks". Vaccine. 39 (16): 2190–2200. doi:10.1016/j.vaccine.2021.03.038. PMC 7987532. PMID 33771389.
- ↑ Evans NG, Pence CH (May 2023). "Gain-of-function research and model organisms in biology". Journal of Medical Ethics. 50 (3): jme–2022–108853. doi:10.1136/jme-2022-108853. PMID 37188506. S2CID 258688081.
- ↑ "Swine influenza". World Organisation for Animal Health. Retrieved 9 March 2021.
جستارهای وابسته
[ویرایش]پیوند به بیرون
[ویرایش]- وبگاه آفتاب بایگانیشده در ۶ نوامبر ۲۰۰۸ توسط Wayback Machine
- آنفلوانزا، دانشنامه رشد
برای مطالعه بیشتر
[ویرایش]- Brown J (2018). Influenza: The Hundred Year Hunt to Cure the Deadliest Disease in History. New York: Atria. ISBN 978-1-5011-8124-5.
- Mouritz, A. A. St. M. (1921). The Flu: A Brief History of Influenza in U.S. America, Europe, Hawaii. Honolulu, Hawaii, U.S. America: Advertiser Publishing Co.


 French
French Deutsch
Deutsch