Carcinome hépatocellulaire — Wikipédia
| Symptômes | Hépatomégalie, amaigrissement, douleur abdominale, sueur et ictère |
|---|
| Médicament | Ginsenoside Rg3 (d), sorafénib et Y-90 microshperes in the treatment of unresectable hepatocellular carcinoma (d) |
|---|---|
| Spécialité | Oncologie |
| CIM-10 | C22.0 |
|---|---|
| CIM-9 | 155 |
| ICD-O | M8170/3 |
| OMIM | 114550 |
| DiseasesDB | 7547 |
| MedlinePlus | 000280 |
| eMedicine | 278354 |
| MeSH | D006528 |
Le carcinome hépatocellulaire (CHC) ou hépatocarcinome (en anglais, hepatocellular carcinoma ou HCC) est un cancer primitif du foie. C'est le type de cancer du foie primaire le plus fréquent chez les adultes et la cause de décès la plus fréquente chez les personnes atteintes de cirrhose[1].
Ce cancer survient dans le cadre d'une inflammation chronique du foie et est plus étroitement liée à une hépatite virale chronique (hépatite B ou C) ou à une exposition à des toxines comme l'alcool ou l'aflatoxine. Certaines maladies, comme l'hémochromatose et le déficit en alpha-1-antitrypsine, augmentent considérablement le risque de développer un CHC. Le syndrome métabolique et la NASH sont également de plus en plus reconnus comme des facteurs de risque de CHC[2].
Comme pour tout cancer, le traitement et le pronostic du CHC varient en fonction des particularités de l'histologie tumorale, de la taille, de la propagation du cancer et de l'état de santé général.
La grande majorité du CHC se trouve en Asie et en Afrique subsaharienne, dans des pays où l'hépatite B est endémique et où beaucoup sont infectés dès la naissance. L'incidence du CHC aux États-Unis et dans d'autres pays en développement augmente en raison d'une augmentation des infections par le virus de l'hépatite C. Elle est plus fréquente chez les hommes que chez les femmes pour des raisons inconnues[2].
Épidémiologie
[modifier | modifier le code]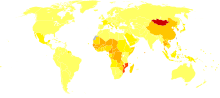
- pas de données
- < 7.5
- 7.5-15
- 15-22.5
- 22.5-30
- 30-37.5
- 37.5-45
- 45-52.5
- 52.5-60
- 60-67.5
- 67.5-75
- 75-110
- > 110
C'est par ordre de fréquence au niveau mondial le cinquième cancer le plus fréquent chez l'homme et le septième chez la femme. Il est aussi le plus fréquent des cancers primitifs du foie (loin devant le cholangiocarcinome et, plus rare encore, l'hémangioendothéliome). L'incidence annuelle mondiale est d'environ 500 000 nouveaux cas par an[4]. Dans les pays non développés, son incidence a particulièrement augmenté ces vingt dernières années en raison de l’augmentation de l’incidence de la cirrhose due au virus de l’hépatite B ou de l'hépatite C. 85 % des cas se situent dans les pays en voie de développement dans les zones d'endémie des hépatites[4]. L'incidence en Europe et aux États-Unis tend à augmenter[5].
Il survient presque toujours sur une maladie hépatique préexistante, exceptionnellement sur un foie sain : cirrhose dans plus de 90 % des cas et plus rarement hépatopathie chronique non cirrhotique, le plus souvent virale (hépatite B ou C chronique) mais aussi alcoolique. Certaines souches de virus B ou C sont plus susceptibles de causer un cancer[6],[7]. Le risque dépend également de la cause de la cirrhose. Il est plus élevé en cas de cirrhose post hépatite C, post hémochromatose et post hépatite B. Le risque est un peu plus réduit lors des cirrhoses post alcoolique[8]. Les formes secondaires à une stéatose hépatique non alcoolique deviennent de plus en plus fréquentes[5].
En Afrique et en Asie, l’aflatoxine, une mycotoxine sécrétée par Aspergillus flavus, parasitant les arachides, est aussi responsable de l'apparition du CHC[9].
Le surpoids, associé au diabète dans le cadre du syndrome métabolique, augmente sensiblement le risque de survenue du cancer du foie[10].
Au contraire, la consommation de café pourrait avoir un effet protecteur[11].
Causes
[modifier | modifier le code]Les facteurs incriminés sont identiques à ceux de la cirrhose :
- le virus de l'hépatite B ;
- le virus de l'hépatite C ;
- l'alcool ;
- l'hémochromatose ;
- d'autres causes moins fréquentes : déficit en alpha-1-antitrypsine, maladie de Wilson, cirrhoses biliaires, glycogénose de type 1, la tyrosinémie, la prise de certaines drogues et hormones (contraceptifs oraux fortement dosés, androgènes, stéroïdes anabolisants).
Le carcinome hépatocellulaire est donc la plupart du temps une complication d'une maladie hépatique déjà présente, il existe ainsi deux maladies, un cancer et un état précancéreux ; cette particularité conditionne le pronostic et la démarche thérapeutique car il faut prendre en considération les deux affections en même temps.
La stéatose hépatique non alcoolique — un trouble en nette augmentation dans le monde — est un facteur de risque pour ce cancer[12].
Le CHC se développe à partir d'un foyer initial localisé puis envahit les vaisseaux portes et métastase dans le foie lui-même par l'intermédiaire des branches portales, ce qui explique le caractère souvent multiloculaire du cancer et la tendance à la thrombose néoplasique des branches, puis du tronc de la veine porte.
Diagnostic
[modifier | modifier le code]Clinique
[modifier | modifier le code]Il est le plus souvent asymptomatique à ses débuts. Il doit être suspecté chez tout patient ayant une maladie du foie chronique avec une décompensation sans cause évidente.
Biologique
[modifier | modifier le code]Il est suspecté devant une augmentation de l'alpha-fœtoprotéine. Au-dessus de 20 μg·l-1,Diagnostic certain si le taux est supérieur à 500 ng/mL, ou supérieur à 400 ng/mL en présence de cirrhose et de nodule de plus de 2 cm hypervascularisé à l'imagerie, sa spécificité dépasserait les 90 % avec une sensibilité autour de 60 %[13].
Imagerie
[modifier | modifier le code]L'échographie, IRM, TDM permettent de le visualiser. L'échographie reste l'examen le plus simple, avec une très bonne sensibilité (un peu moindre dans les stades précoces)[14]. L'IRM et le scanner sont de sensibilité et de spécificité équivalente[15]. L'examen d'imagerie peut suffire pour établir le diagnostic si l'image est caractéristique.
Anatomopathologie
[modifier | modifier le code]L'analyse histologique d'un échantillon prélevé à la ponction-biopsie hépatique permet de lever tout doute sur le diagnostic.
Nouvelles méthodes
[modifier | modifier le code]La recherche de mutations génétiques n'est en 2019, que de peu d'utilité dans la prise en charge de ce type de cancer[16].
L'injection d'une bactérie probiotique modifiée, permet par un test d'urine ultérieur de détecter le cancer du foie[17].
Formes
[modifier | modifier le code]- expansive : le CHC est encapsulé, uni ou multinodulaire ;
- infiltrante ;
- mixte (fréquente) ;
- diffuse : toujours observée sur cirrhose, elle se caractérise par de multiples nodules de petites tailles disséminés.
Hépatocarcinomes Myc
[modifier | modifier le code]Les carcinomes hépatocellulaires induits par le protooncogène Myc appellent une consommation accrue de tryptophane (Trp). Celui-ci est métabolisé en sérotonine et en kynurénine (Kyn) (via l’enzyme indoleamine 2,3-dioxygenase 1 (IDO1)). La kynurénine est à son tour catabolisée en indole 3-pyruvate (I3P) (via l'activité de interleukin 4-induced 1 (IL4I1)). Kyn et I3P entrainent la prolifération en tant que ligand du facteur de transcription récepteur d'aryl hydrocarbone (AHR), qui régule les gènes impliqués dans la croissance cellulaire. L’I3P, qui fonctionne comme un oncométabolite responsable de la croissance tumorale, pourrait devenir une cible thérapeutique[18].
Pronostic
[modifier | modifier le code]Le pronostic est corrélé suivant la classification du cancer en forme précoce, intermédiaire ou avancée suivant des critères établies par le « Barcelona Clinic Liver Cancer » (BCLC)[19].
La tumeur a un fort potentiel de croissance, avec un doublement spontané de sa taille entre un mois et un an[20]. Le pronostic global est mauvais en raison de l'existence de la cirrhose sur le foie non tumoral qui limite les possibilités de traitement. En fait, la détection de petites tumeurs et les progrès thérapeutiques modifient son pronostic. Les taux de survie atteignent, à cinq ans, de 50 à 70 %[21].
Si la tumeur n'est pas résécable, l'espérance de vie ne dépasse guère un à deux ans, avec toutefois un pronostic hétérogène et un taux de survie à 3 ans de 50 % en l'absence de facteurs adverses[22].
Traitement
[modifier | modifier le code]La prise en charge des hépatocarcinomes fait l'objet de plusieurs recommandations publiées par des sociétés savantes internationales : celles, américaines, datent de 2023[23], celles, européennes, de la même année[24].
Préventif
[modifier | modifier le code]Il est celui de la prévention et du traitement des hépatopathies, dont le vaccin contre l'hépatite B.
Le traitement antiviral des hépatites virales pourrait diminuer l'incidence des carcinomes hépatiques. Cela semble être vrai dans le cas d'une hépatite B[25]. dans le cas d'une hépatite C, le traitement antiviral ne préviendrait l'apparition de l'hépatocarcinome qu'en cas de réponse virale effective[26].
Le dépistage précoce de l'hépatocarcinome dans les populations à risque peut, en théorie, en améliorer le pronostic. Il est fait par une échographie hépatique tous les six mois[16]. La preuve de l'efficacité de cette stratégie n'est cependant pas définitivement établie, certaines études prouvant un bénéfice en termes de mortalité[27], d'autres non[28]. L'échographie hépatique a une très bonne spécificité (supérieure à 90 %) et une moins bonne sensibilité (de l'ordre de 60 %)[29]. Il peut être complété par la recherche d'une élévation du taux sanguin d'alpha-fœtoprotéine, avec une sensibilité et une spécificité imparfaite[30].
Curatif
[modifier | modifier le code]Il est valable pour de petites tumeurs, peu nombreuses, sans métastases non résécables. Il est dans ce cas chirurgical avec une résection de la (ou des) tumeurs. Dans certains cas (tumeur de petite taille), une ablation non chirurgicale est possible : thermoablation par radiofréquence, embolisation de la tumeur, la première technique semblant avoir de meilleurs résultats[31]. Le risque de récidive est important[32], quelle que soit la technique, du fait de la persistance du terrain. Ce risque est d'autant plus élevé avec la taille de la tumeur, son aspect micronodulaire, sa survenue chez l'homme ainsi qu'un taux élevé d'alpha-foetoprotéine[33].
La transplantation hépatique est le choix préférentiel quand il existe une dysfonction hépatique, même sévère, sous-jacente ou en cas de tumeur non résécable[34]. Le taux de récidive est le moins élevé, d'autant que le tissu hépatique fibreux, terrain du cancer, est retiré. Le principal obstacle à la diffusion de ce type de traitement reste la pénurie de greffons.
Palliatif
[modifier | modifier le code]Si la fonction hépatique est conservée, une chimio-embolisation intra-artérielle (administration d'une chimiothérapie directement au sein de la tumeur, couplée avec l'obturation des artères nourricières de cette dernière) peut être proposée avec une augmentation de la survie de quelques mois[35]. La chimiothérapie systémique classique n'a pas d'efficacité[36].
L'emploi de sorafénib, un inhibiteur de tyrosine kinase multicible qui présente une double action anti-proliférative et anti-tumorale, a un intérêt qui s'avère être modéré (prolongation de trois mois de la durée de survie)[37]. Le lenvatinib a des résultats équivalents[38]. Le régorafénib[39], ainsi que le cabozantinib[40] ou le ramucirumab[41], peuvent être utilisés en seconde ligne. L'atézolizumab associé au bévacizumab est plus efficace en termes de durée de rémission que le sorafénib[42].
60 à 70% des patients seraient résistants à l'immunothérapie, généralement initiée à un stade avancé[43]. Parmi les thérapies ciblées, l'inhibition de la protéine ChREBP (en), un facteur de transcription identifié comme potentiel facteur favorisant le développement du CHC, est à l'étude[43],[44].
Dépistage
[modifier | modifier le code]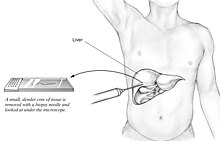
Il est important chez les patients porteurs d'une cirrhose quelle qu'en soit la cause. Il se fait tous les 6 mois chez les patients à risque par échographie hépatique et dosage de l'alpha-fœtoprotéine[45],[46].
Notes et références
[modifier | modifier le code]- ↑ (en) Jordi Bruix, Josep M. Llovet et Alejandro Forner, « Hepatocellular carcinoma », The Lancet, vol. 379, no 9822, , p. 1245–1255 (ISSN 0140-6736 et 1474-547X, PMID 22353262, DOI 10.1016/S0140-6736(11)61347-0, lire en ligne, consulté le )
- (en) Vinay Kumar, Abul K. Abbas et Jon C. Aster, Robbins and Cotran Pathologic Basis of Disease, Professional Edition E-Book, Elsevier Health Sciences, , 1472 p. (ISBN 978-0-323-29635-9, lire en ligne), p. 870–873
- ↑ « WHO Disease and injury country estimates », sur World Health Organization, (consulté le )
- (en) El-Serag HB, « Hepatocellular carcinoma » N Engl J Med. 2011;365:1118-1127
- Singal AG, Lampertico P, Nahon P, Epidemiology and surveillance for hepatocellular carcinoma: new trends, J Hepatol, 2020;72:250-261
- ↑ (en) Yang HI, Yeh SH, Chen PJ et al. « Associations between hepatitis B virus genotype and mutants and the risk of hepatocellular carcinoma » J Natl Cancer Inst. 2008;100:1134-1143
- ↑ (en) Bruno S, Crosignani A, Maisonneuve P, Rossi S, Silini E, Mondelli MU, « Hepatitis C virus genotype 1b as a major risk factor associated with hepatocellular carcinoma in patients with cirrhosis: a seventeen-year prospective cohort study » Hepatology 2007; 46: 1350-1356
- ↑ (en) Fattovich G, Stroffolini T, Zagni I, Donato F, « Hepatocellular carcinoma in cirrhosis: incidence and risk factors » Gastroenterology. 2004;127:Suppl 1:S35-S50
- ↑ Klotz F, Debonne JM, Richecoeur M, « L’hépatocarcinome sous les tropiques » Acta Endoscopica Volume 1999;29 [PDF]
- ↑ (en) Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ, « Overweight, obesity, and mortality from cancer in a prospectively studied cohort of US adults » N Engl J Med. 2003;348:1625-1638
- ↑ (en) Larsson SC, Wolk A, « Coffee consumption and risk of liver cancer: a meta-analysis » Gastroenterology 2007;132:1740-1745
- ↑ Margot Montpezat, « Cancer : les "produits chimiques éternels" des emballages alimentaires et ustensiles de cuisine multiplie les risques », sur pourquoidocteur.fr, Pourquoi Docteur ?, (consulté le ).
- ↑ (en) Trevisani F, D’Intino PE, Morselli-Labate AM, Mazzella G, Accogli E, Caraceni P et al. « Serum alpha-fetoprotein for diagnosis of hepatocellular carcinoma in patients with chronic liver disease: influence of HBsAg and anti-HCV status » J Hepatol. 2001;34:570-5
- ↑ (en) Singal A, Volk ML, Waljee A, Salgia R, Higgins P, Rogers MA et al. Meta-analysis: surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis Aliment Pharmacol Ther. 2009;30:37-47.
- ↑ Roberts LR, Sirlin CB, Zaiem F et al. Imaging for the diagnosis of hepatocellular carcinoma: a systematic review and meta-analysis, Hepatology, 2018;67:401-421
- Villanueva A, Hepatocellular carcinoma, N Engl J Med, 2019;380:1450-1462
- ↑ "Juin 2015: The Same Probiotic That’s In Your Yogurt Could Detect Liver Cancer"
- ↑
- ↑ Llovet JM, Brú C, Bruix J, Prognosis of hepatocellular carcinoma: the BCLC staging classification, Semin Liver Dis, 1999;19:329-338
- ↑ (en) Sheu JC, Sung JL, Chen DS, Yang PM, Lai MY, Lee CS et al. « Growth rate of asymptomatic hepatocellular carcinoma and its clinical implications » Gastroenterology 1985;89:259-66
- ↑ (en) Bruix J, Llovet JM, « Major achievements in hepatocellular carcinoma » Lancet, 2009;37:614- 616
- ↑ (en) Llovet JM, Bustamante J, Castells A, Vilana R, Ayuso Mdel C, Sala M et al. « Natural history of untreated nonsurgical hepatocellular carcinoma: rationale for the design and evaluation of therapeutic trials » Hepatology. 1999;29:62-7.
- ↑ Singal AG, Llovet JM, Yarchoan M et al. AASLD practice guidance on prevention, diagnosis, and treatment of hepatocellular carcinoma, Hepatology. 2023;78:1922-1965
- ↑ European Association for the Study of the Liver, EASL clinical practice guidelines: management of hepatocellular carcinoma, J Hepatol, 2018;69:182-236
- ↑ (en) Sung JJ, Tsoi KK, Wong VW, Li KC, Chan HL, « Meta-analysis: treatment of hepatitis B infection reduces risk of hepatocellular carcinoma » Aliment Pharmacol Ther. 2008;28:1067-1077.
- ↑ (en) Di Bisceglie AM, Shiffman ML, Everson GT et al. « Prolonged therapy of advanced chronic hepatitis C with low-dose peginterferon » N Engl J Med. 2008;359:2429-2441
- ↑ (en) Zhang BH, Yang BH, Tang ZY, « Randomized controlled trial of screening for hepatocellular carcinoma » J Cancer Res Clin Oncol. 2004;130:417-422
- ↑ (en) Chen JG, Parkin DM, Chen QG et al. « Screening for liver cancer: results of a randomised controlled trial in Qidong, China » J Med Screen. 2003;10:204-209
- ↑ (en) Singal A, Volk ML, Waljee A et al. « Meta-analysis: surveillance with ultrasound for early-stage hepatocellular carcinoma in patients with cirrhosis » Aliment Pharmacol Ther. 2009;30:37-47.
- ↑ (en) Sherman M, « Serological surveillance for hepatocellular carcinoma: time to quit » J Hepatol. 2010;52:614-615.
- ↑ (en) Cho YK, Kim JK, Kim MY, Rhim H, Han JK, « Systematic review of randomized trials for hepatocellular carcinoma treated with percutaneous ablation therapies » Hepatology 2009;49:453-9
- ↑ Tsilimigras DI, Bagante F, Moris D et al. Recurrence patterns and outcomes after resection of hepatocellular carcinoma within and beyond the Barcelona Clinic Liver Cancer criteria, Ann Surg Oncol, 2020;27:2321-2331
- ↑ Chan AWH, Zhong J, Berhane S et al. Development of pre and post-operative models to predict early recurrence of hepatocellular carcinoma after surgical resection, J Hepatol, 2018;69:1284-1293
- ↑ (en) Mazzaferro V, Regalia E, Doci R et al. « Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis » N Engl J Med. 1996;334:693-699
- ↑ (en) Llovet JM, Bruix J, « Systematic review of randomized trials for unresectable hepatocellular carcinoma: chemoembolization improves survival » Hepatology. 2003;37:429-42
- ↑ Forner A, Reig M, Bruix J, Hepatocellular carcinoma, Lancet, 2018;391:1301–1314
- ↑ (en) ASCO 2007 Sorafenib improves survival in advanced Hepatocellular Carcinoma (HCC): Results of a Phase III randomized placebo-controlled trial (SHARP trial)
- ↑ Kudo M, Finn RS, Qin S et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial, Lancet, 2018;391:1163-1173
- ↑ Bruix J, Qin S, Merle P et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial, Lancet, 2017;389:56–66
- ↑ Abou-Alfa GK, Meyer T, Cheng A-L et al. Cabozantinib in patients with advanced and progressing hepatocellular carcinoma, N Engl J Med, 2018;379:54-63
- ↑ (en) Andrew X. Zhu, Yoon-Koo Kang, Chia-Jui Yen et Richard S. Finn, « REACH-2: A randomized, double-blind, placebo-controlled phase 3 study of ramucirumab versus placebo as second-line treatment in patients with advanced hepatocellular carcinoma (HCC) and elevated baseline alpha-fetoprotein (AFP) following first-line sorafenib. », Journal of Clinical Oncology, vol. 36, no 15_suppl, , p. 4003–4003 (ISSN 0732-183X et 1527-7755, DOI 10.1200/JCO.2018.36.15_suppl.4003, lire en ligne, consulté le )
- ↑ (en) Richard S. Finn, Shukui Qin, Masafumi Ikeda et Peter R. Galle, « Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma », New England Journal of Medicine, vol. 382, no 20, , p. 1894–1905 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMoa1915745, lire en ligne, consulté le )
- « Carcinome hépatocellulaire : un inhibiteur clé identifié pour combattre les tumeurs ? · Inserm, La science pour la santé », sur Inserm (consulté le )
- ↑ (en) Emmanuel Benichou, Bolaji Seffou, Selin Topçu et Ophélie Renoult, « The transcription factor ChREBP Orchestrates liver carcinogenesis by coordinating the PI3K/AKT signaling and cancer metabolism », Nature Communications, vol. 15, no 1, , p. 1879 (ISSN 2041-1723, DOI 10.1038/s41467-024-45548-w, lire en ligne, consulté le )
- ↑ « Référence Carcinome hépatocellulaire (CHC) », sur oncologik.fr (consulté le )
- ↑ Tzartzeva K, Obi J, Rich NE et al. Surveillance imaging and alpha fetoprotein for early detection of hepatocellular carcinoma in patients with cirrhosis: a meta-analysis, Gastroenterology, 2018;154:1706-1718.e1
Voir aussi
[modifier | modifier le code]


 French
French Deutsch
Deutsch
