Composé organosilicié — Wikipédia

Un composé organosilicié est un composé organométallique contenant une liaison carbone–silicium. Ils présentent souvent des propriétés semblables à celles de composés organiques, étant généralement incolores, inflammables, hydrophobes et stables par rapport à l'air. Ces composés sont largement répandus dans les articles commerciaux : ce sont le plus souvent des mastics, des adhésifs et des revêtements en silicones, mais ils interviennent aussi dans la synthèse d'oligomères polyédriques de silsesquioxanes ainsi que de produits agricoles couramment utilisés avec des herbicides et des fongicides[1], dont certains affectent le système immunitaire des abeilles et d'autres insectes[2].

Les liaisons carbone–silicium sont absentes des substances biologiques naturelles, mais des enzymes ont pu être utilisées pour introduire des liaisons carbone–silicium chez des microorganismes vivants[3]. Les silicates, en revanche, sont présentes chez les diatomées[4]. Plusieurs composés organosiliciés ont par ailleurs été étudiés en vue d'applications pharmaceutiques[5].

Le carbure de silicium, qui est constitué de carbone et de silicium, est une céramique et non un composé organométallique, de sorte que c'est un composé inorganique.
Propriétés des liaisons Si–C, Si–O et Si–F
[modifier | modifier le code]Dans la plupart des composés organosiliciés, l'atome de silicium est tétravalent avec une géométrie moléculaire tétraédrique. Les liaisons carbone–silicium sont plus longues et plus faibles que les liaisons carbone–carbone, respectivement 186 pm contre 154 pm, avec une énergie de dissociation respectivement de 451 kJ/mol contre 607 kJ/mol[1].
La liaison Si–C est polarisée vers l'atome de carbone en raison de l'électronégativité plus élevée de ce dernier, de 2,55 sur l'échelle de Pauling contre 1,90 pour le silicium. Cette polarisation est illustrée par la réaction de Sakurai[6]. Certains alkylsilanes peuvent être oxydés en alcools par l'oxydation de Tamao-Fleming (en).
Les liaisons silicium–oxygène sont bien plus fortes que les liaisons simples carbone–oxygène, avec une énergie de dissociation respectivement de 798 kJ/mol[7] contre environ 200 à 400 kJ/mol[7] selon les composés — elles sont même plus fortes que les liaisons silicium–fluor (540 kJ/mol[7]). La formation préférentielle de liaisons Si–O oriente de nombreuses réactions organiques comme le réarrangement de Brook et la réaction de Peterson.
Préparation
[modifier | modifier le code]Le premier composé organosilicié fut le tétraéthylsilane Si(CH2CH3)4, préparé par Charles Friedel et James Crafts en 1863 en faisant réagir du tétrachlorure de silicium SiCl4 avec du diéthylzinc Zn(C2H5)2[8]. La plupart des composés organosiliciés dérivent de chlorures (CH3)4-xSiClx. Ces chlorures sont produits par synthèse de Müller-Rochow, qui implique la réaction du chlorométhane CH3Cl avec un alliage silicium-cuivre. Le produit principal et le plus recherché est le diméthyldichlorosilane SiCl2(CH3)2:
- 2 CH3Cl + Si ⟶ SiCl2(CH3)2.
Bien d'autres composés peuvent être obtenus, comme le chlorure de triméthylsilyle (CH3)3SiCl et le méthyltrichlorosilane SiCl3CH3. Cette méthode peut également donner des phénylchlorosilanes[9].
L'hydrosilylation est une autre méthode importante de formation de liaisons Si–C[10]. Cette méthode repose sur l'addition de composés portant une liaison Si–H sur des composés insaturés, notamment des alcènes, des alcynes, des imines, des cétones et des aldéhydes. Cette réaction requiert un catalyseur métallique, notamment du groupe du platine.
Groupes fonctionnels
[modifier | modifier le code]Le silicium entre dans la constitution de nombreux groupes fonctionnels. La plupart d'entre eux sont analogues à ceux des composés organiques, avec cependant comme principale différence que les liaisons multiples avec les atomes de silicium sont très rares.
Silanols, siloxydes et siloxanes
[modifier | modifier le code]Les silanols, plus précisément les organosilanols R3SiOH, sont analogues aux alcools R3COH. On les obtient généralement par hydrolyse d'un chlorure de silyle R3SiCl[11] :
Les silanols sont plus rarement préparés par oxydation d'un hydrure de silyle R3SiH en présence d'un catalyseur métallique :
- 2 R3SiH + O2 ⟶ 2 R3SiOH.
De nombreux silanols ont été isolés, comme le triméthylsilanol (CH3)3SiOH et le triphénylsilanol (C6H5)3SiOH. Ils sont considérablement plus acides que les alcools correspondants. Un siloxyde est un dérivé déprotoné d'un silanol[11] :
Les silanols tendent à se déshydrater en donnant des siloxanes :
- 2 R3SiOH ⟶ R3Si–O–SiR3 + H2O.
Les polymère formés de monomères de siloxanes sont des silicones, ou polysiloxanes. Les composés qui contiennent une double liaison Si=O sont appelés silanones et sont très instables.
Éthers de silyle
[modifier | modifier le code]Les éthers de silyle sont des composés présentant les liaisons Si–O–C. On les prépare généralement en faisant réagir un alcool ROH avec un chlorure de silyle (CH3)3SiCl :
- (CH3)3SiCl + ROH ⟶ (CH3)3Si-O-R + HCl.
Ils sont souvent employés comme groupes protecteurs sur les hydroxyles ; on les élimine à l'aide de sources d'ions fluorure F− comme le fluorure de tétra-n-butylammonium (CH3CH2CH2CH2)4N+F−.
- (CH3)3Si–O–R + F− + H2O ⟶ (CH3)3Si–F + H–O–R + OH−.
Chlorures de silyle
[modifier | modifier le code]Les chlorures de silyle sont des composés organosiliciés importants principalement utilisés pour produire des silicones. Parmi les plus notables d'entre eux, on peut retenir le diméthyldichlorosilane SiCl2(CH3)2, le méthyltrichlorosilane SiCl3CH3 et le chlorure de triméthylsilyle (CH3)3SiCl. Des dérivés plus spécialisés qui ont des applications commerciales sont par exemple le dichlorométhylphénylsilane C6H5SiCl2CH3, le trichloro(chlorométhyl)silane ClCH2SiCl3, le trichloro(dichlorophényl)silane C6Cl2H3SiCl3, le trichloroéthylsilane CH3CH2SiCl3 et le phényltrichlorosilane C6H5SiCl3.
Les composés organosiliciés sont assez largement utilisés en synthèse organique. Le principal agent de silylation est le chlorure de triméthylsilyle (CH3)3SiCl. Une méthode classique de synthèse de cette classe de composés consiste à chauffer des hexaalkyldisiloxanes R3SiOSiR3 avec de l'acide sulfurique concentré et un halogénure de sodium[12].
Hydrures de silyle
[modifier | modifier le code]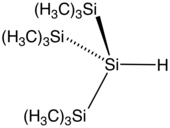
La liaison silicium–hydrogène est plus longue et plus faible que la liaison carbone–hydrogène : respectivement 148 pm et 299 kJ/mol[7] contre 105 pm et 337 kJ/mol[7]. L'hydrogène étant plus électronégatif que le silicium, on parle d'hydrure de silyle. La série des silanes sont des hydrures de silyle.
Silènes
[modifier | modifier le code]Contrairement aux composés organiques, la chimie des doubles liaisons est limitée chez les organosiliciés[13]. Les silènes présentant une double liaison Si=C, appelés alkylidènesilanes, sont des curiosités de laboratoire, à l'instar du silabenzène (en) C5H5SiH. Gusel'nikov et al. ont publié en 1967 les premières observations de silènes à partir de la pyrolyse de diméthylsilacyclobutane[14]. Le premier silène stables, bloqué cinétiquement, a été publié par Brook et al. en 1981[15],[16].
- Quelques silènes historiques.
Les disilènes ont des doubles liaisons Si=Si et sont des analogues siliciés des alcènes, tandis que les disilynes ont des triples liaisons Si≡Si et sont des analogues siliciés des alcynes. L'observation de première triple liaison Si≡C dans un silyne a été publiée en 2010[17].
Siloles
[modifier | modifier le code]
Les siloles, ou silacyclopentadiènes, dont les membres siliciés des métalloles, analogues du cyclopentadiène C4H4CH2. Ils sont étudiés pour leur électroluminescence, et plus généralement pour leurs propriétés électroniques[18].
Les siloles sont de bons transporteurs d'électrons. Le niveau bas de leur orbitale basse vacante (LUMO) provient d'interactions favorables avec l'orbitale antiliante σ du silicium avec les orbitales π antiliantes du fragment butadiène.
Silicium pentacoordonné
[modifier | modifier le code]Contrairement au carbone, le silicium peut être coordonné à cinq atomes dans une série de composés appelés silatranes, comme le phénylsilatrane, ou encore dans un pentaorganosilicate particulièrement stable[19] :
- Pentaorganosilicate.
La stabilité du silicium hypervalent est la base du couplage de Hiyama, utilisé dans certaines applications spécialisées de synthèse organique.
Réactions
[modifier | modifier le code]Certains silanes allyliques peuvent être préparés à partir d'esters tels que (1) ci-dessous et de composés de monosilyles et de zinc (2) ou de cuivre (4)[20] :
- Synthèse de silanes allyliques.
Dans ce type de réaction, la polarité du silicium est inversée dans la liaison avec le zinc et un réarrangement allylique peut avoir lieu sur le groupe benzoyloxy.
Notes et références
[modifier | modifier le code]- (en) Mateusz Janeta et Sławomir Szafert, « Synthesis, characterization and thermal properties of T8 type amido-POSS with p-halophenyl end-group », Journal of Organometallic Chemistry, vol. 847, , p. 173-183 (DOI 10.1016/j.jorganchem.2017.05.044, lire en ligne)
- (en) Julia D. Fine, Diana L. Cox-Foster et Christopher A. Mullin, « An Inert Pesticide Adjuvant Synergizes Viral Pathogenicity and Mortality in Honey Bee Larvae », Scientific Report, vol. 7, , article no 40499 (PMID 28091574, PMCID 5238421, DOI 10.1038/srep40499, Bibcode 2017NatSR...740499F, lire en ligne)
- (en) Mark B. Frampton et Paul Martin Zelisko, « Organosilicon Biotechnology », Silicon, vol. 1, , p. 147-163 (DOI 10.1007/s12633-009-9021-3, lire en ligne)
- (en) Stephen D. Kinrade, Ashley-M. E. Gillson et Christopher T. G. Knight, « Silicon-29 NMR evidence of a transient hexavalent silicon complex in the diatom Navicula pelliculosa », Journal of the Chemical Society, Dalton Transactions, no 3, , p. 307-309 (DOI 10.1039/B105379P, lire en ligne)
- (en) William Bains et Reinhold Tacke, « Silicon chemistry as a novel source of chemical diversity in drug design », Current Opinion in Drug Discovery & Development, vol. 6, no 4, , p. 526-543 (PMID 12951816)
- (en) Ernest W. Colvin, Silicon in Organic Synthesis, 1re édition, Butterworth-Heinemann, janvier 1981. (ISBN 978-1-4831-4223-4)
- (en) « Properties of Atoms, Radicals, and Bonds - Table 4.11 Bond Dissociation Energies », sur labs.chem.ucsb.edu, Université de Californie à Santa Barbara (consulté le ).
- (en) Hideki Sakurai, « Silicon: Organosilicon Chemistry », Encyclopedia of Inorganic Chemistry, (DOI 10.1002/0470862106.ia220, lire en ligne)
- (en) Lutz Rösch, Peter John et Rudolf Reitmeier, « Silicon Compounds, Organic », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a24_021, lire en ligne)
- (en) Bogdan Marciniec, « Hydrosilylation of Alkenes and Their Derivatives », Hydrosilylation, A Comprehensive Review on Recent Advances, Springer, 2009. (ISBN 978-1-4020-8172-9)
- (en) Paul D. Lickiss, « The Synthesis and Structure of Organosilanols », Advances in Inorganic Chemistry, vol. 42, , p. 147-262 (DOI 10.1016/S0898-8838(08)60053-7, lire en ligne)
- (en) E. A. Flood, « Preparation of Triethylsilicon Halides », The Journal of the American Chemical Society, vol. 55, no 4, , p. 1735-1736 (DOI 10.1021/ja01331a504, lire en ligne)
- (en) Henrik Ottosson et Patrick G. Steel, « Silylenes, Silenes, and Disilenes: Novel Silicon‐Based Reagents for Organic Synthesis? », Chemistry, vol. 12, no 6, , p. 1576-1585 (PMID 16138382, DOI 10.1002/chem.200500429, lire en ligne)
- (en) L. E. Gusel'Nikov et M. C. Flowers, « The thermal decomposition of 1,1-dimethyl-1-silacyclobutane and some reactions of an unstable intermediate containing a silicon–carbon double bond », Chemical Communications (London), no 17, , p. 864-865 (DOI 10.1039/C19670000864, lire en ligne)
- (en) Adrian G. Brook, Fereydon Abdesaken, Brigitte Gutekunst, Gerhard Gutekunst et R. Krishna Kallury, « A solid silaethene: isolation and characterization », Journal of the Chemical Society, Chemical Communications, no 4, , p. 191-192 (DOI 10.1039/C39810000191, lire en ligne)
- (en) Kim M. Baines, « Brook silenes: inspiration for a generation », Chemical Communications, vol. 49, no 57, , p. 6366-6369 (DOI 10.1039/C3CC42595A, lire en ligne)
- (en) David Gau, Tsuyoshi Kato, Nathalie Saffon-Merceron, Abel De Cózar, Fernando P. Cossío et Antoine Baceiredo, « Synthesis and Structure of a Base-Stabilized C-Phosphino-Si-Amino Silyne », Angewandte Chemie International Edition, vol. 49, no 37, , p. 6585-6588 (PMID 20677192, DOI 10.1002/anie.201003616, lire en ligne)
- (en) Laurent Aubouy, Philippe Gerbier, Nolwenn Huby, Guillaume Wantz, Laurence Vignau, Lionel Hirsch et Jean-Marc Janot, « Synthesis of new dipyridylphenylaminosiloles for highly emissive organic electroluminescent devices », New Journal of Chemistry, vol. 28, no 6, , p. 1086-1090 (DOI 10.1039/B405238B, lire en ligne)
- (en) Sirik Deerenberg, Marius Schakel, Adrianus H. J. F. de Keijzer, Mirko Kranenburg, Martin Lutz, Anthony L. Spek et Koop Lammertsma, « Tetraalkylammonium pentaorganosilicates: the first highly stable silicates with five hydrocarbonligands », Chemical Communications, no 4, , p. 348-349 (DOI 10.1039/B109816K, lire en ligne)
- (en) Eric S. Schmidtmann et Martin Oestreich, « Mechanistic insight into copper-catalysed allylic substitutions with bis(triorganosilyl) zincs. Enantiospecific preparation of α-chiral silanes », Chemical Communications, no 34, , p. 3643-3645 (DOI 10.1039/B606589A, lire en ligne)
| C-H | He | |||||||||||||||||
| C-Li | C-Be | C-B | C-C | C-N | C-O | C-F | Ne | |||||||||||
| C-Na | C-Mg | C-Al | C-Si | C-P | C-S | C-Cl | C-Ar | |||||||||||
| C-K | C-Ca | C-Sc | C-Ti | C-V | C-Cr | C-Mn | C-Fe | C-Co | C-Ni | C-Cu | C-Zn | C-Ga | C-Ge | C-As | C-Se | C-Br | C-Kr | |
| C-Rb | C-Sr | C-Y | C-Zr | C-Nb | C-Mo | C-Tc | C-Ru | C-Rh | C-Pd | C-Ag | C-Cd | C-In | C-Sn | C-Sb | C-Te | C-I | C-Xe | |
| C-Cs | C-Ba | * | C-Lu | C-Hf | C-Ta | C-W | C-Re | C-Os | C-Ir | C-Pt | C-Au | C-Hg | C-Tl | C-Pb | C-Bi | C-Po | C-At | Rn |
| Fr | C-Ra | * * | Lr | Rf | Db | C-Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | ||||||||||||||||||
| * | C-La | C-Ce | C-Pr | C-Nd | C-Pm | C-Sm | C-Eu | C-Gd | C-Tb | C-Dy | C-Ho | C-Er | C-Tm | C-Yb | ||||
| * * | Ac | C-Th | C-Pa | C-U | C-Np | C-Pu | C-Am | C-Cm | C-Bk | C-Cf | C-Es | Fm | Md | No | ||||
| Liaison de base en chimie organique | Nombreuses utilisations en chimie |
| Recherche académique, peu d'usages courants | Liaison inconnue / non évaluée |


 French
French Deutsch
Deutsch

