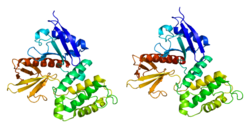Ezrine — Wikipédia
L'Ezrine aussi connu sous le nom de cytovilline ou villine-2 est une protéine codée chez l'homme par le gène EZR[5] situé sur le chromosome 6 humain.
Structure
[modifier | modifier le code]L'extrémité N-terminale de l'ezrine contient un domaine FERM qui est subdivisée en trois sous-domaines. L'extrémité C-terminale contient un domaine ERM.
Fonction
[modifier | modifier le code]La membrane protéique à la périphérie du cytoplasme codée par ce gène fonctionne comme une protéine-tyrosine kinase substrat dans les microvillosités. En tant que membre de la famille des protéines ERM, cette protéine sert d'intermédiaire entre la membrane plasmique et l'actine du cytosquelette. Elle joue un rôle clé dans la structure de surface cellulaire de l'adhérence, la migration, et de l'organisation[6].
L’extrémité N-terminal du domaine FERM se lie fortement au sodium-hydrogène de l'échangeur de facteur de régulation (NHERF) protéines (impliquant à longue portée de l'allostérie)[7]. Le C-terminal se lie à l'actine, le phosphatidylinositol(4,5)bis-phosphate (PIP2)[8] et des protéines membranaires comme CD44 et ICAM-2.
Interactions
[modifier | modifier le code]Il a été montré que l'ezrine interagit avec:
Références
[modifier | modifier le code]- GRCh38: Ensembl release 89: ENSG00000092820 - Ensembl, May 2017
- GRCm38: Ensembl release 89: ENSMUSG00000052397 - Ensembl, May 2017
- ↑ « Publications PubMed pour l'Homme », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- ↑ « Publications PubMed pour la Souris », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- ↑ « cDNA cloning and sequencing of the protein-tyrosine kinase substrate, ezrin, reveals homology to band 4.1 », EMBO J., vol. 8, no 13, , p. 4133–42 (PMID 2591371, PMCID 401598)
- ↑ « Entrez Gene: VIL2 villin 2 (ezrin) »
- ↑ « Activation of nanoscale allosteric protein domain motion revealed by neutron spin echo spectroscopy », Biophysical Journal, vol. 99, no 10, , p. 3473–82 (PMID 21081097, PMCID 2980739, DOI 10.1016/j.bpj.2010.09.058)
- ↑ « Open conformation of ezrin bound to phosphatidylinositol 4,5-bisphosphate and to F-actin revealed by neutron scattering », J. Biol. Chem., vol. 287, no 44, , p. 37119–33 (PMID 22927432, PMCID 3481312, DOI 10.1074/jbc.M112.380972)
- ↑ Gajate C, Mollinedo F, « Cytoskeleton-mediated death receptor and ligand concentration in lipid rafts forms apoptosis-promoting clusters in cancer chemotherapy », J. Biol. Chem., vol. 280, no 12, , p. 11641–7 (PMID 15659383, DOI 10.1074/jbc.M411781200)
- ↑ Parlato S, Giammarioli AM, Logozzi M, Lozupone F, Matarrese P, Luciani F, Falchi M, Malorni W, Fais S, « CD95 (APO-1/Fas) linkage to the actin cytoskeleton through ezrin in human T lymphocytes: a novel regulatory mechanism of the CD95 apoptotic pathway », EMBO J., vol. 19, no 19, , p. 5123–34 (PMID 11013215, PMCID 302100, DOI 10.1093/emboj/19.19.5123)
- ↑ Heiska L, Alfthan K, Grönholm M, Vilja P, Vaheri A, Carpén O, « Association of ezrin with intercellular adhesion molecule-1 and -2 (ICAM-1 and ICAM-2). Regulation by phosphatidylinositol 4, 5-bisphosphate », The Journal of Biological Chemistry, vol. 273, no 34, , p. 21893–900 (PMID 9705328, DOI 10.1074/jbc.273.34.21893)


 French
French Deutsch
Deutsch