Facteur XIII — Wikipédia
| Facteur Laki-Lorand | ||
 Homodimère de facteur de coagulation XIII humain (PDB 1GGT[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Facteur de coagulation XIII | |
| N° EC | 2.3.2.13 | |
| Chaîne A | ||
| Homo sapiens | ||
| Locus | 6p25.1 | |
| Masse moléculaire | 83 267 Da[2] | |
| Nombre de résidus | 732 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Chaîne B | ||
| Homo sapiens | ||
| Locus | 1q31.3 | |
| Masse moléculaire | 75 511 Da[2] | |
| Nombre de résidus | 661 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
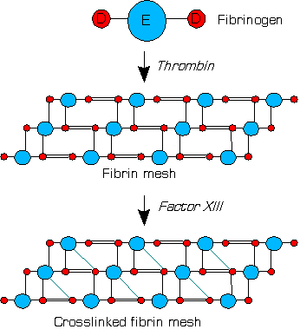
Le facteur XIII est une proenzyme de la coagulation sanguine qui ramifie la fibrine. Après que la thrombine a converti le fibrinogène en fibrine, cette dernière forme un réseau protéinacé dans lequel chaque unité E est liée latéralement à seulement une unité D. Le facteur XIII est activé par la thrombine en facteur XIIIa ; son activation en facteur XIIIa nécessite des ions calcium Ca2+ comme cofacteurs.
On l'appelle également facteur Laki-Lorand ou facteur de stabilisation de la fibrine.
Le facteur de coagulation XIII humain est un hétérotétramère constitué de deux peptides A enzymatiques et deux peptides B non enzymatiques. XIIIa est un homodimère de peptides A activés[3].
Enzyme
[modifier | modifier le code]| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Texte anglais à traduire :
Factor XIII consists of twice two subunits (2 A and 2 B), the genes for which are on different chromosomes:
- A subunit (6p25-p24). The transglutaminase part; this adds an alkyl group to the nitrogen on a glutamine residue, which binds in turn with a lysine on the other chain.
- B subunit (1q31-q32.1). This has no clear enzymatic activity, and may serve as a carrier for the A subunit.
Rôle dans les maladies
[modifier | modifier le code]Une déficience en facteur XIII est très rare, et peut provoquer une grave prédisposition aux hémorragies graves.
Notes et références
[modifier | modifier le code]- (en) V. C. Yee, L. C. Pedersen, I. Le Trong, P. D. Bishop, R. E. Stenkamp et D. C. Teller, « Three-dimensional structure of a transglutaminase: human blood coagulation factor XIII », Proceedings of the National Academy of Sciences of the United States of America, vol. 91, no 15, , p. 7296-7300 (PMID 7913750, PMCID 44386, DOI 10.1073/pnas.91.15.7296, JSTOR 2365267, Bibcode 1994PNAS...91.7296Y, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- (en) László Muszbek, Zsuzsanna Bereczky, Zsuzsa Bagoly, István Komáromi et Éva Katona, « Factor XIII: A Coagulation Factor With Multiple Plasmatic and Cellular Functions », Physiological Reviews, vol. 91, no 3, , p. 931-972 (PMID 21742792, DOI 10.1152/physrev.00016.2010, lire en ligne)
Liens externes
[modifier | modifier le code]- (en) 134570 (sous-unité A) et (en) 134580 (sous-unité B)
- déficience en facteur XIII


 French
French Deutsch
Deutsch