Flavone (groupe) — Wikipédia

Les flavones (du latin flavus, jaune) sont une sous-famille des flavonoïdes dont la structure est basée sur la flavone (2-phényl-1-benzopyran-4-one ou 2-phénylchromén-4-one). Ce sont des colorants végétaux jaunes dont environ 300 composés naturels sont connus. Comme d'autres flavonoïdes (hypéroside, quercitrine), elles sont parfois présentes sous forme d'hétérosides solubles dans l'eau. On les trouve parfois comme co-pigment avec les anthocyanes.
Les flavones 3-hydroxylées (portant un groupe alcool sur le carbone 3) sont appelées flavonols et forment une autre sous-famille des flavonoïdes.
Principales flavones
[modifier | modifier le code]Flavones naturelles
[modifier | modifier le code]| Nom | Structure | R5 | R6 | R7 | R8 | R3' | R4' | R5' | CAS | Nom IUPAC |
|---|---|---|---|---|---|---|---|---|---|---|
| Flavone | 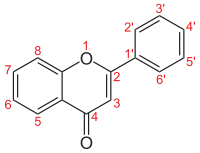 | H | H | H | H | H | H | H | 2-phénylchromèn-4-one | |
| Apigénine | OH | H | OH | H | H | OH | H | 5,7-dihydroxy-2-(4-hydroxyphényl)chromèn-4-one | ||
| Acacétine | OH | H | OH | H | H | OCH3 | H | 5,7-dihydroxy-2-(4-méthoxyphényl)chromèn-4-one | ||
| Baicaléine | OH | OH | OH | H | H | H | H | 5,6,7-trihydroxy-2-phénylchromèn-4-one | ||
| Chrysine | OH | H | OH | H | H | H | H | 5,7-dihydroxy-2-phénylchromèn-4-one | ||
| Chrysoériol | OH | H | OH | H | OCH3 | OH | H | 5,7-dihydroxy-2-(4-hydroxy-3-méthoxy-phényl)chromèn-4-one | ||
| Diosmétine | OH | H | OH | H | OH | OCH3 | H | 5,7-dihydroxy-2-(3-hydroxy-4-methoxyphenyl)chromèn-4-one | ||
| Eupatiline | OH | OCH3 | OH | H | OCH3 | OCH3 | H | 5,7-dihydroxy-2-(3,4-diméthoxyphényl)chromèn-4-one | ||
| Eupatorine | OH | OCH3 | OCH3 | H | OH | OCH3 | H | 5,7-dihydroxy-6-méthoxy-2-(3-hydroxy-4-methoxyphenyl)chromèn-4-one | ||
| Genkwanine | OH | H | OCH3 | H | H | OH | H | 5-hydroxy-7-méthoxy-2-(4-hydroxy-phényl)chromèn-4-one | ||
| 6-hydroxyflavone | H | OH | OH | H | H | H | H | 6-hydroxy-2-phénylchromèn-4-one | ||
| Lutéoline | OH | H | OH | H | OH | OH | H | 5,7-dihydroxy-2-(3,4-dihydroxyphényl)chromèn-4-one | ||
| Népétine | OH | OCH3 | OH | H | OH | OH | H | 5,7-dihydroxy-6-méthoxy-2-(3,4-dihydroxyphényl)chromén-4-one | ||
| Nobilétine | OCH3 | OCH3 | OCH3 | OCH3 | OCH3 | OCH3 | H | 5,6,7,8-téraméthoxy-2-(3,4-méthoxyphényl)chromèn-4-one | ||
| Oroxyline A | OH | OCH3 | OH | H | H | H | H | 5,7-dihydroxy-6-méhtoxy-2-phénylchromèn-4-one | ||
| Scutellaréine | OH | OH | OH | H | H | OH | H | 5,6,7-trihydroxy-2-(4-hydroxyphényl)chromèn-4-one | ||
| Sinensétine | OCH3 | OCH3 | OCH3 | H | OCH3 | OCH3 | H | 5,6,7-triméthoxy-2-(3,4-diméthoxyphényl)chromèn-4-one | ||
| Tangéritine | OCH3 | OCH3 | OCH3 | OCH3 | H | OCH3 | H | 5,6,7,8-tétraméthoxy-2-(4-méthoxyphényl)chromèn-4-one | ||
| Techtochrysine | OH | H | OCH3 | H | H | H | H | 5-hydroxy-7-méthoxy-2-phénylchromèn-4-one | ||
| Tricine | OH | H | OH | H | OCH3 | OH | OCH3 | 5,7-dihydroxy-2-(4-hydroxy-3,5-diméthoxyphényl)chromèn-4-one | ||
| Wogonine | OH | H | OH | OCH3 | H | H | H | 5,7-dihydroxy-8-méhtoxy-2-phénylchromèn-4-one |
Flavones synthétiques
[modifier | modifier le code]De nombreuses flavones ont été synthétisées et servent par exemple de médicament. On peut notamment citer le flavoxate, la diosmine (hétéroside) ou encore l'hidrosmine.
Hétérosides de flavones
[modifier | modifier le code]Synthèse de flavones
[modifier | modifier le code]En chimie organique, il existe différentes méthodes permettant de synthétiser les flavones :
- la réaction d'Allan-Robinson
- la synthèse d'Auwers
- le réarrangement de Baker-Venkataraman
- la réaction d'Algar-Flynn-Oyamada
Une autre méthode passe par la cyclisation déshydratante de certaines 1,3-diaryl dicétones[1]

Cette méthode particulière utilise un solvant qui est un liquide ionique et une irradiation par micro-ondes.
Réarrangement de Wessely-Moser
[modifier | modifier le code]Le réarrangement de Wessely-Moser (1930) [2] a été un outil important dans la découverte de la structure des flavonoïdes. Il permet la conversion de 5,7,8-triméthoxyflavones en 5,6,7-trihydroxyflavones par hydrolyse des groupes methoxy en groupe hydroxy (phénols).
Ce réarrangement ouvre aussi des perspectives pour certaines synthèses. Par exemple[3]:
Le réarrangement se produit à différentes étapes: A ouverture du cycle pour donner la dicétone, B rotation de la liaison avec formation d'un composé de type acétylacétone, et C hydrolyse des deux groupes méthoxy et fermeture du cyle.
Consommation et effets supposés
[modifier | modifier le code]Les flavones sont particulièrement présentes dans les céréales et les herbes. Dans le monde occidental, la consommation en flavones est estimée entre 20 et 50 mg par jour[4]. Ces dernières années, l'intérêt du monde scientifique et du grand public pour les flavones s'est accru du fait de leurs supposés effets bénéfiques contre l'athérosclérose, l'ostéoporose, le diabète et certains cancers[5]. Les études actuelles sur la prise de flavones et d'autres extraits de plantes en compléments alimentaires se multiplient.
Polyméthoxyflavones
[modifier | modifier le code]Les polyméthoxyflavones (PMF), flavones méthoxylées, et leurs dérivés sont des pigments bioactifs alimentaires présents dans les agrumes (Flavonoïdes d'agrumes), en particuliers les mandarines primitives et les mandarines sauvages. Mesuré sur le agrumes de Jeju le niveau de flavonoïdes est plus élevé dans le flavedo des fruits verts[6].
Trois gènes homologues, CreOMT3 , CreOMT4 et CreOMT5 sont impliqués dans leur biosynthèse. CreOMT4 subit une délétion chez la plupart des mandarines cultivées modernes, ce qui en réduit la teneur en PMF par rapport à celle des mandarines sauvages et précoces (comme celles des îles Ryūkyū. voir C. depressa)[7]. La protéine recombinante de CitOMT a une activité de méthylation des flavones in vitro, elle intervient pour la biosynthèse de la nobilétine (une des polyméthoxyflavones) qui s'accumule dans les premiers stades de croissance des mandarines (juillet) et décline de 50% jusqu'à la maturité[8].
Les études précliniques sur modèle animal (anti-cancer, anti-inflammation, anti-athérosclérose, syndrome métabolique) n'ont pas encore permis (2024) de déterminer les dosages ni la pharmacocinétique chez l'humain[9]. La tangérétine, la nobilétine, la 5′-déméthylnobilétine, la tétraméthyl-o-scutellaréine, la pentaméthoxyflavone, la tétraméthyl-o-isoscutellaréine et la sinensetine font l'objet d'études cliniques et précliniques (2023) visant à améliorer leur biodisponibilité (très faible perméabilité à l'eau et solubilité) en vue d'exploiter leurs effets pharmacologiques démontrés[10].
Interactions médicamenteuses
[modifier | modifier le code]Les flavones ont un effet sur l'activité des CYP (p450)[11],[12], enzymes métabolisant la plupart des médicaments dans le corps.
Notes et références
[modifier | modifier le code]- ↑ (en) Sarda SR, Pathan MY, Paike VV, Pachmase PR, Jadhav WN, Pawar RP, « A facile synthesis of flavones using recyclable ionic liquid under microwave irradiation », Arkivoc, vol. xvi, , p. 43–8 (lire en ligne)
- ↑ (en) Wessely F, Moser GH, « Synthese und Konstitution des Skutellareins », Monatsh. Chem., vol. 56, no 1, , p. 97–105 (DOI 10.1007/BF02716040, lire en ligne)
- ↑ (en) Larget R, Lockhart B, Renard P, Largeron M, « A convenient extension of the Wessely-Moser rearrangement for the synthesis of substituted alkylaminoflavones as neuroprotective agents in vitro », Bioorg. Med. Chem. Lett., vol. 10, no 8, , p. 835–8 (PMID 10782697, DOI 10.1016/S0960-894X(00)00110-4, lire en ligne)
- ↑ (en) Cermak R, Wolffram S, « The potential of flavonoids to influence drug metabolism and pharmacokinetics by local gastrointestinal mechanisms », Curr. Drug Metab., vol. 7, no 7, , p. 729–44 (PMID 17073577, DOI 10.2174/138920006778520570, lire en ligne)
- ↑ (en) Cermak R, « Effect of dietary flavonoids on pathways involved in drug metabolism », Expert Opin Drug Metab Toxicol, vol. 4, no 1, , p. 17–35 (PMID 18370856, DOI 10.1517/17425255.4.1.17, lire en ligne)
- ↑ (en) Hyejin Hyeon, Ho Bong Hyun, Sung Chun Kim et Boram Go, « Simultaneous Quantification Method of Flavonoids in Jeju Native Citrus from Different Harvest Times Using a High-Performance Liquid Chromatography–Diode Array Detector (HPLC–DAD) », Separations, vol. 10, no 11, , p. 567 (ISSN 2297-8739, DOI 10.3390/separations10110567, lire en ligne, consulté le )
- ↑ (en) Zhaoxin Peng, Lizhi Song, Minghua Chen et Zeyang Liu, « Neofunctionalization of an OMT cluster dominates polymethoxyflavone biosynthesis associated with the domestication of citrus », Proceedings of the National Academy of Sciences, vol. 121, no 14, (ISSN 0027-8424 et 1091-6490, DOI 10.1073/pnas.2321615121, lire en ligne, consulté le )
- ↑ (en) Mao Seoka, Gang Ma, Lancui Zhang, Masaki Yahata, Kazuki Yamawaki, Toshiyuki Kan & Masaya Kato, « Figure 1 | Scientific Reports / Expression and functional analysis of the nobiletin biosynthesis-related gene CitOMT in citrus fruit », Nature Scientific Reports, (lire en ligne, consulté le )
- ↑
- ↑ (en) Zarina Mushtaq, Mahwish Aslam, Muhammad Imran, Mohamed A. Abdelgawad et al., « Polymethoxyflavones: an updated review on pharmacological properties and underlying molecular mechanisms », International Journal of Food Properties, vol. 26, no 1, , p. 866–893 (ISSN 1094-2912 et 1532-2386, DOI 10.1080/10942912.2023.2189568, lire en ligne
 , consulté le )
, consulté le ) - ↑ (en) Rainer Cermak et Siegfried Wolffram, « The Potential of Flavonoids to Influence Drug Metabolism and Pharmacokinetics by Local Gastrointestinal Mechanisms », Current Drug Metabolism, vol. 7, no 7, , p. 729–744 (DOI 10.2174/138920006778520570, lire en ligne
 , consulté le )
, consulté le ) - ↑ (en) Si D, Wang Y, Zhou YH, et al., « Mechanism of CYP2C9 inhibition by flavones and flavonols », Drug Metab. Dispos., vol. 37, no 3, , p. 629–34 (PMID 19074529, DOI 10.1124/dmd.108.023416, lire en ligne)[1]
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « flavones » (voir la liste des auteurs).


 French
French Deutsch
Deutsch