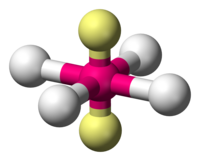
Géométrie moléculaire plane carrée — Wikipédia
| Géométrie moléculaire plane carrée | |
 | |
| Notation VSEPR | AX4E2 |
|---|---|
| Exemple(s) | XeF4, cisplatine |
| Nombre stérique | 6 |
| Coordinence | 4 |
| Doublet non liant | 2 |
| Angle de liaison | 90° |
| modifier | |
En chimie, une géométrie moléculaire plane carrée ou plan-carré est la géométrie des molécules où un atome central, noté A, est lié à quatre atomes, groupes d'atomes ou ligands, notés X, aux sommets d'un carré plan. Elle se rencontre en particulier pour les atomes centraux liés à quatre substituants mais possédant aussi deux doublets non-liants, notés E, qui viennent se placer de part et d'autre du plan. Cette configuration est notée AX4E2 selon la théorie VSEPR.
Dans le cas idéal, où entre autres les quatre substituants sont identiques, l'angle de liaison XAX fait 90°, mais il peut prendre des valeurs légèrement différentes dans la réalité.
Exemples
[modifier | modifier le code]De nombreux composés adoptent cette géométrie ; c'est par exemple le cas de tétrafluorure de xénon (XeF4), un des rares composés de gaz noble, mais on trouve surtout de nombreux exemples parmi les complexes de métaux de transition. Cette géométrie est d'ailleurs prévalente pour les complexes de métaux de transition ayant une configuration de type d8, ce qui inclut Rh(I), Ir(I), Pd(II), Pt(II), et Au(III). Parmi les exemples notables, on trouve les médicaments anticancéreux cisplatine [PtCl2(NH3)2] et carboplatine. De nombreux catalyseurs homogènes prennent cette géométrie dans leur état de repos, tel que le catalyseur de Wilkinson et le catalyseur de Crabtree. On peut également citer le complexe de Vaska et le sel de Zeise. Certain ligands (tels que les porphyrines) stabilisent cette géométrie.
- Structure du cisplatine.
- Structure du tétrafluorure de xénon.
Relation à d'autres géométries
[modifier | modifier le code]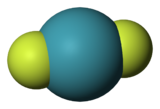


Géométrie moléculaire linéaire
[modifier | modifier le code]Certains complexes à deux ligands (ML2) adoptant une géométrie moléculaire linéaire peuvent se voire adjoindre deux ligands supplémentaires et prendre une géométrie plane carrée. On peut citer par exemple, XeF2 qui avec l'ajout de deux atomes de fluor supplémentaires forme XeF4.
Géométrie moléculaire tétraédrique
[modifier | modifier le code]En principe, une géométrie plane carrée peut être obtenue en aplatissant une géométrie moléculaire tétraédrique. Ainsi, l'interconversion entre géométries tétraédrique et plane carrée offre une voie intramoléculaire pour l'isomérisation de composés tétraédriques. Cette voie ne fonctionne pas facilement pour les hydrocarbures mais les complexes tétraédriques de nickel(II), par exemple NiBr2(PPh3)2, peuvent subir cette transformation de manière réversible.
Géométrie moléculaire octaédrique
[modifier | modifier le code]On peut également obtenir des composés à structure plane carrée en retirant deux ligands suivant l'axe z d'un composé octaédrique, laissant quatre ligands dans le plan x-y. Pour les complexes de métaux de transition, la séparation dans le digramme d'orbitales du fait du champ cristallin pour la géométrie plane carrée peut être obtenue en dérivant le diagramme correspondant à la géométrie octaédrique. Le retrait de deux ligands stabilise le niveau dz2. laissant le niveau dx2-y2 très déstabilisé. En conséquence, dx2-y2 reste inoccupé dans les complexes de métaux de transition avec une configuration de type d8. Ces composés ont typiquement 16 électrons de valence (huit venant des ligands, huit du métal)[1].
Notes et références
[modifier | modifier le code]- (en) G. L. Miessler et D. A. Tarr, Inorganic Chemistry, Pearson/Prentice Hall, 3rd éd. (ISBN 978-0-13-035471-6 et 0-13-035471-6)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Square planar molecular geometry » (voir la liste des auteurs).


 French
French Deutsch
Deutsch
