Isotopes du néon — Wikipédia
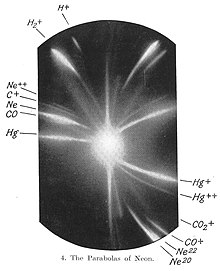
Le néon (Ne) possède 19 isotopes connus, de nombre de masse allant de 16 à 34. Parmi eux, trois sont des isotopes stables, 20Ne, 21Ne et 22Ne, qui représentent la totalité du néon naturellement présent. La masse atomique standard attribuée au néon est de 20,179 7(6) u.
Les 16 radioisotopes du néon, artificiels, sont tous à vie courte. Le radioisotope à la plus longue demi-vie est 24Ne avec 3,38 minutes. Tous les autres ont une demi-vie inférieure à une minute, et la plupart inférieure à une seconde. L'isotope le moins stable est 16Ne avec une demi-vie de 9 × 10−21 s[1]. Ce dernier se désintègre par double émission de proton en 14O, les autres isotopes plus légers que les isotopes stables se désintégrant soit par émission de positron (β+), capture électronique (dans ces deux cas en isotopes du fluor) voire par émission de positron et émission de proton (en oxygène) ou encore par émission de positron et émission alpha. Les isotopes les plus lourds se désintègrent eux tous en isotopes du sodium par désintégration β−, parfois également couplée avec une émission de neutron.
Néon naturel
[modifier | modifier le code]
Le néon naturel est constitué des trois isotopes stables 20Ne, 21Ne et 22Ne, le premier étant largement majoritaire. La composition isotopique est donnée pour l'air.
| Isotope | Abondance (pourcentage molaire) | Gamme de variations |
|---|---|---|
| 20Ne | 90,48 (3) % | 88,47 – 90,51 |
| 21Ne | 0,27 (1) % | 0,27 – 1,71 |
| 22Ne | 9,25 (3) % | 9,20 – 9,96 |
Table des isotopes
[modifier | modifier le code]| Symbole de l'isotope | Z (p) | N (n) | Masse isotopique (u) | Demi-vie | Mode(s) de désintégration[2],[n 1] | Isotope(s) fils[n 2] | Spin nucléaire |
|---|---|---|---|---|---|---|---|
| 16Ne | 10 | 6 | 16,025761(22) | 9×10−21 s [122(37) keV] | 2p | 14O | 0+ |
| 17Ne[n 3] | 10 | 7 | 17,017672(29) | 109,2(6) ms | β+, p (96,0 %) | 16O | 1/2- |
| β+, α (2,7 %) | 13N | ||||||
| β+ (1,3 %) | 17F | ||||||
| 18Ne | 10 | 8 | 18,0057082(3) | 1,672(8) s | CE | 18F | 0+ |
| 2p (possible 2He)[3] | 16O | ||||||
| 19Ne | 10 | 9 | 19,0018802(3) | 17,296(5) s+ | β+ | 19F | 1/2+ |
| 20Ne | 10 | 10 | 19,9924401754(19) | Stable | 0+ | ||
| 21Ne | 10 | 11 | 20,99384668(4) | Stable | 3/2+ | ||
| 22Ne | 10 | 12 | 21,991385114(19) | Stable | 0+ | ||
| 23Ne | 10 | 13 | 22,99446690(11) | 37,24(12) s | β− | 23Na | 5/2+ |
| 24Ne | 10 | 14 | 23,9936108(4) | 3,38(2) min | β− | 24Na | 0+ |
| 25Ne | 10 | 15 | 24,997737(28) | 602(8) ms | β− | 25Na | (3/2)+ |
| 26Ne | 10 | 16 | 26,000461(29) | 197(1) ms | β− (99,87 %) | 26Na | 0+ |
| β−, n (0,13 %) | 25Na | ||||||
| 27Ne | 10 | 17 | 27,00759(12) | 32(2) ms | β− (98,0 %) | 27Na | (3/2+)# |
| β−, n (2,0 %) | 26Na | ||||||
| 28Ne | 10 | 18 | 28,01207(16) | 18,3(22) ms | β− (78,0 %) | 28Na | 0+ |
| β−, n (22,0 %) | 27Na | ||||||
| 29Ne | 10 | 19 | 29,01939(29) | 15,6(5) ms | β− | 29Na | (3/2+)# |
| 30Ne | 10 | 20 | 30,02480(61) | 5,8(2) ms | β− | 30Na | 0+ |
| 31Ne | 10 | 21 | 31,03311(97)# | 3,4(8) ms | β− | 31Na | 7/2-# |
| β−, n | 30Na | ||||||
| 32Ne | 10 | 22 | 32,04002(86)# | 3,5(9) ms | β−, n | 31Na | 0+ |
| β− | 32Na | ||||||
| 33Ne | 10 | 23 | 33,04938(86)# | <260 ns | 7/2-# | ||
| 34Ne | 10 | 24 | 34,05703(87)# | 1# ms [>1,5 µs] | 0+ | ||
- Abréviation :
CE : capture électronique. - Isotopes stables en gras.
- Possède un halo à deux protons.
Remarques
[modifier | modifier le code]- La précision de l'abondance isotopique et de la masse atomique est limitée par des variations. Les échelles de variations données sont normalement valables pour tout matériel terrestre normal.
- Il existe des échantillons géologiques exceptionnels dont la composition isotopique est en dehors de l'échelle donnée. L'incertitude sur la masse atomique de tels spécimens peut excéder les valeurs données.
- Les valeurs marquées # ne sont pas purement dérivées des données expérimentales, mais aussi au moins en partie à partir des tendances systématiques. Les spins avec des arguments d'affectation faibles sont entre parenthèses.
- Les incertitudes sont données de façon concise entre parenthèses après la décimale correspondante. Les valeurs d'incertitude dénotent un écart-type, à l'exception de la composition isotopique et de la masse atomique standard de l'IUPAC qui utilisent des incertitudes élargies[4].
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Isotopes of neon » (voir la liste des auteurs).
Références
[modifier | modifier le code]- Voir isotopes du carbone pour plus d'informations sur cette mesure.
- (en) Universal Nuclide Chart
- (en) Physicists discover new kind of radioactivity Oct 24, 2000
- (en) « 2.5.7. Standard and expanded uncertainties », Engineering Statistics Handbook (consulté le )
Sources
[modifier | modifier le code]- Masse des isotopes depuis :
- (en) G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », Nuclear Physics A, vol. 729, , p. 3–128 (DOI 10.1016/j.nuclphysa.2003.11.001, Bibcode 2003NuPhA.729....3A, lire en ligne [archive du ])
- Compositions isotopiques et masses atomiques standards :
- (en) J. R. de Laeter, J. K. Böhlke, P. De Bièvre, H. Hidaka, H. S. Peiser, K. J. R. Rosman and P. D. P. Taylor, « Atomic weights of the elements. Review 2000 (IUPAC Technical Report) », Pure and Applied Chemistry, vol. 75, no 6, , p. 683–800 (DOI 10.1351/pac200375060683, lire en ligne)
- (en) M. E. Wieser, « Atomic weights of the elements 2005 (IUPAC Technical Report) », Pure and Applied Chemistry, vol. 78, no 11, , p. 2051–2066 (DOI 10.1351/pac200678112051, résumé, lire en ligne)
- Demi-vies, spins et données sur les isomères sélectionnés depuis les sources suivantes :
- (en) G. Audi, A. H. Wapstra, C. Thibault, J. Blachot and O. Bersillon, « The NUBASE evaluation of nuclear and decay properties », Nuclear Physics A, vol. 729, , p. 3–128 (DOI 10.1016/j.nuclphysa.2003.11.001, Bibcode 2003NuPhA.729....3A, lire en ligne [archive du ])
- (en) National Nuclear Data Center, « NuDat 2.1 database », Brookhaven National Laboratory (consulté en )
- (en) N. E. Holden et D. R. Lide (dir.), CRC Handbook of Chemistry and Physics, CRC Press, , 85e éd., 2712 p. (ISBN 978-0-8493-0485-9, lire en ligne), « Table of the Isotopes », Section 11
Voir aussi
[modifier | modifier le code]
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |


 French
French Deutsch
Deutsch