Sex-ratio — Wikipédia
Le sexe-ratio ou sex-ratio (nom masculin[1] ou féminin[2], souvent abrégé en « SR »), encore appelé rapport des sexes ou rapport de masculinité, est le rapport du nombre de mâles et de femelles au sein d'une espèce à reproduction sexuée, pour une génération, ou dans la descendance d'un individu. C'est un indice biologique important, car la proportion de mâles et de femelles peut affecter le succès reproductif. Chez certaines espèces, le sexe-ratio peut être un indicateur de la température du milieu d'incubation (par exemple, les tortues, chez lesquelles le sexe-ratio est fortement influencé dans l’œuf par la température) ou de l'exposition à des polluants qui sont aussi des perturbateurs endocriniens.
On distingue le sexe-ratio primaire, rapport du nombre d'individus de chaque sexe à la conception, du sexe-ratio secondaire, de chaque sexe à la naissance (ou éclosion), et du sexe-ratio tertiaire, rapport du nombre d'adultes de chaque sexe.
Formule
[modifier | modifier le code]
Commentaire
[modifier | modifier le code]On pourrait distinguer le sex-ratio de l'ensemble d'une population (personnes vivantes) et le sex-ratio à la naissance, néanmoins mathématiquement le sex-ratio à la naissance est bien un sex-ratio de l'ensemble d'une population de personnes vivantes, filtré sur l'âge de moins d'1 jour.
Emploi de la formule
[modifier | modifier le code]Exemple d'emploi de la formule :
Sex-ratio Paris (2003-2017 inclus) = 247297 naissances de sexe masculin / 225224 naissances de sexe féminin = 1,098[3]
Sex-ratio France entière (2004-2018 inclus) = 6139574 personnes vivantes au nées après le de sexe masculin / 5879846 idem féminin = 1,044[4]
Valeur minimale du sex-ratio France entière (2004-2018 inclus) : 1,031 (année 2014)
Valeur maximale du sex-ratio France entière (2004-2018 inclus) : 1,049 (année 2008)
Valeur minimale du sex-ratio Paris (2003-2017 inclus) : 1,077 (année 2008)
Valeur maximale du sex-ratio Paris (2003-2017 inclus) : 1,122 (année 2003)
Exemple d'analyse :
On constate que le sex-ratio varie dans le temps sans qu'aucun événement particulier ne justifie l'ampleur de ces variations. On constate que le sex-ratio varie dans l'espace et que ces variations sont durables (le minimum à Paris est toujours supérieur au maximum France entière, sur la période considérée). Mais l'échantillon considéré n'est pas du tout représentatif (1 seul pays et 1,5 décennie).
Le principe de Fisher
[modifier | modifier le code]Le principe de Fisher explique pourquoi, pour la plupart des espèces, le sexe-ratio est approximativement de 1:1. Il suppose que le « coût de production » soit identique pour produire un mâle ou une femelle.
William Donald Hamilton donna cette explication fondamentale dans son article « Extraordinary sex ratios »[5] de 1967 :
- Supposons que les naissances mâles soient moins fréquentes que les naissances femelles. La population comprend moins de mâles que de femelles.
- Un nouveau-né mâle a alors des chances d'accouplement plus élevées qu'une nouveau-née femelle. Par conséquent il peut s'attendre à avoir plus de descendants (qu'une femelle).
- Donc les parents génétiquement disposés à produire des mâles ont tendance à avoir un nombre de petits-enfants plus élevé que la moyenne.
- Par conséquent, les gènes qui tendent à produire des mâles se répandent, et les naissances mâles deviennent plus fréquentes.
- Lorsque le sexe-ratio s'approche de 1:1, l'avantage donné à la production de mâles diminue jusqu'à disparaître complètement.
- Ce raisonnement est identique si les rôles des femelles et des mâles sont inversés.
Le sex-ratio 1:1 est donc la stratégie évolutivement stable, c'est-à-dire la valeur d'équilibre du sexe-ratio.
Cette théorie, attribuée à Fischer qui l'a publiée en 1930 dans The Genetical Theory of Natural Selection, a initialement été émise par Charles Darwin dans sa première édition de Descent of Man. Il l'avait formulée en étudiant le sex-ratio des populations de Nouvelle Zélande et des îles Sandwich, « qui restait inégal longtemps après la pratique des infanticides de fille qui avaient pu le biaiser ». Toutefois, Darwin l'a retirée de la seconde édition, se disant incertain que les quelques cas de preuves relevés soient dignes de confiance[6].
Sex-ratio dans différents embranchements
[modifier | modifier le code]Dans le règne animal, le sexe-ratio a souvent tendance à privilégier les femelles, qui ont un investissement reproductif plus intense, ne réservant qu'un petit nombre de mâles qui en échange sont soumis à une pression de sélection supérieure (entraînant l'apparition de caractères sexuels secondaires parfois spectaculaires). Un cas extrême de ce principe est l'Hermaphrodisme successif, très répandu chez les poissons, qui fait que tous les individus naissent femelles et que seules les plus dominantes peuvent devenir, après un certain temps, mâles. Ce trait est cependant inversé quand l'investissement reproducteur est inverse, comme chez les poissons-clowns (où le mâle doit s'occuper des œufs).
Quand l'investissement reproducteur est symétrique (cas de nombreux oiseaux nidificateurs), le sexe-ratio est généralement de 1:1, avec la mise en place de couples monogames fidèles.
Les biais du sexe-ratio sont fréquents dans la nature pour de nombreuses espèces. Par exemple, chez les copépodes le rapport des sexes (ou sexe-ratio) est rarement voisin de 1, mais le plus souvent en faveur des femelles[7].
Par ailleurs, il existe des cas où il n’y a pas de mâle dans la population (pucerons, rotifères). La reproduction est alors un clonage de la femelle (elle procrée toute seule par parthénogenèse)[8].
Sexe-ratio chez les insectes
[modifier | modifier le code]Chez les hyménoptères sociaux, on observe un biais du sexe-ratio en faveur des femelles. Les hyménoptères sont haplodiploïdes, c'est-à-dire que le mâle est haploïde et issu d'un œuf non fécondé et la femelle est diploïde et issue d'un œuf fécondé. De ce fait, une ouvrière est génétiquement plus proche de ses sœurs ouvrières que de ses frères. La sélection de parentèle prédit donc qu'il est dans l'intérêt des ouvrières de privilégier le soin des femelles à celui des mâles. Ceci explique le biais de sexe-ratio observé[9].
Sexe-ratio chez les mammifères et les oiseaux
[modifier | modifier le code]D’après Fisher (1930)[10], la sélection naturelle favorise les parents investissant équitablement dans leurs fils et dans leurs filles, résultant en sexe-ratio proche de 1. Si celui-ci est biaisé, il y aura un rapide retour à l’équilibre : on parle de stratégie évolutivement stable (ESS).
Cependant, le modèle de Trivers et Willard (1973)[11] explique que, si la mère est en bonne condition (définie par la charge en parasites, dominance, taille du corps, etc.), le sexe-ratio aura tendance à être biaisé en faveur des mâles, qui ont un succès reproducteur plus sensible aux variations de conditions que les femelles et permettront donc à la mère d’obtenir plus de petits-enfants. La tendance inverse est observée dans un environnement où il y a une faible disponibilité en nourriture[12].
En effet, chez les oiseaux et les mammifères (comme les ongulés)[12], les mâles ont une croissance plus précoce et plus longue que celle des femelles, (donc un métabolisme impliquant de plus grands besoins nutritifs) et cette tendance est positivement corrélée au degré de dimorphisme sexuel. De ce fait, leur taux de survie est plus affecté par le manque de nourriture que celui des femelles. Bien que certaines études[13] expliquent cette mortalité différentielle des sexes par le refus de la mère de nourrir un des sexes, cette hypothèse n’est pas encore confirmée.
Néanmoins, chez la plupart des oiseaux et mammifères (entre autres, les psittacidés, les fringillidés...), les femelles atteignent leur maturité sexuelle un peu plus tardivement que les mâles. Au moment de la reproduction, la femelle a besoin de bien plus de nutriments que le mâle (par exemple, la ponte d'œufs demande énormément de calcium, lequel est puisé en partie dans les propres réserves de la mère) et est par conséquent plus susceptible de mourir que le mâle. Pourtant, alors que la très grande majorité des oiseaux est monogame, il naît chez la plupart des espèces un peu plus de mâles que de femelles[14].
Chez les marsupiaux, il naît plus de mâles que de femelles de manière générale, jusqu'à 2 voire 3 fois plus de mâles que de femelles. Néanmoins, certains facteurs comme la qualité de l'environnement accentuent encore le fait qu'il naît davantage de mâles que de femelles[14].
Sexe-ratio chez les reptiles
[modifier | modifier le code]De nombreux reptiles ont un sexe fixé non pas par détermination génétique mais par activation différenciée de certains gènes : par exemple, chez les tortues marines, c'est la température d'incubation qui détermine le sexe à la naissance, rendant ces populations particulièrement vulnérables au réchauffement climatique.
Quant aux crocodiles, toujours d'après le document Relations entre sex ratio et taille des populations chez les vertébrés, cela dépend d'un facteur en particulier : la taille. Les groupes où les individus atteignent de très grande taille comptent plus de mâles que de femelles. Concernant les groupes de taille moyenne, on observe un sexe-ratio équilibré de 1:1. Enfin, les groupes où les individus sont relativement petits comptent également plus de mâles que de femelles. On note que les mâles sont plus territoriaux, et donc risquent plus pour leur vie que les femelles qui, elles, sont plus cryptiques, ce qui augmente leurs chances de survie.
Sexe-ratio chez l'être humain
[modifier | modifier le code]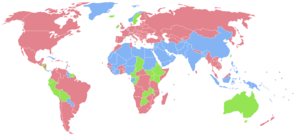
- Population féminine plus importante
- Populations masculine et féminine équivalentes
- Population masculine plus importante
- Données manquantes
Le sexe-ratio moyen à la naissance observé chez l'être humain est d'environ 105, l'excédent de naissances se trouvant chez les mâles[15]. Selon les estimations de l'ONU pour 2009, le rapport est de 102 à 100 sur l'ensemble de la population mondiale[16]. En réalité, il est toujours né plus de garçons que de filles (les statistiques ont toujours montré qu'il naissait un peu plus de garçons que de filles et, en temps de guerre, encore davantage de garçons[réf. nécessaire]), sans qu'on sache si cela comptabilise les infanticides liés au sexe.
Ainsi, pour la tranche d'âge des 0 - 14 ans, on dénombre 962 504 434 de garçons pour 897 959 144 filles, soit un sexe-ratio de 107 garçons pour 100 filles.
Par âge
[modifier | modifier le code]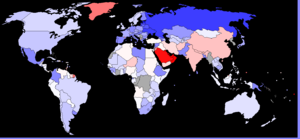


Le sexe-ratio par âge est le rapport du nombre de garçons au nombre de filles dans une tranche d'âge donnée. À la naissance, il est supérieur à 1 mais varie peu : de 1,03 à 1,07[17].
En France, il y a environ 105 garçons pour 100 filles à la naissance. En Chine, il naît officiellement autour de 120 garçons pour 100 filles, ce qui suggère qu'il existe une pratique d'avortement sélectif.
En Allemagne (qui est assez représentative du sex ratio dans les pays développés où l'accès aux soins de santé est accessible à l'ensemble de la population), on a[18] :
- à la naissance : 1,06 garçon/fille
- 0-14 ans : 1,06 garçon/fille
- 15-24 ans : 1,04 garçon/fille
- 25-54 ans : 1,03 homme/femme
- 55-64 ans : 0,98 homme/femme
- 65 ans et plus : 0,78 homme/femme
Ainsi, en Allemagne, on observe que dans les tranches d'âge plus jeunes (les moins de 55 ans), il y a plus d'hommes que de femmes et que dans les tranches d'âges plus âgées (à partir de 55 ans), on compte plus de femmes que d'hommes.
Ceci s'explique en partie du fait que les femmes naissent avec des télomères légèrement plus longs que ceux des hommes. Or, la longueur des télomères détermine la vitesse de vieillissement (http://www.informationhospitaliere.com/actualite-8325-telomeres-cle-longevite-femmes.html). C'est pourquoi, à conditions de vie égales, les femmes vivent en moyenne 6 à 7 ans de plus que les hommes.
Une autre raison est que les hommes sont plus touchés par le cancer et les maladies cardiovasculaires (d'après la Ligue contre le cancer et Passeportsante.net).
Par ailleurs, chez les jeunes, les garçons ont des comportements plus à risque, plus dangereux que les filles (par exemple, selon les chiffres publiés par la Sécurité routière (Roulons-Autrement.com) en France, les hommes dominent de très loin les statistiques en matière d’accidentalité routière : 76 % des personnes décédées sur les routes françaises en 2012 étaient des hommes. En 2000, les hommes représentaient 92 % des conducteurs impliqués dans un accident mortel lié à l’alcool en 2012[pas clair] et 89 % des retraits de permis en 2011).
Pour la France (qui est un pays plus féminin que le précédent), on observe[19] :
- À la naissance : 1,05 garçon/fille
- 0-14 ans : 1,05 garçon/fille
- 15-24 ans : 1,05 garçon/fille
- 25-54 ans : 1,01 homme/femme
- 55-64 ans : 0,93 homme/femme
- 65 ans et plus : 0,75 homme/femme
En 2015, en France, il y a plus d'hommes que de femmes dans chaque tranche d'âge de moins de 25 ans et plus de femmes que d'hommes dans chaque tranche d'âge de plus de 25 ans. Les femmes sont globalement plus nombreuses que les hommes.
Pour des raisons biologiques comme sociologiques, le sexe-ratio est déjà différent pour les enfants de moins de cinq ans (le ). Si on remonte dans le passé, selon les statistiques de l'INSEE, le nombre de femmes à 25 ans devient déjà plus grand que celui des hommes du même âge, mais les surfaces des deux côtés de la pyramide penchent encore en faveur d'une surpopulation masculine[20]. À partir de trente ans (entre 35[21] et 49 ans[22] en France, contre 25 en 1950), la prépondérance s'inverse et le nombre de femmes l'emporte généralement sur le nombre d'hommes. Et pour les centenaires, huit centenaires sur dix sont des femmes. Malgré de notables disparités régionales : une carte des âges de décès moyens par départements établie par la revue Populations et société dans les années 1980 montrait une différence de dix ans entre le Nord-Est et le Sud-Ouest de la France. Le climat plus clément de celui-ci peut sans doute y attirer aussi davantage de retraités, la Côte d'Azur (Sud-Est) étant pour sa part beaucoup plus onéreuse.
Anomalies récentes du sexe-ratio primaire et secondaire
[modifier | modifier le code]Plusieurs anomalies sont observées :
- dans certains pays asiatiques, où les parents privilégient les garçons en recourant à l'avortement voire l'infanticide envers les filles ;
- dans la plupart des pays riches où on constate depuis l’après-seconde Guerre mondiale une baisse du nombre de naissances des garçons par rapport à celle des filles[réf. nécessaire] ;
- au sein de certaines populations exposées à certains polluants (îles Féroé par exemple ou communautés amérindiennes d'Amérique du sud ou du nord)[réf. nécessaire].
Anomalies du sexe-ratio dans les pays riches
[modifier | modifier le code]Møller cite[23] plusieurs rapports et articles publiés avant la fin des années 1990 et notant une diminution du nombre de naissances de garçons par rapport aux filles dans les pays riches, avec cependant des variations d’ampleur du phénomène selon les pays. En étudiant les sexe-ratio des 4 pays scandinaves (Il a pu remonter jusqu'en 1750 pour la Suède), il confirme une tendance récente de diminution du ratio garçons/filles depuis l’après-Seconde Guerre mondiale. Ce phénomène semble accompagner une croissance de l’incidence du cancer des testicules, et un syndrome de délétion de la spermatogenèse. La corrélation entre ces trois problèmes pourrait laisser supposer l'existence d'une cause ou plusieurs causes communes, encore inconnues. Il a été avancé comme cause possible une exposition à des perturbateurs endocriniens à dioxines et au dichlorobromopropane (connu pour diminuer la fécondité et modifier le sexe-ratio de la descendance) et à des polluants reprotoxiques.
La Finlande fait exception : les hommes y ont le moins de risque de cancer des testicules et le plus grand nombre de spermatozoïdes, mais paradoxalement dans ce pays, que la baisse du sex-ratio semble la plus rapide encore non expliquée en Finlande pour le nombre de spermatozoïdes et le poids des testicules qui diminue moins qu'ailleurs). Chez des cas-témoin, le taux de garçons, conçus avant un diagnostic de cancer des testicules (47 %), est inférieur à celui observé dans l'ensemble de la population (51,4 %). Par ailleurs, ces hommes (diagnostiqués porteur d’un cancer des testicules) ont eu moins d'enfants que les hommes témoins d'âge comparable.[évasif]
Anomalies du sexe-ratio en Asie
[modifier | modifier le code]En Amérique du Nord et en Europe, le sexe-ratio est d'environ 1,05. En Inde et Asie, plutôt de 1,07.
Ces déséquilibres sont très présents en Chine et en Inde. Les inquiétantes variations au-delà des 1,10 sont récentes : on peut observer des de 1,20 en 2000 en Chine (et même de 1,32 au Henan, au sud de Pékin), de 1,13 en Corée du Sud, de 1,26 au Penjab et jusqu'à 1,69 à Daman[24]. En 2017, la Corée du Sud est revenue à un taux de 1,07[25].
Les causes en sont :
- certains facteurs de stress (guerre, attentats, crise…) ;
- l'avortement sélectif ;
- l'infanticide sélectif (mis au compte des mort-nées) ;
- la négligence infantile sélective (plus de soins portés aux garçons).
Il y a plusieurs explications à cela :
- dans de nombreuses cultures orientales, lorsque la fille se marie, la famille doit verser une dot à la famille du marié ;
- dans la tradition confucéenne, seul le garçon est habilité à perpétuer le culte des ancêtres et à s'occuper de ses parents en fin de vie ;
- l'homme hérite du nom et de l'honneur de sa famille alors que la femme perd son nom (remplacé par celui du mari) ;
- souvent dans les milieux ruraux, la fille ne peut pas travailler ;
- la pauvreté de nombreuses familles en Chine et en Inde les pousse à calculer la rentabilité de leurs enfants, cela renforcé par la politique de l'enfant unique en Chine ;
- la possibilité de l'avortement en connaissance du sexe du bébé (bien qu'illégal) facilite l'élimination des bébés filles, (à noter que l'infanticide est assez répandu)[26] ;
- les hommes héritent des biens familiaux alors que les femmes n'en ont pas le droit ;
- beaucoup de femmes sont déplacées des campagnes vers les villes, pour être achetées et mariées (trafic de femmes).
En Chine, on estime le déficit à environ quarante millions de femmes sur une population d'1,3 milliard. Autant en Inde selon Amartya Sen (lauréat du "prix Nobel d'économie" en 1998) qui a bien analysé les causes et les conséquences d'une telle évolution : sociologiquement, l'enfant mâle est valorisé pour des raisons de patronyme et de culte aux ancêtres ; économiquement, la force de travail d'un garçon et sa « rentabilité » économique sont mieux considérées. D'où, avec la pratique de la restriction sévère de la natalité, ces choix parentaux proches du « sexocide ». La pratique de l'IAC (insémination artificielle entre conjoints) accroît la dérive du sexe-ratio. La conséquence la plus évidente à terme sera un déséquilibre sur le marché matrimonial.
Pour pallier cette dérive, l'Inde offre une prime aux parents n'ayant qu'une fille, par exemple en Andhra Pradesh (province du sud du Dekkan). Il n'y a pas de solution simple en vue tant que la transition démographique ne sera pas effectuée. La situation du Bangladesh, pays où la densité de population est la plus élevée au monde (seulement dépassée par quelques micro-états), avec une moyenne de 1083 hab./km2 début 2005, et de grande pauvreté, reste préoccupante.
Le stress favorise la survie des embryons féminins
[modifier | modifier le code]L'étude du sexe-ratio des fausses couches, par exemple récemment après les attentats du aux Etats-Unis, montre que chez les mères stressées il y a plus de morts in utero de garçons. Et les registres de naissances américains ont vu diminuer les naissances de garçons, notamment au mois de décembre qui a suivi l'attentat.
Ceci confirme d'autres études plus anciennes qui ont par exemple concerné les mères enceintes au moment du tremblement de terre de Kobe.
Des catastrophes écologiques, des crises économiques ont aussi été reliées à une inversion du sexe-ratio en faveur des filles, phénomène qui pourrait résulter de la sélection naturelle.
Anomalie induite par des infections microbiennes
[modifier | modifier le code]On sait maintenant que la toxoplasmose affecte le sexe-ratio des naissances, au moment de l'élimination naturelle des embryons non viables.
Les garçons sont favorisés chez les femmes enceintes qui ont été contaminées peu avant le début de leur grossesse par Toxoplasma gondii, parce qu'elles ont plus de chances que les autres de mener leur grossesse à terme. Plus le titrage d'anticorps contre le parasite est élevé, plus ceci est vrai, alors que la différence est minime entre les femmes ayant un faible titrage (qui signifie que l'infection date de longtemps avant la conception du fœtus) et celles qui n'ont jamais été infectées par le Toxoplasma. Selon une étude de 2006 l'immunosuppression induite par le parasite pourrait éventuellement être en cause, en limitant le risque d'élimination de l'embryon mâle en bloquant les actions du système immunitaire maternel contre les antigènes mâles HY, ce qui restait à démonter via l'expérimentation animale[27].
Anomalies induites par certains polluants
[modifier | modifier le code]Les garçons naissent anormalement moins nombreux que les filles dans des populations dont les pères ont été exposés à la dioxine[28], dont les familles ont été exposées au méthylmercure (lors du scandale de Minamata par exemple[29], aux pesticides[30],[31],[32], et selon Fukuda et al. (2002) au tabagisme parental[33].
L'hypothèse explicative la plus partagée est que certains de ces produits chimiques acquis à partir de l'environnementaux, des activités professionnelles, de l'orpaillage, de la consommation de gibiers de viande de mammifères marins (baleine, cachalot, dauphin...) ou poissons gras pourraient agir comme composés perturbateurs endocriniens (EDC) et influencer le sexe-ratio des couples en perturbant leur équilibre hormonal des (James 1996), ou en induisant une mortalité spécifique de spermatozoïdes ou précoce d'embryons selon leur sexe[29].
Les relations entre expositions aux polluants de type perturbateurs endocriniens, tels que les polychlorobiphényles (PCB), le dichlorodiphényldichloroéthylène (DDE) et le mercure (via le méthylmercure en général) ont montré des résultats contradictoires selon les études[34], avec par exemple une diminution du ratio uniquement lorsque les pères exposés avaient moins de 20 ans[35] ou avec une diminution légère et jugée non significative au détriment des garçons, toujours en cas d'exposition des pères[36]
- L'effet isolé et combiné de ces polluants sur le sexe-ratio dit « secondaires » a été récemment confirmé dans un sens contraire à celui attendu par une étude basée sur 23 ans de données de suivi de 2152 dyades mères-enfants saines recrutées de 1986 à 2009 dans les îles Féroé (où l'alimentation, qui inclut la viande de baleine et d'autres mammifères marins) est particulièrement chargée en ces 3 polluants pour lesquels l'exposition des mères peut être facilement mesurée dans les cheveux maternels, le sérum ou le sang du cordon ombilical[34]. Une fois éliminés les facteurs de confusion les auteurs ont conclu qu'un doublement des contaminations des mères par ces produits était associé à une légère augmentation de la probabilité d'avoir un garçon (+ 8 % pour les PCB, +7 % pour le DDE et + 9 % pour le méthylmercure. Les auteurs précisent qu'ils n'ont pas pu étudier les expositions paternelles, qui pourraient éventuellement aussi jouer un rôle[34].
- Un phénomène similaire, mais inverse en termes de sex-ratio (ce sont ici les filles qui sont anormalement plus nombreuses à la naissance, avec par exemple Chez les Aamjiwnaang un taux de naissance de garçons qui a continuellement décliné du début des années 1990 à 2003) est observé chez certaines communautés autochtones amérindiennes d'Amérique du Nord[37].
Histoire de l'étude du sexe-ratio dans la population humaine
[modifier | modifier le code]Le débat sur le taux de masculinité apparaît au XVIIIe siècle dans un souci tantôt plutôt scientifique et tantôt davantage théologique. C'est un auteur allemand qui remarque la surreprésentation des garçons à la naissance à cette époque[38].
Au départ, s'interroger sur le phénomène qu'il relève n'est pas une chose évidente, et un certain nombre d'auteurs tels que d'Alembert et Adolphe Quetelet estiment qu'il n'y a pas à étudier la question. Parmi les arguments avancés, la surmortalité masculine dans la jeunesse, qui fait disparaître la différence entre filles et garçons avec le temps et transforme donc les spéculations en pur exercice de style. D'après Éric Brian et Marie Jaisson, auteurs contemporains spécialistes du sexe-ratio, cette vision qui faisait de l'un des deux phénomènes la compensation de l'autre valorisait en fait inconsciemment le modèle monogamique du mariage défendu par l'Église catholique : l'idée qu'il y aurait un équilibre naturel des deux sexes à l'âge nubile invitait à penser la fidélité conjugale comme une évidence qu'il n'y avait pas de raison de remettre en cause, chacun pouvant trouver un partenaire pour former un couple dans le mariage chrétien[38].
Cette vision n'empêche pas, cependant, le développement d'hypothèses. Pour Laplace, qui compare le taux de masculinité à Paris et à Londres, la variable est déterminée par une cause physique, climatique par exemple. De son côté, Condorcet ne croit pas aux explications déterministes et est le premier à envisager une intervention humaine sur le taux de masculinité dans le cadre d'une politique morale. Mais sa position, pour avoir été rédigée à la main, se perd, ce qui permet la perpétuation des considérations les plus naturalistes au XIXe siècle[38].
Au début du XXe siècle, Maurice Halbwachs se penche à nouveau sur la question à la faveur d'une démographie comparée de l'espèce humaine commandée par une encyclopédie. À la fois disciple d'Émile Durkheim et d'Henri Bergson, il développe une approche mixte qui l'amène à s'interroger sur l'influence de la différence d'âge entre les parents, l'âge étant pour lui un terme médian entre le social et le biologique, et donc tout indiqué pour étudier le problème. Son hypothèse ne tient pas, car il n'y a pas de relation entre le sex ratio et la différence entre l'âge des parents, mais il se distingue néanmoins par son approche qui ne privilégie plus l'explication naturelle[38].
En outre, Maurice Halbwachs est le premier à faire le constat d'une augmentation du taux de masculinité à la fin de la Première Guerre mondiale alors même que depuis 1846 il avait jusqu'alors tendance à diminuer de façon régulière. Depuis lors, les chercheurs ont pu constater une reprise de la baisse tendancielle et une interruption momentanée à la fin de la Deuxième Guerre mondiale, ce qui laissait entrevoir des variables nouvelles à considérer. Néanmoins, d'après Éric Brian et Marie Jaisson, le débat s'est éteint en faveur du préjugé qui fait du plus grand nombre de garçons à la naissance une constante que ne sauraient remettre en cause les différences géographiques, considérées comme des défauts localisés créés de toutes pièces, par exemple par la politique de l'enfant unique en Chine[38].
Pourtant, on connaît désormais plusieurs variables pertinentes, outre les guerres : les naissances en ville sont plus féminines que les naissances à la campagne, peut-être par une promiscuité plus importante et aujourd'hui par une exposition à des perturbateurs endocriniens plus présents en ville qu'ailleurs. Par ailleurs, la légitimité des naissances et le taux de fécondité a également un impact sur le taux de masculinité. Ces données laissent penser que le taux de masculinité à la naissance a à voir avec les variations du degré d'investissement dont fait l'objet la femme enceinte et le nouveau-né selon les milieux. Ainsi, si le taux de masculinité est plus faible au Mexique qu'en France, c'est sans doute parce que la prise en charge de la grossesse s'exerce dans un contexte masculin dans le pays d'Europe alors qu'il est nettement plus féminin en Amérique centrale : en France, la grossesse est médicalisée et les médecins sont avant tout des hommes ; au Mexique, pays marqué par l'émigration masculine, elle est davantage gérée par les femmes de l'environnement de la personne enceinte. Or, les études montrent qu'il y a un net surinvestissement médical et des hommes en faveur des garçons qui vont naître ou viennent de naître[38], surinvestissement qui s'expliquerait notamment par le fait que ces derniers sont plus fragiles que les filles qui vont naître ou viennent de naître[39].
Ces explications interviennent dans un contexte qui voit la remise en cause de la surmortalité des nouveau-nés masculins par les historiens, qui considèrent qu'il y a un biais de déclaration : l'enfant masculin étant plus désiré, la perte de celui-ci à la naissance est davantage déclarée que celle d'une petite fille, qui demeure sous-déclarée[38].
Localement, un autre biais statistique peut provenir d'une sous-déclaration des fausses-couches ou du fait que des nouveau-nés "anormaux" soient tués à la naissance (par exemple chez certaines populations amérindiennes exposées au mercure de l'orpaillage. Traditionnellement, les handicaps physiques qui pourraient affecter la survie en forêt ne sont pas acceptés dans ces tribus)[réf. nécessaire].
Évolution du sex-ratio
[modifier | modifier le code]Chez les animaux sexués, l’anisogamie (la différence de taille entre les gamètes mâles et femelles) est le mode le plus présent. Les gamètes mâles sont en grand nombre et de petite taille, tandis que les gamètes femelles sont de grande taille et en petit nombre.
Partant de ce principe, peu de mâles seraient suffisants pour la fécondation de plusieurs femelles. Afin de maximiser la croissance de la population, il serait plus intéressant de produire plus de femelles que de mâles (du moment qu’il y ait assez de mâles pour féconder toutes les femelles).
Or, on constate que la majorité des espèces possède un sexe-ratio de 1:1.
Cela n’est pas initialement dû à la séparation égale des chromosomes sexuels durant la méiose, car il existe des espèces sans déterminisme sexuel génétique possédant un sex-ratio de 1:1. À l’inverse, certaines espèces à déterminisme sexuel génétique ont un sexe-ratio biaisé. Les déterminismes sexuels de type X/Y et W/Z ont été sélectionnés car ils permettent par le biais du hasard de tendre vers un sexe-ratio 1:1 (50 % de chance durant la méiose d'obtenir un gamète portant le chromosome X ou le chromosome Y).
Sexe-ratio de 1:1
[modifier | modifier le code]Pour une population, la stratégie d’adopter un sexe-ratio équilibré 1:1 est, dans un cas Fisherien, évolutivement stable.
En effet, dans The Theory of Sex Allocation (1982)[40], Charnov démontre que dans ce cas, la valeur du sexe-ratio optimale pour qu’un individu mutant adoptant une stratégie autre (en l'occurrence, un sexe-ratio biaisé) n’envahisse pas la population, est 1:1. En d’autres termes, dans une population à sexe-ratio 1:1, aucune autre stratégie ne peut être adoptée durablement.
Par conséquent, dans une grande population, le sexe-ratio tend à s'équilibrer par des phénomènes de fréquence dépendance négative (Principe de Fisher). Le sexe-ratio joue directement sur le taux de reproduction d'une population, ce qui peut diminuer le taux d'accroissement de celle-ci en cas de sexe-ratio biaisé. Ceci à des conséquences importantes dans les petites populations : un sexe-ratio biaisé, du fait de la stochasticité démographique, peut mener à l'extinction de celle-ci. Les extinctions de populations peuvent mener à une extinction de l'espèce.
Sexe-ratio biaisé
[modifier | modifier le code]Impact du climat[41]
[modifier | modifier le code]Le climat fait partie des facteurs de détermination environnementaux pouvant biaiser le sexe-ratio primaire 1:1.
Chez certains reptiles, l'activité et/ou l'expression des gènes responsables de la détermination du sexe sont thermo-dépendants, et peuvent s’activer ou non en fonction de la température. Lorsque la température d’incubation est moyenne, le sexe-ratio est déterminé par la méiose (1 :1), alors que dans le cas de températures extrêmes, le sexe-ratio est fortement biaisé.
Chez l'Agame barbu (Pogona vitticeps), le sexe-ratio secondaire est équilibré entre 22 et 32 °C, et lorsque la température d’incubation est comprise entre 34 et 37°, le sexe-ratio secondaire est biaisé en faveur des femelles.
Impact de la quantité de ressources[42]
[modifier | modifier le code]Un des facteurs pouvant biaiser le sexe-ratio est la quantité de ressources. En effet, en fonction de la ressource disponible pour les futurs descendants, certaines espèces peuvent être amenées à modifier leur sexe-ratio afin de favoriser le sexe ayant la meilleure fitness.
Chez l'espèce de guêpe parasitoïde (Lariophagus distinguendus), qui attaque et pond des œufs dans des larves de charançons (Sitophilus granarius), la taille de l'hôte déterminera la taille des descendants (ayant eu plus ou moins de nourriture). De plus, l'augmentation de la taille de l'hôte profite plutôt à une descendante femelle, car une grosse femelle produit plus de descendants qu'un gros mâle.
Dans une expérience menée par Charnov et ses collaborateurs, on constate que les mères sont capables de modifier leur sexe-ratio de ponte (par haplodiploïdie) en fonction de la taille des hôtes disponibles, et donc de la quantité de ressources. Plus ces hôtes étaient gros, plus elles produisaient des femelles. Plus ils étaient petits, plus elles produisaient des mâles.
Une mère peut ainsi améliorer sa fitness en fonction de la quantité de ressources à sa disposition.
Impact de la compétition[43]
[modifier | modifier le code]Le sexe-ratio d’une population peut être biaisé par l’intensité de la Local Mate Competition (compétition pour l’accès aux partenaires sexuels).
Par exemple, les femelles araignées rouges (Tetranychus urticae) ont la capacité de modifier le sexe-ratio de leur progéniture par haplodiploïdie. Lorsqu’il existe une compétition entre mâles pour l’accès à la reproduction (accès aux femelles), la fitness des descendants femelles augmente, celle des mâles baisse. Les mères ont donc intérêt à produire des femelles pour améliorer leur fitness : le sexe-ratio devient biaisé en faveur des femelles.
Impact des helpers[44]
[modifier | modifier le code]Quand des individus appelés “helpers” améliorent la fitness de leurs parents (en aidant par exemple à élever les petits), les couples reproducteurs vont préférentiellement produire ce sexe aidant et ainsi biaiser le sexe-ratio.
La variation du sexe-ratio chez certaines espèces, comme la Fauvette des Seychelles (Acrocephalus sechellensis), est en outre cohérente avec l’hypothèse de la compétition locale pour les ressources (Local Resource Competition ou LRC). En biaisant le sexe-ratio de leurs petits en faveur des mâles (qui dispersent) dans des territoires de basse qualité et en faveur des femelles (qui ne dispersent pas) dans des territoires de bonne qualité, les Fauvettes évitent ainsi d’avoir de la compétition sur les territoires de basse qualité (LRC), et bénéficient de la coopération entre apparentés sur les territoires de bonne qualité (Local Resource Enhancement ou LRE).
Impact de l'attractivité[45]
[modifier | modifier le code]L’ornementation des adultes est aussi un facteur pouvant influencer le sexe-ratio.
En effet, il sera biaisé en faveur du sexe du parent ayant une attractivité plus forte. Ainsi, si une femelle est plus attractive (plus souvent préférée) qu’un mâle, le sexe-ratio de leurs descendants sera biaisé en faveur des femelles, et inversement.
Parfois, comme chez le Diamant mandarin (Poephila guttata), les mâles les plus attractifs vont même préférer les femelles moyennement attractives, afin de biaiser le sexe-ratio de naissance en faveur des mâles et transmettre davantage leurs gènes.
Impact de la densité de population[46]
[modifier | modifier le code]Le sexe-ratio peut être fortement influencé par la densité de la population.
Chez le cerf élaphe (Cervus elaphus), on observe, à faible densité de population, que les femelles dominantes produisent plus de mâles que de femelles. Cependant, cette relation disparaît à forte densité : les femelles dominantes tendent à équilibrer le sex-ratio de leurs descendants.
Il existe alors une corrélation de densité-dépendance négative entre le sex-ratio et la densité de la population.
Impact des distorteurs génétiques[47]
[modifier | modifier le code]Les distorteurs du sexe-ratio sont des gènes égoïstes situés sur des chromosomes sexuels.
Dans le but de favoriser leur propre transmission, ils peuvent produire un ARN ou une protéine empêchant la production de gamètes contenant le chromosome sexuel opposé. Seul un des deux sexes pourra donc être produit, et le sexe-ratio de la population sera biaisé. Toutefois, des éléments suppresseurs de distorsion peuvent apparaître, le plus souvent sur des autosomes, et inhiber l’élément distorteur, rétablissant ainsi un sexe-ratio de 1:1, comme chez Drosophilia simulans où l’on a découvert un suppresseur sur le chromosome 3, inhibant les distorteurs présents sur le chromosome X.
Impact des parasites[48]
[modifier | modifier le code]Les parasites intra-cytoplasmiques ne sont transmis aux descendants que par la mère (les mâles ne transmettant que le noyau de leur gamète, les femelles tout leur ovule). Ils peuvent modifier le sexe de la progéniture de leurs hôtes pour être transmis d’une génération à l’autre (transmission verticale). Par exemple, Wolbachia transforme les œufs génétiquement mâles de son hôte (A.vulgare) en femelles fonctionnelles, ce qui biaise le sexe-ratio en faveur des femelles.
Impact du coût de production
[modifier | modifier le code]Une hypothèse serait également que chez certaines espèces l’un des sexes est plus coûteux à produire. Ces coûts de production différents peuvent amener des populations à ne pas suivre l'équilibre 1:1 de Charnov, ce qui modifierait la fitness de l’un des sexes et entraînerait des conflits intergénérationnels.
Chez les Inuits où le nombre de garçons dépassait tellement celui des filles que de nombreuses personnes ont conclu à des infanticides de petites filles, des chercheurs se sont interrogés sur l'avantage évolutif de les éliminer alors que leur « coût d'élevage » était moindre que celui des garçons. Ils ont conclu que grâce à leur travail à l'âge adulte, les garçons « remboursaient » ce différentiel de coût[49]).
Tous ces exemples montrent que le sexe-ratio peut être biaisé par de nombreux facteurs, malgré les avantages évolutifs d’un sexe-ratio 1:1 dans des cas Fisheriens (même coût de production entre petits mâles et femelles). Il existe des interactions possibles entre ces facteurs biaisants (exemple des Helpers avec l’interaction entre LRC et LRE).
La capacité individuelle de modifier son sexe-ratio primaire est une adaptation aux variations de l'environnement et des interactions biotiques[50]. Un facteur peut biaiser le sexe-ratio d'une population ayant perdu cette adaptation, ce qui peut entraîner l'extinction de cette population[51].
Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sex ratio » (voir la liste des auteurs).
- Définition du mot correspondant sur le site du Dictionnaire Larousse.
- Le Petit Larousse en couleur, Librairie Larousse, Paris, 1990, p. 909.
- Liste des prénoms 2004 à 2018, Ville de Paris
- Population totale par sexe et âge au 1er janvier 2019, France, Bilan démographique 2018, Insee
- (en) Hamilton, W.D. 1967 Extraordinary sex ratios Science 156: 477-488, article payant
- Martin J. Osborne, « Darwin, Fisher, and a theory of the evolution of the sex ratio », sur economics.utoronto.ca, 1996-2019
- Sex ratio des Copépodes planctoniques marins
- « ecosociosystemes.fr/sexratio.h… »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- À ce sujet consulter S. Aron et L.Passera, 2000, Les sociétés animales - Évolution de la coopération et organisation sociale De Boeck Université p. 101-115 et Trivers R. et Hare H. 1976, Haplodiploidy and the evolution of the social insects. Science 191, p. 249-263
- Ronald Aylmer Fisher, The Genetical Theory of Natural Selection (Clarenton, Oxford, 1930), 307 p.
- R. L. Trivers et D. E. Willard, Natural Selection of Parental Ability to Vary the Sex Ratio of Offspring dans Science, New Series, vol.179, no 4069, 1973, p. 90-92
- T. H. Clutton-Brock, S. D. Albon et F. E. Guiness. Parental Investment and Sex Differences in Juvenile Mortality in Birds and Mammals dans Nature, vol.313, 1985, p. 131-133
- P. A. McClure, Sex-Biased Litter Reduction in Food-Restricted Wood Rats (Neotoma-Floridana) dans Science, vol.211, no 4486, 1981, p. 1058-1060
- http://www.enssib.fr/bibliotheque-numerique/documents/61420-relations-entre-sex-ratio-et-taille-de-population-chez-les-vertebres.pdf.
- http://www.nationmaster.com/graph/peo_sex_rat_tot_pop-people-sex-ratio-total-population : détails par pays
- (en) [1] sur The World Factbooks, d'après The World Factbook 2017. Washington, DC: Central Intelligence Agency, 2017..
- Les populations de la planète ayant des alimentations très différentes, on voit donc que les régimes alimentaires censés favoriser la naissance de l'un ou l'autre sexe ne disposent que d'une marge étroite.
- (World Factbook Germany, 2015 est.)
- (World Factbook France, 2015)
- « Bilan démographique 2019 », sur insee.fr (consulté le ).
- Lexique de la Cité des Sciences et de l'Industrie
- selon la revue de l'INED Population et sociétés
- Henrik Møller (1998) ;Tendances relatives au sex-ratio, au cancer des testicules et aux dangers pour la reproduction chez l'homme : Ces facteurs sont-ils liés? ; Centre McLaughlin, Institut de recherche sur la santé de la population, Université d'Ottawa
- Statistique du ministère de l'interieur indien
- The World Factbook
- « Démographie : les filles sacrifiées d'Asie », Le Monde.fr, (lire en ligne, consulté le )
- Marina Casselyn (2006) La toxoplasmose bouscule le sex-ratio des naissances |Rev Med Suisse 2006 | vol.2. 2352 (résumé)
- Paternal concentrations of dioxin and sex ratio of offspring. Mocarelli P, Gerthoux PM, Ferrari E, Patterson DG Jr, Kieszak SM, Brambilla P, Vincoli N, Signorini S, Tramacere P, Carreri V, Sampson EJ, Turner WE, Needham LL Lancet. (2000) 27 mai | 355(9218):1858-63.
- Sakamoto M, Nakano A & Akagi H (2001) Declining Minamata male birth ratio associated with increased male fetal death due to heavy methylmercury pollution. | Environ Res.| Oct; 87(2):92-8.
- Garry VF, Holland SE, Erickson LL, Burroughs BL (2003) Male reproductive hormones and thyroid function in pesticide applicators in the Red River Valley of Minnesota. J Toxicol Environ Health A.|13 juin | 66(11):965-86.
- Goldsmith JR Ann (1997) Dibromochloropropane: epidemiological findings and current questions. N Y Acad Sci. |26 décembre | 837():300-6.
- Jarrell JF, Gocmen A, Akyol D & Brant R (2002) Hexachlorobenzene exposure and the proportion of male births in Turkey 1935-1990 |Reprod Toxicol. |Jan-Fév ; 16(1):65-70.
- Fukuda M, Fukuda K, Shimizu T, Andersen CY & Byskov AG (2002), Parental periconceptional smoking and male: female ratio of newborn infants |The Lancet | 20 avril |359(9315):1407-8.
- Clara Amalie Gade Timmermann & al. (2017) Secondary sex ratio in relation to exposures to polychlorinated biphenyls, dichlorodiphenyl dichloroethylene and methylmercury | mis en ligne le 01 Décembre | https://doi.org/10.1080/22423982.2017.1406234 (résumé)
- (en) Iliana del Rio Gomez, Tom Marshall, Peichien Tsai et Yu-Shuan Shao, « Number of boys born to men exposed to polychlorinated byphenyls », The Lancet, vol. 360, no 9327, , p. 143–144 (DOI 10.1016/S0140-6736(02)09386-8, lire en ligne, consulté le )
- (en) the Great Lakes Consortium, Marc G Weisskopf, Henry A Anderson et Lawrence P Hanrahan, « Decreased sex ratio following maternal exposure to polychlorinated biphenyls from contaminated Great Lakes sport-caught fish: a retrospective cohort study. », Environmental Health, vol. 2, no 1, , p. 2 (ISSN 1476-069X, PMID 12694628, PMCID PMC153540, DOI 10.1186/1476-069X-2-2, lire en ligne, consulté le )
- Mackenzie C.A, Lockridge A & Keith M (2005) Declining sex ratio in a first nation community. Environmental health perspectives, 113(10), 1295.
- Le sexisme de la première heure, Éric Brian et Marie Jaisson, Raison d'agir, – (ISBN 978-2912107367)
- Jean-Luc Nothias, « Chez les bébés aussi, le sexe fort est féminin », sur sante.lefigaro.fr, (consulté le ).
- Eric L. Charnov, The Theory of Sex Allocation. 1982. Princeton University Press, 1982, 355 p.
- A. E. Quinn, A. Georges, S. D. Sarre, F. Guarino, T. Ezaz, J. A. Graves, Sex Reversal Implies Sex Gene Dosage in a Reptile. Science. Vol. 316, 2007, p. 411.
- E. L. Charnov; L-D Hartogh, R. L.; Jones, W. T.; Van den Assem, J. Sex ratio evolution in a variable environment, Nature, Vol 289, 1981, p. 27-33.
- E. Macke, S. Magalhães, F. Bach, I. Olivieri, Experimental Evolution of Reduced Sex Ratio Adjustment Under Local Mate Competition, Science, Vol. 334, 2011, pp. 1127-1129.
- J. Komdeur, S. Daan, J. Tinbergen, C. Mateman, Extreme adaptive modification in sex ratio of the Seychelles warbler eggs, Nature, Vol. 385, 1997, p. 522-525
- N. Burley, Sex Ratio Manipulation and Selection for Attractiveness, Science, Vol 211, 1981, p. 721-722.
- Loeske E. B. Kruuk, Tim H. Clutton-Brock, Steve D. Albon, Josephine Pemberton & Fiona E. Guinness Population density affects sex ratio variation in red deer, Nature. Vol 399, 1999.
- Colin D. Meiklejohn, Y. Tao, Genetic conflict and sex chromosome evolution, Trends ecology evolution, April 2010, p. 215-223
- S. Verne, M. Johnson, D. Bouchon, F. Grandjean, Effect of parasitic sex ratio distorters on host genetic structure in the Armadillidium vulgare-Wolbachia association, Journal of evolutionary biology, October 2011, Vol. 25, p. 264-276
- Smith E.A, Smith S.A, Anderson J, Mulder M.B, Burch Jr E.S, Damas D, ... & Wenzel G.W (1994) Inuit Sex-ratio variation: population control, ethnographic error, or parental manipulation ? [and comments and reply ]. Current Anthropology, 35(5), 595-624.
- E. Macke, S. Magalhães, F. Bach, I. Olivieri, Experimental Evolution of Reduced Sex Ratio Adjustment Under Local Mate Competition, Science, Vol. 334, 2011, p. 1127-1129.
- WD Hamilton Extraordinary sex ratios, Science, Vol. 156, 1967, p. 477-488.
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- François Héran, « Les raisons du sex-ratio. À propos de Le Sexisme de la première heure : hasard et sociologie d'Éric Brian et Marie Jaisson », La Revue internationale des livres et des idées, no 4, mars- (article en accès libre).
- (en) Metrecia L. Terrell, Kathleen P. Hartnett et Michele Marcus, « Can environmental or occupational hazards alter the sex ratio at birth? A systematic review », Emerging Health Threats Journal, vol. 4, no 1, , p. 7109 (ISSN 1752-8550, PMID 24149027, PMCID PMC3168220, DOI 10.3402/ehtj.v4i0.7109, lire en ligne, consulté le )
Articles connexes
[modifier | modifier le code]- Perturbateur endocrinien
- Démographie de la Chine
- Démographie de l'Inde
- Droit à naître
- Gynécide
- Sex-ratio opérationnel
Liens externes
[modifier | modifier le code]
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :


 French
French Deutsch
Deutsch
