クロロフィルa
| クロロフィルa | |
|---|---|
 | |
Chlorophyll a | |
Magnesium [methyl (3S,4S,21R)-14-ethyl-4,8,13,18-tetramethyl-20-oxo-3-(3-oxo-3-{[(2E,7R,11R)-3,7,11,15-tetramethyl-2-hexadecen-1-yl]oxy}propyl)-9-vinyl-21-phorbinecarboxylatato(2−)-κ2N,N′] | |
別称 α-Chlorophyll | |
| 識別情報 | |
| CAS登録番号 | 479-61-8 |
| PubChem | 6433192 |
| ChemSpider | 16736115 |
| UNII | YF5Q9EJC8Y |
| EC番号 | 207-536-6 |
| RTECS番号 | FW6420000 |
| |
| |
| 特性 | |
| 化学式 | C55H72MgN4O5 |
| モル質量 | 893.49 g mol−1 |
| 外観 | 緑色 |
| 匂い | 無臭 |
| 密度 | 1.079 g/cm3[1] |
| 融点 | |
| 水への溶解度 | 不溶 |
| 溶解度 | エタノール、ジエチルエーテルによく溶ける ベンジン[2]、アセトン、ベンゼン、クロホルム[1]に可溶 |
| 吸光度 | 本文を参照 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
クロロフィルaは、酸素光合成で使用されるクロロフィルの1種類である。スペクトルで紫から青とオレンジから赤の波長からほとんどのエネルギーを吸収し、緑や緑に近い部分はあまり吸収しない[3]。クロロフィルは光を反射しないが細胞壁などの構造により拡散反射された緑色の光が反射光に多く含まれるため、クロロフィルを含む組織は緑色に見える[4]。この光合成色素は、電子伝達系における主要な電子供与体としての役割があるため、真核生物、藍藻、および原核緑藻の光合成に不可欠である[5]。クロロフィルaはまた、アンテナ複合体において共鳴エネルギーを伝達し、特定のクロロフィルP680およびP700が配置されている反応中心で終了する[6]。
クロロフィルaの分布
[編集]クロロフィルaはほとんどの光合成生物が化学エネルギーを放出するために不可欠であるが、光合成に使用される唯一の色素ではない。すべての酸素光合成生物はクロロフィルaを使用するが、クロロフィルbのような補助色素が異なっている[5]。クロロフィルaは嫌気性光独立栄養生物である緑色硫黄細菌にもごく少量含まれている[7]。これらの生物はバクテリオクロロフィルと一部のクロロフィルaを使用するが、酸素を生成しない[7]。酸素非発生光合成は、この過程に適用される用語であり、光合成の光反応中に酸素が生成される酸素光合成と異なる。
分子構造
[編集]クロロフィルaは、4つの窒素原子が中央のマグネシウム原子を取り囲むクロリン環から構成され、他のいくつかの側鎖と炭化水素の尾を有する。
 | 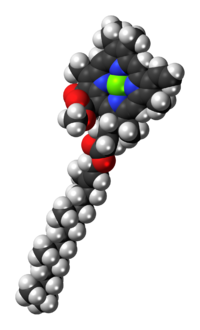 |
| 長い炭化水素の尾を示すクロロフィルa分子の構造 | |
クロリン環
[編集]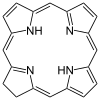
クロロフィルaは、クロリンと呼ばれる大きな環構造に囲まれたマグネシウムイオンが含まれる。クロリンはピロールに由来する複素環式化合物である。クロリンの4つの窒素原子がマグネシウム原子を囲み、結合する。マグネシウム中心はその構造をクロロフィル分子として独自に定義する[8]。バクテリオクロロフィルのポルフィリン環は飽和しており、光の吸収に変化を起こす交互に配列した二重結合と単結合はない[9]。
側鎖
[編集]
側鎖はさまざまなクロロフィル分子のクロリン環に結合する。側鎖が異なることでクロロフィル分子の特徴が異なり、光の吸収スペクトルを変化する[10][11]。例えば、クロロフィルaとクロロフィルbの唯一の違いはクロロフィルbがC-7位にメチル基ではなくアルデヒドを有する点である[11]。
炭化水素の尾
[編集]クロロフィルaは長い疎水性の尾を持ち、葉緑体のチラコイド膜にある他の疎水性タンパク質に分子を固定する[5]。長い炭化水素の尾は、ポルフィリン環から分離すると、地球化学の研究と石油源の決定に重要なプリスタンやフィタンというバイオマーカーの前駆体となる。
生合成
[編集]クロロフィルaの生合成経路はさまざまな酵素を利用する[12]。ほとんどの植物では、クロロフィルはグルタミン酸に由来し、ヘムとシロヘムと共有される分岐経路に沿って合成される[13][14][15]。最初の段階では、グルタミン酸をアミノレブリン酸 (ALA) に組み込む。次に、ALAの2つの分子がポルフォビリノーゲン (PBG) に還元され、PBGの4つの分子が結合してプロトポルフィリンIXを形成する[8]。
クロロフィル合成酵素[16]は反応EC 2.5.1.62を触媒することにより、クロロフィルa[17][18]の生合成を完了する酵素である。
- クロロフィリドa + フィチル二リン酸 クロロフィルa + 二リン酸
これにより、20個の炭素ジテルペンアルコールフィトールがついたクロロフィリドaのカルボキシ基のエステルが形成される。
光合成の反応
[編集]光吸収
[編集]光スペクトル
[編集]
クロロフィルaは紫、青、赤の光を吸収し、緑の光を主に反射する。この反射により、クロロフィルは緑色に見える。補助的な光合成色素は吸収される光のスペクトルを広げ、光合成に使用できる波長の範囲を広げる[5]。クロロフィルaにクロロフィルbを並べると、吸収スペクトルが広がる。暗い場所では、植物はクロロフィルa分子に対するクロロフィルb分子の比率を大きくし、光合成の収量を増やす[10]。
集光
[編集]
光合成色素による光の吸収により、光子が化学エネルギーに変換される。葉緑体に放射される光エネルギーは、チラコイド膜の色素に当たり、それらの電子を励起する。クロロフィルa分子は特定の波長のみ捕捉するため、生物は黄色の円で示された補助色素を使用して、より広い範囲の光エネルギーを捕捉することがある[6]。次に、捕捉された光を共鳴エネルギーとしてある色素から次の色素に伝達し、反応中心の特殊なクロロフィルa分子に到達するまでエネルギーを色素から色素へ渡す[10]。これらの特別なクロロフィルa分子は光化学系IIと光化学系Iの両方に存在する。これらは光化学系IIではP680、光化学系IではP700と呼ばれる[19]。P680とP700は電子伝達系への主要な電子供与体である。これらの2つの系は一電子酸化の酸化還元電位が異なる。P700のEmは約500 mVであり、P680のEmは約1,100-1,200 mVである[19]。
主な電子供与
[編集]クロロフィルaは光合成のエネルギー段階で非常に重要である。光合成の過程を進めるには2つの電子を電子受容体に渡す必要がある[5]。両方の光合成系の反応中心内には酸化還元反応を介して電子を伝達系に渡すクロロフィル分子の対がある[19]。
出典
[編集]- ^ a b c Anatolievich, Kiper Ruslan. “Chlorophyll a”. chemister.ru. 2014年11月29日時点のオリジナルよりアーカイブ。2014年8月23日閲覧。
- ^ a b Lide, David R., ed (2009). CRC Handbook of Chemistry and Physics (90th ed.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0
- ^ “Photosynthesis”. 2009年11月28日時点のオリジナルよりアーカイブ。 Template:Cite webの呼び出しエラー:引数 accessdate は必須です。
- ^ “Chlorophyll does not reflect green light - how to correct a misconception”. Journal of Biological Education in press: 1–8. (December 2020). doi:10.1080/00219266.2020.1858930.
- ^ a b c d e Raven, Peter H.; Evert, Ray F.; Eichhorn, Susan E. (2005). “Photosynthesis, Light, and Life”. Biology of Plants (7th ed.). W. H. Freeman. pp. 119–127. ISBN 0-7167-9811-5
- ^ a b Papageorgiou, G.; Govindjee (2004). Chlorophyll a Fluorescence, A Signature of Photosynthesis. Advances in Photosynthesis and Respiration. 19. Springer. p. 14, 48, 86
- ^ a b “The complete genome sequence of Chlorobium tepidum TLS, a photosynthetic, anaerobic, green-sulfur bacterium”. Proceedings of the National Academy of Sciences of the United States of America 99 (14): 9509–14. (July 2002). Bibcode: 2002PNAS...99.9509E. doi:10.1073/pnas.132181499. PMC 123171. PMID 12093901.
- ^ a b Zeiger, Eduardo; Taiz, Lincoln (2006). “Ch. 7: Topic 7.11: Chlorophyll Biosynthesis”. Plant physiology (4th ed.). Sunderland, MA: Sinauer Associates. ISBN 0-87893-856-7
- ^ Campbell, Mary K.; Farrell, Shawn O. (20 November 2007). Biochemistry (6th ed.). Cengage Learning. pp. 647. ISBN 978-0-495-39041-1
- ^ a b c Physiological Plant Ecology I – Responses to the Physical Environment. 12A. Springer-Verlag. (1981). pp. 67, 259
- ^ a b “Singlet and triplet excited state properties of natural chlorophylls and bacteriochlorophylls”. Photosynthesis Research 106 (3): 227–38. (December 2010). doi:10.1007/s11120-010-9598-9. PMID 21086044.
- ^ “Genetic analysis of chlorophyll biosynthesis”. Annual Review of Genetics 31 (1): 61–89. (1997). doi:10.1146/annurev.genet.31.1.61. PMID 9442890.
- ^ Battersby, A. R. (2000). “Tetrapyrroles: the Pigments of Life. A Millennium review”. Nat. Prod. Rep. 17 (6): 507–526. doi:10.1039/B002635M. PMID 11152419.
- ^ Akhtar, M. (2007). “The Modification of Acetate and Propionate Side Chains During the Biosynthesis of Haem and Chlorophylls: Mechanistic and Stereochemical Studies”. Ciba Foundation Symposium 180 - the Biosynthesis of the Tetrapyrrole Pigments. Novartis Foundation Symposia. 180. pp. 131–155. doi:10.1002/9780470514535.ch8. ISBN 9780470514535. PMID 7842850
- ^ Willows, Robert D. (2003). “Biosynthesis of chlorophylls from protoporphyrin IX”. Natural Product Reports 20 (6): 327–341. doi:10.1039/B110549N. PMID 12828371.
- ^ Schmid, H. C.; Rassadina, V.; Oster, U.; Schoch, S.; Rüdiger, W. (2002). “Pre-Loading of Chlorophyll Synthase with Tetraprenyl Diphosphate is an Obligatory Step in Chlorophyll Biosynthesis”. Biological Chemistry 383 (11): 1769–78. doi:10.1515/BC.2002.198. PMID 12530542.
- ^ Eckhardt, Ulrich; Grimm, Bernhard; Hortensteiner, Stefan (2004). “Recent advances in chlorophyll biosynthesis and breakdown in higher plants”. Plant Molecular Biology 56 (1): 1–14. doi:10.1007/s11103-004-2331-3. PMID 15604725.
- ^ Bollivar, David W. (2007). “Recent advances in chlorophyll biosynthesis”. Photosynthesis Research 90 (2): 173–194. doi:10.1007/s11120-006-9076-6. PMID 17370354.
- ^ a b c “How photosynthetic reaction centers control oxidation power in chlorophyll pairs P680, P700, and P870”. Proceedings of the National Academy of Sciences of the United States of America 103 (26): 9855–60. (June 2006). Bibcode: 2006PNAS..103.9855I. doi:10.1073/pnas.0601446103. PMC 1502543. PMID 16788069.
関連項目
[編集]外部リンク
[編集]- Zeiger & Taiz 2006, Topic 7.11: Chlorophyll Biosynthesis


 French
French Deutsch
Deutsch