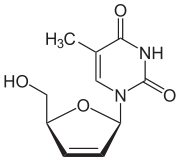
サニルブジン
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Zerit |
| Drugs.com | monograph |
| MedlinePlus | a694033 |
| ライセンス | EMA:リンク、US Daily Med:リンク |
| 胎児危険度分類 | |
| 法的規制 | |
| 薬物動態データ | |
| 生物学的利用能 | >80% |
| 血漿タンパク結合 | Negligible |
| 代謝 | Kidney elimination (~40%) |
| 半減期 | 0.8–1.5 hours (in adults) |
| データベースID | |
| CAS番号 | 3056-17-5 |
| ATCコード | J05AF04 (WHO) |
| PubChem | CID: 18283 |
| DrugBank | DB00649 |
| ChemSpider | 17270 |
| UNII | BO9LE4QFZF |
| KEGG | D00445 |
| ChEMBL | CHEMBL991 |
| NIAID ChemDB | 000005 |
| 別名 | 2′,3′-didehydro-2′,3′-dideoxythymidine |
| 化学的データ | |
| 化学式 | |
| 分子量 | 224.22 g·mol−1 |
| |
サニルブジン(Sanilvudine, JAN)またはスタブジン(Stavudine, USAN/INN)は、HIV/AIDSの予防と治療に使用される抗レトロウイルス薬の一つである[3]。ヌクレオシド系アナログ逆転写酵素阻害剤(NRTI)に分類される薬剤であり、略称でd4Tと呼ばれる[3]。一般的には、他の抗レトロウイルス薬との併用が推奨されているが、第一選択の治療法ではない[3]。本剤は、針刺し事故やその他の曝露の可能性がある場合の予防に使用出来る[3]。本剤は経口投与である[3]。
一般的な副作用は、頭痛、下痢、嘔吐、発疹、末梢神経障害などである[3]。重篤な副作用としては、血中乳酸値の上昇、膵炎、肝臓肥大などがある[3]。妊娠中は一般的に推奨されない[3]。スタブジンは、1966年に発表され、1994年に米国での使用が承認された[4]。日本では1997年7月に承認されたが[5]、2018年6月を以って販売中止となる旨が公表された[6]。
脚注
[編集]- ^ “Zerit EPAR”. European Medicines Agency (EMA). 2020年10月13日閲覧。
- ^ “Stavudine capsule”. DailyMed (2019年9月21日). 2020年10月13日閲覧。
- ^ a b c d e f g h “Stavudine Monograph for Professionals - Drugs.com”. www.drugs.com. 2016年11月10日時点のオリジナルよりアーカイブ。2016年11月9日閲覧。
- ^ Fischer, Janos; Ganellin, C. Robin (2006) (英語). Analogue-based Drug Discovery. John Wiley & Sons. p. 505. ISBN 9783527607495. オリジナルの2017-09-08時点におけるアーカイブ。
- ^ “ゼリットカプセル15/ゼリットカプセル20 インタビューフォーム”. 2021年6月8日閲覧。
- ^ “ヴアイデックスECカプセル125,200/ゼリットカプセル15,20 販売中止のご案内”. 2021年6月8日閲覧。


 French
French Deutsch
Deutsch