ナトリウムアミド
| ナトリウムアミド | |
|---|---|
 | |
別称 ソーダミド | |
| 識別情報 | |
| CAS登録番号 | 7782-92-5 |
| PubChem | 24533 |
| 特性 | |
| 化学式 | NaNH2 |
| モル質量 | 39.0124 g/mol |
| 外観 | 灰色粉末、純粋なものは無色 |
| 密度 | 1.39 g/cm3 |
| 融点 | 210 ℃ |
| 沸点 | 400 ℃ |
| 水への溶解度 | 水と反応 |
| 酸解離定数 pKa | 38 [1] |
| 構造 | |
| 結晶構造 | 斜方晶系 |
| 熱化学 | |
| 標準生成熱 ΔfH | −123.8 kJ mol−1[2] |
| 標準モルエントロピー S | 76.90 J mol−1K−1 |
| 標準定圧モル比熱, Cp | 66.15 J mol−1K−1 |
| 危険性 | |
| EU Index | Not listed |
| NFPA 704 | |
| 引火点 | 4.44 ℃ |
| 発火点 | 450 ℃ |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ナトリウムアミド (sodium amide、別名 ソーダミド) は、化学式が NaNH2 と表される無機化合物。有機合成において強塩基として用いられる。
合成
[編集]ナトリウムアミドは金属ナトリウムと気体アンモニアから得られる[3]。しかし、通常は硝酸鉄(III)を触媒として液体アンモニアから合成する。このとき、液体アンモニアの沸点 (約 -33 ℃) で反応が最も速く進行する[4]
性質
[編集]外見は固体で、水とは激しく加水分解反応し、空気により酸化され亜硝酸ナトリウムを生ずる。
純度の高いものは無色結晶または白色粉末だが、市販品は不純物を含むため灰色を帯びている。これは製造段階で微量の鉄を含むためであり、実際の用途には影響しない。
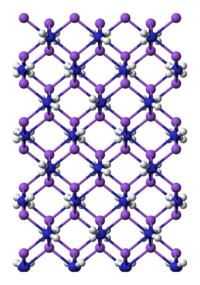
構造
[編集]ナトリウムアミドの結晶構造では N-Na 結合がポリマー状に連続している[5]。ナトリウム上には4個の窒素が四面体型に配位している[6]。ナトリウムアミドを液体アンモニアの溶液とすると と というイオンが発生して導電性を示す。
用途
[編集]インディゴやヒドラジン、シアン化ナトリウムを工業的に生産する際にナトリウムアミドが用いられる[7]。アンモニアから微量の水を除く乾燥剤として用いられる。また、有機化学では、主に液体アンモニアを溶媒とする合成において塩基として用いられる。長所としては塩基性が強いこととそれに比べ求核性が低いことが挙げられる。しかし通常の有機溶媒への溶解性は乏しいため、リチウムジイソプロピルアミド (LDA) や ナトリウムビス(トリメチルシリル)アミド (NaHMDS) が代用される。
脚注
[編集]- ^ Buncel; Menon J. Organomet. Chem. 1977, 141, 1.
- ^ D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982).
- ^ Bergstrom, F. W. "Sodium Amide" Org. Synth. Coll. Vol. 3, 1955, pp. 778. オンライン版
- ^ Greenlee, K. W.; Henne, A. L. (1946). "Sodium Amide". Inorganic Syntheses 2:128-135.
- ^ Zalkin, A.; Templeton, D. H. "The Crystal Structure Of Sodium Amide" J. Phys. Chem. 1956, 60, 821-823. DOI: 10.1021/j150540a042
- ^ Wells, A. F. "Structural Inorganic Chemistry", Oxford: Clarendon Press, 1984. ISBN 0-19-855370-6
- ^ Merck Index 12th edition.


 French
French Deutsch
Deutsch



