ファモチジン
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | ガスター |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 | |
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 20–66% |
| 血漿タンパク結合 | 10–28% |
| 代謝 | 肝臓(30%以下) |
| 半減期 | 2.5–4 時間 (臨床半減期 8–12 時間) |
| 排泄 | 尿 |
| 識別 | |
| CAS番号 | 76824-35-6 |
| ATCコード | A02BA03 (WHO) |
| PubChem | CID: 3325 |
| DrugBank | APRD00296 |
| ChemSpider | 3208 |
| UNII | 5QZO15J2Z8 |
| KEGG | D00318 |
| 化学的データ | |
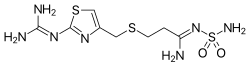
| 化学式 | C8H15N7O2S3 |
| 分子量 | 337.449 g/mol |
| |
ファモチジン(英: famotidine)は、ヒスタミンH2受容体拮抗薬(H2ブロッカー)の1つであり、胃酸生成を抑制する医薬品である[1]。消化性潰瘍、胃食道逆流症、ゾリンジャー・エリソン症候群の治療に用いられる[1]。商品名はガスター。服用1時間で効果を示す[1]。
壁細胞のヒスタミンH2受容体を遮断することにより胃酸分泌を抑制するため、胃酸抑制薬として使用される。ファモチジンはラニチジンより9倍強力であり、シメチジンより32倍強力であることが示されている[2]。
1979年に山之内製薬(現・アステラス製薬)が開発し特許を取得した[3]。現在はジェネリック医薬品が存在する[4]。2019年において米国で104番目によく処方された薬であり、600万を超える処方があった[5][6]
効果・効能
[編集]- 胃潰瘍・十二指腸潰瘍
- 逆流性食道炎(胃食道逆流症)
- ゾリンジャー・エリスン(Zollinger-Ellison)症候群
- 胸焼け(英: heartburn & acid indigestion)
- NSAID潰瘍の予防[7][8]
他のH2ブロッカーであるシメチジン同様に異所性石灰化に有効だという報告がなされており、シメチジンより副作用も少ないため、整形外科分野での治療効果が期待されている。
副作用
[編集]ヒスタミンH2受容体は人間の場合、胃壁の他、心筋などにも存在する。ヒスタミンH2受容体拮抗薬は心筋の受容体にも影響を与えるため、不整脈等の心臓の異常を起こすことがある。特に心臓病の患者が摂取することは禁忌とされる。ファモチジンを含む市販薬では死亡例も確認されている。
その他、低血圧、下痢、めまい、頭痛、発赤、発汗、悪心・嘔吐、眠気、焦燥感、幻覚がみられることがある[9]。シメチジンは抗アンドロゲン作用(性機能障害、勃起不全、女性化乳房)がみられることがあるが、中止すると回復する。
重大な副作用として、せん妄が報告されている。高齢者では通常使用される40mg/日の投与量で、せん妄が発現する可能性がある[10]。
薬物動態
[編集]ファモチジンは主に腎臓から排泄される。糸球体ろ過だけではなく、尿細管分泌によって尿中に排泄されると考えられている[11]。 腎機能低下患者にファモチジンを投与すると血中半減期が増大し、体内に蓄積される。腎臓の機能の指標であるクレアチニンクリアランスの低い患者には、投与量を減らして用いられる [12]。
ファモチジンの経口バイオアベイラビリティは40-50%であり、これは吸収の不完全なことが原因である[11]。
処方箋医薬品
[編集]1983年より錠剤型が「ガスター(Gaster)」の名称で処方箋医薬品として日本で発売開始された。同時期より流通していた海外製品のシメチジンやラニチジンと効能は同等であるが、山之内製薬の製品であるため広く流通していた。散剤の「ガスター散」およびOD錠型の「ガスターD」と、重症者向けの「ガスター注」がある。1993年には内用薬が、1999年には注射剤が、日本薬局方に指定されている。
一時期山之内の主力製品となったが、米国では2000年に、日本では2001年に基本的な製造特許が満了し、2002年より後発医薬品が流通している。
2018年10月1日付で、全剤形をLTLファーマ株式会社に製造販売承認の承継、および販売移管(譲渡)した。
ファモチジン訴訟
[編集]山之内製薬のガスターは、ファモチジン結晶多形から製造していたが、1990年代にハンガリーのリヒターゲテオンが、ファモチジン結晶多形にA型とB型が存在している事を突き止め、結晶多形B型での製造特許を取得した(ガスターおよび日本薬局方の成分では、結晶多形A型とB型を混合していることになった)。そのためリヒターゲテオンは、山之内製薬が結晶多形B型に係る部分の特許侵害をしているとしたが、山之内は2000年に日本における発売製品について、2007年まで同社と独占的な製造特許のライセンスを締結した。
しかし、ファモチジンの特許切れに伴い、後発医薬品メーカー各社が同製剤を製造するにあたり、リヒターゲテオンは山之内製薬と同じく『特許侵害』として、2001年に該当する後発医薬品メーカー14社に対して、不法行為に基づく損害賠償及び不当利得の返還を請求する訴訟を提起した。この時点でリヒターゲテオンの日本におけるパートナーは山之内のみであった事から、山之内 対 ジェネリック医薬品メーカーの代理戦争を呈していた。
2003年に東京地裁および大阪地裁での判決は「純粋に結晶多形B型のみを使用して製造したものではない」と、特許侵害が認められないとして原告敗訴となり、控訴審でも棄却される結果となった。
一般用医薬品 (スイッチOTC)
[編集]1997年に山之内製薬は、ガスター(錠剤)をスイッチOTCした「ガスター10」(ガスター・テン)を発売開始。内用薬初のスイッチOTCであった。ガスター10は、元々「ガスター20」の名称で医療用医薬品として使用されていた物を、一般用医薬品(大衆薬)として販売するために、ファモチジンの含有量を10mgに抑えて開発した物である。現在でも医療用医薬品としてガスター20は広く使われている。
当時は胃酸を抑える効果のあるアルミニウム・マグネシウムや胃粘膜を保護する成分(ロートエキス・スクラルファート等)・消化酵素(リパーゼ等)など古典的な成分を配合した胃腸薬のみ市販化されていたため、1回あたりの単価が高価であるにもかかわらず、胃痛・胸やけに即効性のあるガスター10は瞬く間にヒット商品となり、後に散・OD錠・内用液(医療用には無い)型も発売されるようになった。他の大衆薬メーカーも1998年からH2ブロッカー製品の市販に追従したが、撤退して流通していない。
ただし、体質や既往歴によっては重篤な副作用が起こる可能性があることや、あくまで対症療法のため常用を続けると重篤な胃疾患(胃潰瘍・胃癌など)の症状を紛らわせて発見が遅れる場合もあるため、発売当初より「薬剤師に相談すること」を広告で周知している。2009年の改正薬事法施行により第一類医薬品に移行してるため、引き続き薬剤師のいる薬局・ドラッグストアでないと販売できない。なおガスター10には、ファモチジン以外の有効成分は含んでいないため、食べ過ぎに対する消化促進の効果はない。
ガスター10は2004年にゼファーマへ移管され、後に第一三共ヘルスケアへ吸収されたことから、同社(第一三共)の製品として発売されている。
山之内時代・ゼファーマ時代・第一三共時代まで一貫して、パッケージの「ガスター10」ロゴの「10」には必ず「テン」の振り仮名が振ってある。
脚注
[編集]- ^ a b c “Famotidine Monograph for Professionals” (英語). Drugs.com. American Society of Health-System Pharmacists. 3 March 2019閲覧。
- ^ “Famotidine, a new, potent, long-acting histamine H2-receptor antagonist: comparison with cimetidine and ranitidine in the treatment of Zollinger-Ellison syndrome”. Gastroenterology 88 (4): 1026–33. (April 1985). doi:10.1016/s0016-5085(85)80024-x. PMID 2857672.
- ^ (英語) Analogue-based Drug Discovery. John Wiley & Sons. (2006). p. 444. ISBN 9783527607495
- ^ British national formulary : BNF 76 (76 ed.). Pharmaceutical Press. (2018). pp. 74–75. ISBN 9780857113382
- ^ “The Top 300 of 2019”. ClinCalc. 16 October 2021閲覧。
- ^ “Famotidine - Drug Usage Statistics”. ClinCalc. 16 October 2021閲覧。
- ^ “Prophylaxis and treatment of NSAID-induced gastroduodenal disorders”. Drug Safety 20 (6): 527–43. (June 1999). doi:10.2165/00002018-199920060-00006. PMID 10392669.
- ^ “Double-blind randomized trials of single-tablet ibuprofen/high-dose famotidine vs. ibuprofen alone for reduction of gastric and duodenal ulcers”. The American Journal of Gastroenterology 107 (3): 379–86. (March 2012). doi:10.1038/ajg.2011.443. PMC 3321505. PMID 22186979.
- ^ "MedkinePlus 25-H2 receptor antagonists overdose"
- ^ “Famotidine-Associated Delirium: A Series of Six Cases”. Clin Pharmacokinet. 21 (3): 178-94.. (July–August 1996). doi:10.1016/S0033-3182(96)71548-7.. PMID 8701013.
- ^ a b “Clinical pharmacokinetics of famotidine”. Psychosomatics 37 (4): 349-355.. (September 1991). doi:10.2165/00003088-199121030-00003.. PMID 1764869.
- ^ ガスター錠10mg/ガスター錠20mg_添付文書
参考文献
[編集]- 伊藤勝昭ほか編集 『新獣医薬理学 第二版』 近代出版 2004年 ISBN 4874021018


 French
French Deutsch
Deutsch