ブルーリ潰瘍

ブルーリ潰瘍(ブルーリかいよう、Buruli ulcer)はグラム陽性桿菌の Mycobacterium ulcerans ないしその近縁の M. ulcerans subsp. shinsuenseが病原体となり発症する潰瘍などの皮膚病変を主症状とする感染症である[1][2][3]。患者数は、結核、ハンセン病に次ぐ第三の抗酸菌感染症として知られ、西アフリカや中央アフリカなどの熱帯・亜熱帯地域を主として、世界約33カ国から患者報告がある。
疫学
[編集]1948年にオーストラリアのMacCallumらがM. ulceransを起因菌とする無痛性の慢性皮膚潰瘍を報告し、ブルーリ潰瘍が非結核性抗酸菌症(nontuberuculous mycobacterium; NTM)であると位置づけた。ブルーリの名称は、ウガンダのブルーリ地域でこの疾患が多く発症した事に由来する。
世界
[編集]WHO による顧みられない熱帯病のひとつ[4]。
西アフリカ(特にガーナ、ベナン、コートジボワール)及び中央アフリカを中心として約33カ国からの患者報告がある。熱帯・亜熱帯地域に多いが、日本と同様の温帯地域であるオーストラリアでも年間30 - 50例の報告がある。WHOは、年間5000例以上の新規症例があると報告しているが、本疾患の認知度・診断率が低く、報告義務もないため、実際にはそれ以上の患者が存在すると考えられる。なお、アフリカでは5-15歳の子供に発症する場合が多い。
日本
[編集]1980年に日本で初めて御子柴らが19歳女性の左肘関節伸側の慢性皮膚潰瘍を報告[5]して以降、計73例(2019年末現在)の報告がある。特に、2007年以降増加傾向にある。いずれも海外渡航歴はなく、日本国内での感染が示唆された[3]。病原体として M. shinshuense が検出されている[6]。

男女比は男性29例、女性44例(2019年末現在)と女性の発症が多い。日本における発症年齢は、0-14歳:15例、15-59歳:29例、60-89歳:29例とアフリカに比して中高年に多い。
| 1980 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | |
| 男性 | 0 | 0 | 0 | 0 | 2 | 0 | 2 | 3 | 5 | 1 | 4 | 2 | 2 | 1 | 3 | 2 | 2 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 女性 | 1 | 1 | 1 | 1 | 1 | 2 | 3 | 6 | 5 | 3 | 6 | 5 | 2 | 1 | 4 | 1 | 1 |
原因
[編集]感染源
[編集]非結核性抗酸菌であるM. ulcerans 及びその亜種であるM. ulcerans subsp shinshuenseが起因菌である[7]。この菌は、マイコラクトン(mycolactone)という脂質毒素を産生し[8]、局所の壊死、アポトーシスを引き起こし、皮膚潰瘍を形成する。なお、日本の患者から検出された原因菌のすべてと中国での感染症例はM. ulcerans subsp shinshuenseであった。
感染経路
[編集]感染経路はいまだ不明であるが、水系やその周辺に生息する媒介生物を介して感染すると考えられている。沼地や河川での歩行、水泳、釣り、農作業などが感染の危険因子とされている。ヒト-ヒト感染の報告はない。日本各地でブルーリ潰瘍患者が散発していることから、日本においては原因菌は環境中の水系などに広く分布していると考えられる。
宿主
[編集]宿主については、水棲昆虫、貝類、魚類、陸生節足動物などからM. ulcerans 遺伝子が検出されているが、明らかな事はわかっていない[9]。日本においてザリガニから菌DNAが検出されたとの報告があるが[9]、ザリガニは雑食性であることからこれが感染源というわけでは無く、実際に水系のどこかに菌が存在することの証明である点に留意する必要がある。
分類
[編集]WHOは1998年に、世界ブルーリ潰瘍戦略(Global Buruli Ulcer Initiative:GBUI)を設立し、重症度別に治療方針を決定するために、潰瘍の大きさで3つに分類した。
| 症状 | |
|---|---|
| カテゴリーⅠ | 5cm未満の病変 |
| カテゴリーⅡ | 5cm以上15cm未満の病変 |
| カテゴリーⅢ | 15cm以上の病変、骨髄炎の合併、複数個の潰瘍、関節をまたいだ潰瘍 |
症状
[編集]好発部位は四肢や顔面などの裸露部、特に下肢である。感染経路は明らかになってはいないものの、水辺の環境での発症が多い事に関連すると考えられる。
最初は虫さされ様の紅斑、紅色丘疹で始まり、無痛性皮下結節に進行する。その数日から数週間後、中心部は自壊し、潰瘍化する。菌が産生する脂質毒素(マイコラクトン)により、局所の免疫反応の抑制、組織の壊死が起こり、潰瘍は拡大する。また、菌が神経のシュワン細胞に侵入するため、痛覚の低下を起こし、無痛性の事が多い。ただし、日本の症例では有痛性の症例もあり、これはM. ulcerans subsp shinshuenseとM. ulcerans間での何らかの違いがあると考えられるが、現時点でも不明である。
鑑別疾患
[編集]糖尿病性足潰瘍、うったい性皮膚炎による潰瘍、皮膚リーシュマニア症、ハエ幼虫症、炭疽、悪性腫瘍による潰瘍、その他の皮膚抗酸菌症(結核、ハンセン病、M.avium, M.marinumなどの感染症)による潰瘍など[10]。
検査
[編集]スメア検査
[編集]潰瘍辺縁から潰瘍底を綿棒で強く擦過したもの、生検組織をスタンプ標本としたものを検体とする。チール・ネールゼン染色で抗酸菌を検出する。
培養検査
[編集]生検皮膚組織を細切したもの、膿や潰瘍底を強く擦過した綿棒を用いる。小川培地、液体培地を用い、25℃、37℃で培養する(至適温度28-33℃)。小川培地については6ヶ月以上培養を継続する。
PCR検査
[編集]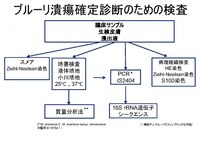
PCR検査でIS2404を検索してM. ulcerans かM. ulcerans subsp. shinshuense を検出する。 M. ulceransおよびM. ulcerans subsp. shinshuenseに特異的なIS2404をPCR検査で検出する[11]。
診断
[編集]潰瘍を伴う皮疹の菌検査でM. ulceransを同定できれば、診断確定となるが、培養に時間を要する場合が多い。そのため、日本では下記の3項目を満たした場合、診断としている。
- 潰瘍を伴う皮疹
- 病理組織検査で壊死像
- PCR検査で陽性(ブルーリ潰瘍に特異的なIS2404陽性)
治療
[編集]抗菌薬内服治療が主となる。WHOはRFP(10mg/kg/d)+SM(15mg/kg/d 筋注)の8週間あるいはRFP+SMの4週間と、RFP(10mg/kg/d)+CAM(15mg/kg/d)の4週間投与を推奨している。日本では薬剤感受性検査の結果[7]RFP+CAM+LVFXの三剤を併用する事が多い[12]。詳細な用量は下記参照*。なお、潰瘍が大きい場合、抗菌剤治療だけでは不十分な場合には、病巣から数cm程度離して切除し、皮膚移植も考慮する。
| 治療薬 | 用量 |
|---|---|
| リファンピシン(RFP) | 450mg/d(保険適用外) |
| クラリスロマイシン(CAM) | 800mg/d(非結核性抗酸菌症として保険適用) |
| レボフロキサシン(LVFX) | 500mg/d(深在性皮膚感染症として保険適用) |
出典
[編集]- ブルーリ潰瘍とは 国立感染症研究所
- 濱田利久、「ブルーリ潰瘍」『日本皮膚科学会雑誌』 Vol.124 (2014) No.1 p.23-26, doi:10.14924/dermatol.124.23
参考文献
[編集]- 石井則久 ほか、「深い潰瘍を形成する新たな非結核性抗酸菌感染症―Mycobacterium shinshuense感染症」『臨床皮膚科』 2010/4/10
- 福西征子、「西アフリカ・ガーナにおけるブルーリ潰瘍の流行」『公衆衛生』 2001/7/15
- 四津里英、「ガーナ紀行─ブルーリ潰瘍最多地域での経験─」『日本ハンセン病学会雑誌』 Vol.81 (2012) No.1_2 p.155-159, doi:10.5025/hansen.81.155
- 圓純一郎、石井則久、後藤正道、ブルーリ潰瘍(Mycobacterium ulcerans感染症)の神経傷害における((mycolactoneの役割」『日本ハンセン病学会雑誌』 Vol.80 (2011) No.1 P5-10, doi:10.5025/hansen.80.5
- Yotsu RR, Murase C, Sugawara M, Suzuki K, Nakanaga K, Ishii N, Asiedu K: Revisiting buruli ulcer. J Dermatol 42: 1033-1041, 2015.
- Murase C, Kono M, Nakanaga K, Ishii N, Akiyama M: Buruli ulcer successfully treated with negative- pressure wound therapy. JAMA Dermatol 151: 1137-1139, 2015.
脚注
[編集]- ^ Yotsu RR, et al.:Buruli ulcer and current situation in Japan: a new emerging cutaneous Mycobacterium infection. J Dermatol 39:587-593, 2012. doi:10.1111/j.1346-8138.2012.01543.x
- ^ 石井則久、四津里英、浅野裕子ほか:『ブルーリ潰瘍』 日本臨床皮膚科医会雑誌 29: 376-383, 2012. NAID 40019306691
- ^ a b Nakanaga K, et al.:Buruli ulcer and mycolactone-producing mycobacteria Japanese Journal of Infectious Diseases Vol.66 (2013) No.2 p.83-88, doi:10.7883/yoken.66.83
- ^ 鹿角契, 「顧みられない熱帯病」『ファルマシア』 54巻 12号 2018年 p.1150_4, doi:10.14894/faruawpsj.54.12_1150_4。
- ^ 御子柴甫, 進藤泰子, 松本頴樹, 望月正子, 束村道雄, 「Mycobacterium ulcerans類似菌による非定型抗酸菌症の1例」『日本皮膚科学会雑誌』 92巻 5号 1982年 p.557-, doi:10.14924/dermatol.92.557。
- ^ 「加畑大輔、谷崎英昭、荒川明子ほか、【原著】Mycobacterium ulcerans subsp. shinshuenseによるBuruli潰瘍の1例」 『日本皮膚科学会雑誌』 Vol.121 (2011) No.14 p.3337-3342, doi:10.14924/dermatol.121.3337
- ^ a b Nakanaga K, et al.:Nineteen cases of Buruli ulcer diagnosed in Japan from 1980 to 2010 J Clin Microbiol 49: 3829-3836.2011. doi:10.1128/JCM.00783-11
- ^ 圓純一郎, ブルーリ潰瘍の神経傷害の原因としての、マイコラクトンによるシュワン細胞毒性」『日本ハンセン病学会雑誌』 87巻 3号 2018年 p.123-129, doi:10.5025/hansen.87.123。
- ^ a b Ohtsuka M, etal:Buruli ulcer caused by Mycobacterium ulcerans subsp.shinshuense:a rare case of familial concurrent occurrence and detection of insertion sequence 2404 in Japan. JAMA Dermatol 150:64-67, 2014. doi:10.1001/jamadermatol.2013.6816
- ^ 四津里英、他:『誤診されている皮膚疾患』(宮地良樹編集), p356-359, メディカルレビュー社(東京), 2013年. ISBN 9784779208829
- ^ Nakanaga K, et al.:Laboratory procedures for the detection and identification of cutaneous non-tuberculous mycobacterial infections. J Dematol 40:151-159,2013. doi:10.1111/1346-8138.12047
- ^ Sugawara M, et al: Exploration of a standard treatment for Buruli ulcer through a comprehensive analysis of all cases diagnosed in Japan. J Dermatol 42: 588-595, 2015. doi:10.1111/1346-8138.12851


 French
French Deutsch
Deutsch