細胞皮質
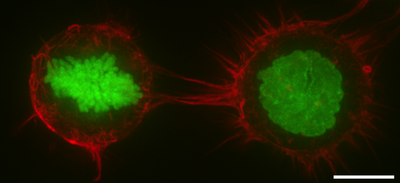
細胞皮質または細胞皮層 (英語: cell cortex) は、細胞膜の内面の細胞質のタンパク質にある特殊な層のことである。「アクチン皮質」や「アクトミオシン皮質」とも呼ばれる。
概要
[編集]細胞膜の可動性と細胞の表面に関する特性の変調器としての機能を持つ[1][2][3]。細胞壁を欠くほとんどの真核生物の細胞では、皮質はF-アクチンのフィラメント、ミオシンのモータータンパク質及びアクチン結合タンパク質で構成されるアクチンに富んだネットワークである[4][5]。アクトミオシン皮質は細胞膜に付着しているERMタンパク質と呼ばれるフィラメントと細胞膜を架橋しているタンパク質を介して、細胞の形状制御において中心的な役割を果たしている[1][6]。皮質のタンパク質の構成要素は急速にターンオーバーして、皮質を機械の様に硬く、高度な可塑性(しなやかさ)をもたらす。その二つの特性は、皮質の機能に必要不可欠なものである。大抵の場合、皮質の厚さは、100ナノメートルから1000ナノメートルまでの範囲内である。
一部の動物細胞では、タンパク質のスペクトリンが皮質に存在する場合がある。スペクトリンは、架橋アクチンフィラメントを通してネットワークを結合することに役立っている[3]。スペクトリンとアクチンの比率は、その細胞の型によって異なる[7]。スペクトリンのタンパク質とアクチンのマイクロフィラメントは、膜を透過する細胞膜に付着して膜の内外を行き来できる。スペクトリンのタンパク質とアクチンのマイクロフィラメントが形成した網状の構造体が重合と脱重合及び分岐による改変を繰り返す細胞内の形質膜の内側の細胞質基質に接する面に細胞皮質は付着している。
多くのタンパク質は、アクチン重合の役割を担うフォルミン、アクチンの分岐とキャッピングタンパク質を生じさせるArp2/3複合体を含む皮質の調節と変遷過程の管理に関与している。皮質の細胞骨格について、いかにフラクタル構造などの非常に複雑な網目構造が形成できるかは、アクチンの分岐プロセスとアクチン皮質の密度がどの程度かによって左右される[8]。特殊な機能を持つ細胞は通常、非常に特異的な皮質アクチン細胞骨格を特徴としている。例えば、赤血球では、五角形または六角形の対称性を持つ二次元架橋弾性ネットワークで構成された細胞皮質が、細胞膜につなぎ合わされ、主にスペクトリン、アクチン、アンキリンによって形成される[9]。神経繊維では、アクチン/スペクトル細胞骨格が周期的なリングの配列を形成し[10]、精子の鞭毛ではらせん構造を形成している[11]。
植物細胞については、皮層とは、茎や根の表皮と中心柱との間の部分を指すが[12]、内皮の細胞壁には高等植物の木化に関与するリグニンや組織への水分の透過を防ぐスベリンを蓄積するカスパリー線があって[13]、細胞皮層は形質膜の下にあるこれらの皮層微小管により補強されている。これらの皮層微小管の向きによって、細胞が成長する時に細胞がどのように伸長するかが決定される。
機能
[編集]- 有糸分裂において、F-アクチンとミオシンIIは、細胞球形化の為に高度な凝縮と均一な皮質を形成している。アクトミオシン皮質の活動によって生成された表面張力は、細胞内の静水圧を生じさせて、周囲の物質を変位させて細胞球形化を容易にする[14][15]。
- 細胞質分裂において、細胞皮質は、二つの娘細胞に分裂細胞を凝縮する為のミオシンの豊富な凝縮環を生じさせることに関し、中心的な役割を果たしている[16]。
- 細胞皮質のアクトミオシン複合体の収縮は、多くのガン細胞の転移に関して特徴的なアメーバ様遊走の鍵となっている[1][17][18]。
脚注
[編集]出典
[編集]- ^ a b c “Actin cortex mechanics and cellular morphogenesis”. Trends in Cell Biology 22 (10): 536–45. (October 2012). doi:10.1016/j.tcb.2012.07.001. PMID 22871642.
- ^ “Micromechanical architecture of the endothelial cell cortex”. Biophysical Journal 88 (1): 670–9. (January 2005). doi:10.1529/biophysj.104.049965. PMC 1305044. PMID 15489304.
- ^ a b Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). “Cross-linking Proteins with Distinct Properties Organize Different Assemblies of Actin Filaments”. Molecular Biology of the Cell (4th ed.). New York: Garland Science. ISBN 0-8153-3218-1
- ^ “The evolution of compositionally and functionally distinct actin filaments”. Journal of Cell Science 128 (11): 2009–19. (June 2015). doi:10.1242/jcs.165563. PMID 25788699.
- ^ “Stresses at the cell surface during animal cell morphogenesis”. Current Biology 24 (10): R484-94. (May 2014). doi:10.1016/j.cub.2014.03.059. PMID 24845681.
- ^ “Organizing the cell cortex: the role of ERM proteins”. Nature Reviews. Molecular Cell Biology 11 (4): 276–87. (April 2010). doi:10.1038/nrm2866. PMC 2871950. PMID 20308985.
- ^ “Spectrin-based skeleton as an actor in cell signaling”. Cellular and Molecular Life Sciences 69 (2): 191–201. (January 2012). doi:10.1007/s00018-011-0804-5. PMC 3249148. PMID 21877118.
- ^ “Plasma Membrane is Compartmentalized by a Self-Similar Cortical Actin Meshwork”. Physical Review X 7 (1). (2017). doi:10.1103/PhysRevX.7.011031. PMC 5500227. PMID 28690919.
- ^ “Active elastic network: cytoskeleton of the red blood cell”. Physical Review E 75 (1 Pt 1): 011921. (January 2007). doi:10.1103/PhysRevE.75.011921. PMID 17358198.
- ^ “Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons”. Science 339 (6118): 452–6. (January 2013). doi:10.1126/science.1232251. PMC 3815867. PMID 23239625.
- ^ “The actin cytoskeleton of the mouse sperm flagellum is organized in a helical structure”. Journal of Cell Science 131 (11): jcs215897. (June 2018). doi:10.1242/jcs.215897. PMC 6031324. PMID 29739876.
- ^ “皮層”. コトバンク. 朝日新聞. 2020年6月9日閲覧。
- ^ Takeshi Nakayama. “植物の組織”. BotanyWEB. 筑波大学. 2020年6月9日閲覧。
- ^ “Hydrostatic pressure and the actomyosin cortex drive mitotic cell rounding”. Nature 469 (7329): 226–30. (January 2011). doi:10.1038/nature09642. PMID 21196934.
- ^ “Cdk1-dependent mitotic enrichment of cortical myosin II promotes cell rounding against confinement”. Nature Cell Biology 17 (2): 148–59. (February 2015). doi:10.1038/ncb3098. PMID 25621953.
- ^ “Cytokinesis in animal cells”. Annual Review of Cell and Developmental Biology 28: 29–58. (November 2012). doi:10.1146/annurev-cellbio-101011-155718. PMID 22804577.
- ^ “The actin cytoskeleton in cancer cell motility”. Clinical & Experimental Metastasis 26 (4): 273–87. (April 2009). doi:10.1007/s10585-008-9174-2. PMID 18498004.
- ^ 斉藤康二、太田安隆「がん細胞の浸潤における運動様式の転換制御」『生化学』第89巻第1号、日本生化学会、2017年2月、90-93頁、ISSN 0037-1017、NAID 40021119795、2020年9月1日閲覧。


 French
French Deutsch
Deutsch