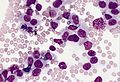
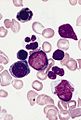
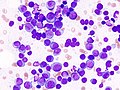
骨髄像

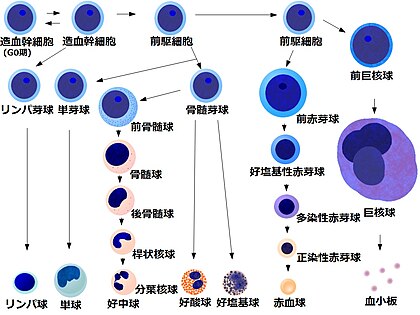
骨髄像(こつずいぞう、英語: Bone marrow smear examination、 myelogram[※ 1])とは、骨髄から得た細胞をスライドガラスに塗抹、染色して顕微鏡で観察する検査である。 末梢血塗抹検査では原則として成熟した血液細胞しか観察できないが、血液細胞は骨髄で産生されて成熟するため、骨髄液塗抹標本では幼若な血液細胞を観察することができる。骨髄像は血液疾患の診断、病期判定、治療効果判定などに不可欠な場合が多い。 また、血液疾患以外でも、悪性腫瘍の転移、感染症、先天性代謝異常、などに関する重要な情報を得られる場合がある。
検査法の概要
[編集]通常、骨髄穿刺を行い、0.2から0.3 mL[※ 2]の骨髄液を吸引してスライドガラスに塗抹し染色した標本を顕微鏡で観察する。 同時に、液中の有核細胞数や巨核球数を計測し、骨髄像検査の一環として併せて報告する(有核細胞数の項参照)。[※ 3]。
穿刺液が十分に得られない場合(ドライタップと呼ばれる)、穿刺針や骨髄生検標本などをスライドガラスに捺印して染色する場合もある[1]。
染色は、通常、形態観察用にメイ・グリュンワルド・ギムザ染色などのロマノフスキー染色が行われるが、必要に応じ、鉄染色など、後述の特殊染色が追加される。
標本の観察にあたっては、異常細胞の検出、造血能の評価、末梢血塗抹標本との対比、等を念頭において観察するとともに、 通常は、有核細胞[※ 4]の分画を算定する[※ 5]。
検査の適応
[編集]骨髄穿刺は患者への負担が大きいので、 診療の必要上、病歴・身体診察・末梢血等の一般的な検査では不十分な場合にのみ実施される[※ 6]。 以下、骨髄穿刺の適応となる病態の例をあげる。[2]:253-268
血液疾患の診断
[編集]白血球分画で分画の異常や異常細胞の出現、末梢血塗抹検査での血球形態異常、などから血液疾患が疑われた場合、 確定診断目的で骨髄像検査が行われることが多い
- 血液系の腫瘍性疾患の診断
急性白血病、各種の骨髄増殖性腫瘍(慢性骨髄性白血病、真性多血症、等)などについては、 通常、全血球計算や末梢血塗抹検査での異常から血液疾患を疑い、骨髄像検査が実施される。
多発性骨髄腫、原発性マクログロブリン血症などの免疫グロブリン系疾患については、アルブミン/グロブリン比(A/G比)や血清蛋白分画などから疑われて骨髄検査を施行することが多い。
悪性腫瘍の広範な骨髄転移(骨髄癌腫症[※ 7])は末梢血での赤芽球や幼若白血球の出現(白赤芽球症)がきっかけになって骨髄穿刺にいたり診断がつく場合が多い[3]。
- 各種の血球減少症・増多症の診断
全血球計算で原因不明の血球数の異常(貧血/多血症、白血球増多/減少、血小板増多/減少、特に、複数の系統の血球数の異常が見られた場合に、診断確定のため骨髄像検査が実施される。 例としては、再生不良性貧血、骨髄異形成症候群、などがあげられる。
悪性腫瘍の病期診断
[編集]悪性リンパ腫やホジキン病では骨髄浸潤の頻度が高い[※ 8]。骨髄に腫瘍細胞が認められたら進行期(Ⅳ期)と判断される。
血液疾患の治療効果の監視
[編集]化学療法後の残存病変の検索や、造血幹細胞移植後の生着の確認に使用される。[2]:253-268
その他の全身性疾患の検索
[編集]骨髄病変を伴う全身性疾患の診断に骨髄像が有用な場合がある。[2]:253-268
- 不明熱
- 不明熱(原因不明の持続性の発熱)の原因検索には骨髄像が重要である。
骨髄像で深在性真菌症、結核、リーシュマニア、などの感染症が診断されることがある(特にHIV感染患者)。また、悪性リンパ腫等、悪性腫瘍の浸潤が発見される場合がある[4]。
有核細胞の分類
[編集]骨髄塗抹標本では、通常、500個の有核細胞を目視で同定して分類する[7]。 骨髄像という言葉は、狭義には、この分類を意味する。
骨髄像の基準値
[編集]骨髄像の基準値は文献や施設により異なるが、一例を示す。
| 骨髄像 | 範囲 (%) | 基準範囲 (%) | メジアン (%) | 平均 (%) | ||
|---|---|---|---|---|---|---|
| 赤芽球系 (E) | 赤芽球 (小計) | 8.5–56.5 | 15.8–46.2 | 32.0 | 31.7 | |
| 前赤芽球 | 0–5.0 | 0–3.0 | 0.5 | 0.6 | ||
| 好塩基性赤芽球 | 0–21.0 | 0.5–13.5 | 3.5 | 4.5 | ||
| 多染性赤芽球 | 3.0–47.0 | 7.8–34.5 | 20.0 | 20.2 | ||
| 正染性赤芽球 | 0–21.0 | 0.5–16.5 | 5.5 | 6.3 | ||
| 骨髄系 (M) | 顆粒球系 (G) | 顆粒球 (小計) | 24.5–72.5 | 34.8–66.3 | 49.5 | 49.9 |
| 好中球 | ||||||
| 骨髄芽球 | 0–8.5 | 0–5.0 | 1.5 | 1.6 | ||
| 前骨髄球 | 0–8.5 | 0–5.5 | 1.0 | 1.3 | ||
| 骨髄球 | 1.0–31.7 | 5.8–24.0 | 13.5 | 13.7 | ||
| 後骨髄球 | 0.5–18.0 | 1.0–12.0 | 4.5 | 5.0 | ||
| 桿状核球 | 2.0–34.0 | 6.5–26.2 | 14.5 | 15.2 | ||
| 分葉核球 | 1.0–27.5 | 2.5–19.7 | 9.5 | 9.8 | ||
| 好酸球 | 0–18.0 | 0.5–7.0 | 2.5 | 3.0 | ||
| 好塩基球 (および マスト細胞)[※ 10] | 0–3.0 | 0–1.5 | 0 | 0.3 | ||
| G/E比(顆粒球系/赤芽球系比) | 0.5–5.9 | 0.8–4.1 | 1.6 | 1.7 | ||
| 単球系 | 単球 | 0–8.5 | 0–6.0 | 2.0 | 2.2 | |
| M/E比(骨髄系/赤芽球系比) | 0.6–6.2 | 0.8–4.1 | 1.6 | 1.8 | ||
| リンパ系 | リンパ球 | 1.0–38.5 | 5.5–23.2 | 13.2 | 13.6 | |
| 形質細胞 | 0–17.5 | 0–7.0 | 2.3 | 2.6 | ||
顆粒球系幼若細胞
[編集]白血球系の幼若細胞の大半を占める顆粒球(主に好中球、他に少数の好酸球・好塩基球)の形態の概要を示す[10]。
なお、血液細胞は、一般に、幼若なものほど、細胞が大きく、核は類円形に近く、核クロマチンが繊細で、細胞質の好塩基性(青色調)が強い。 成熟に従い、核は固有の形をとり、クロマチンは粗になり核小体も消失、細胞質も固有の色調を呈し、顆粒球系では特異的な顆粒が出現してくる。[11]
| 顆粒球系 | シェーマ・画像 | 直径 | 核 | 細胞質 | |
|---|---|---|---|---|---|
| 骨髄芽球 (myeloblast) |  | 10~15μm | 円形、クロマチンは網状繊細、核小体がある。 | 青色、顆粒は認めない。 | |
| 前骨髄球 (promyelocyte) |  | 15~20μm | 偏在、円形、クロマチンは繊細、核小体を認めることが多い。 | 青色、アズール顆粒(一次顆粒)、核周明庭(ゴルジ野)[※ 11]がみられる。 | |
| 骨髄球 (myelocyte) |  | 12~20μm | 類円形、クロマチンは粗。核小体は認めない。 | 特異顆粒(二次顆粒)を認める、青色が薄れる。アズール顆粒は残存していることがある。 | |
| 後骨髄球 (metamyelocyte) |  | 12~18μm | 陥凹(腎ないしそら豆型)、クロマチンは粗で一部塊状。 | ほとんどが特異顆粒で占められる | |
赤芽球系幼若細胞
[編集]| 赤芽球系 | シェーマ・画像 | 直径 | 核 | 細胞質 | |
|---|---|---|---|---|---|
| 前赤芽球 (proerythroblast) | ①核小体 ②核周明庭 (ゴルジ野) | 20~25μm | 核クロマチンは顆粒状繊細で核小体がある。 | 濃青色、狭く明瞭な核周明庭[※ 11]を認める。 | |
| 好塩基性赤芽球 (basophilic erythroblast) | 16~20μm | 核クロマチンは顆粒状、核小体はない。 | 濃青色、前赤芽球に比べて濃い。核周明庭も認める。 | ||
| 多染性赤芽球 (polychromatic erythroblast) |  |  | 12~18μm | 核クロマチンは粗大、一部塊状。核小体はない。 | 淡青色にヘモグロビン色調(橙紅色)が加わる。 |
| 正染性赤芽球 (orthochromic erythroblast) | 8~10 μm | 核クロマチンは濃縮。 | 正常赤血球とほぼ同じ色。 | ||
その他の細胞
[編集]



- マスト細胞(組織肥満細胞)
- マスト細胞は、骨髄の造血幹細胞・骨髄系前駆細胞に由来するが、骨髄ではなく末梢組織で成熟し、アレルギー反応や自然免疫などに関与する。血中には出現せず、白血球ではないと考えられている。マスト細胞の核は円形で、好塩基球に似て多数の好塩基性顆粒をもつ。[2]:159
- マクロファージ
- 骨髄で成熟した単球は末梢血から組織に移行してマクロファージ、破骨細胞、樹状細胞、クッパー細胞、ミクログリアなどに分化する。マクロファージは、老化・死滅した細胞などを貪食する他、自然免疫や抗原提示に関与する。マクロファージの径は40〜50 μmに達し、卵円形の核をもち、細胞質の色は淡く、しばしば貪食した残渣を含む。 [2]:159-161
M/E比
[編集]有核細胞分画を算定する場合はM/E比(英語: Myeloid-to-erythroid ratio)も算出される。これは、骨髄の有核細胞のうち、赤芽球系と顆粒球(好中球・好酸球・好塩基球)系の細胞数比率である(リンパ球、形質細胞、などは除く。なお、単球を含める場合をM/E比、含めない場合をG/E比とする場合もある[9])。 基準値は「骨髄像の基準値」の項に記載したように0.8〜4.1であるが、文献により、2〜3[14]、1.5〜3.3[15]、2〜4[13]、等、差がある。
- M/E比が上昇する病態
- 赤芽球系造血が低下する病態(赤芽球癆など)、および、顆粒球系が増加する病態(炎症、急性骨髄性白血病、顆粒球コロニー刺激因子(G-CSF)投与、など)があげられる。
有核細胞数・巨核球数
[編集]骨髄穿刺吸引液中の有核細胞数[※ 4]や巨核球数は骨髄での造血状況を反映し、骨髄像検査の際に併せて算定されるのが通常である。 有核細胞数が低下していると低形成(造血能の低下)、上昇していると過形成(造血能の亢進または異常細胞の増加)と判定する[13][15]。 ただし、骨髄穿刺吸引液には末梢血が混入することが避けられないため、基準値は、おおよその目安程度の位置づけとなる[8]。
| 有核細胞数の基準値[14][8][15][13] | 低値をしめす病態の例 | 高値をしめす病態の例 |
|---|---|---|
| 10万 〜 25万 /μL | 再生不良性貧血、化学療法後、骨髄線維症、末梢血の混入。 | 急性白血病(低形成の場合もある)、骨髄増殖性腫瘍/疾患(慢性骨髄性白血病、真性多血症、原発性血小板血症など)、骨髄異形成症候群(末梢血は汎血球減少でも正ないし過形成であることが多いが、低形成の場合もある)、溶血性貧血(末梢血は赤血球減少) |
骨髄穿刺吸引液中の巨核球数は血小板造血能を反映するが、有核細胞数と同様、末梢血混入の影響が大きい。
| 巨核球数の基準値[14][8][15][13] | 低値をしめす病態の例 | 高値をしめす病態の例 |
|---|---|---|
| 50 〜 150 /μL | 特発性血小板減少性紫斑病(ITP)、慢性骨髄性白血病、本態性血小板血症、反応性(二次性)血小板増多症、造血の回復期 |
特殊染色(血液細胞化学染色)
[編集]


骨髄細胞の特殊染色としては、血液細胞化学染色(細胞の形態を保ったままで化学反応を行い反応産物を呈色させる検査)がおこなわれる。 主な目的は、鉄などの細胞内物質の検出、および、細胞系統の同定(骨髄系かリンパ系か等)や細胞の分化度の判定、である[※ 13]。[8][15]
- 鉄染色
- 鉄染色は、赤芽球やマクロファージの細胞内の非ヘモグロビン鉄[※ 14]をフェロシアンイオンと結合させることにより不溶性の色素ベルリン青(プルシアンブルー)を生成させ、濃青色の鉄顆粒を染め出すものである[※ 15]。赤芽球のおよそ30%は鉄染色で鉄顆粒を認め、鉄芽球と呼ばれる。鉄芽球数は貯蔵鉄量に比例し、鉄欠乏状態では減少するため、貯蔵鉄の評価(鉄欠乏・鉄過剰)に有用である。また、病的状態では、核を囲むミトコンドリア内に病的な鉄顆粒が出現し、これを環状鉄芽球とよぶ。環状鉄芽球の検出は鉄芽球性貧血や骨髄異形成症候群の診断に有用である。[15]
- ペルオキシダーゼ染色(ミエロペルオキシダーゼ染色)
- 好中球や単球に存在するミエロペルオキシダーゼ[※ 16]を検出する染色である。リンパ系細胞にはミエロペルオキシダーゼが含まれないため、古くから急性白血病の芽球がリンパ系か骨髄系かの鑑別に用いられてきており、芽球の3 %以上がミエロペルオキシダーゼ陽性であれば骨髄系と判定する[※ 17](。[15]
- エステラーゼ染色
- エステラーゼ反応は単球系細胞と好中球系細胞の鑑別に有用である。単球では非特異的エステラーゼ反応は強陽性であり、好中球では陰性である。なお、T細胞系でも非特異的エステラーゼ反応が弱いながら陽性になるが、単球系ではフッ化ナトリウムによる阻害試験で陰性化する一方、T細胞系では陰性化されないので鑑別可能である。[15]
- PAS(パス)染色
- PAS染色は過ヨウ素酸シッフ反応でグリコゲンを染色するもので、正常赤芽球は陰性が通常であるが、急性赤白血病(AML-M6)や骨髄異形成症候群の赤芽球では陽性になることがある。また、骨髄に転移した腺癌細胞では強陽性を示す。ただし、本法は多くの細胞系統で陽性となり特異性が低いため、近年はおまり行われない。[15][14]
骨髄像の異常と病態
[編集]

- 有核細胞数の増加・減少
- 著減している場合(骨髄低形成)は再生不良性貧血、化学療法後、低形成性白血病[※ 12]、などが考えられる。逆に、著増している場合(骨髄過形成)は、急性白血病(低形成の場合もある)、骨髄増殖性腫瘍/疾患、骨髄異形成症候群、溶血性貧血、などが考えられる。
- 血球形態異常
- 巨赤芽球性貧血では、巨赤芽球(大型で核が未熟な赤芽球)がみられる。
- 骨髄異形成症候群では、下記のような各系統の細胞形態の異常が見られる。[16]
- 赤芽球系:巨赤芽球、多核赤芽球、など。また、鉄染色で環状鉄芽球、PAS染色でPAS染色陽性赤芽球がみられることがある。[16]
- 顆粒球系:アウエル小体、過分葉・ペルゲル・フェット核異常などの核の分葉異常、細胞質顆粒の減少、など、さまざまな異形成の所見が見られる。
- 巨核球系:微小巨核球、単核巨核球、分離多核巨核球、などの巨核球の形態異常がみられることがある
- 異常細胞や微生物の存在
- 悪性腫瘍の骨髄浸潤、血球貪食症候群の血球貪食像、ゴーシェ病・ニーマンピック病などの先天代謝異常で異常な代謝産物の蓄積した細胞(ゴーシェ細胞、ニーマンピック細胞、泡沫細胞など)がみられることがある[※ 9]。また、感染症の所見や原因微生物がみられることがある。その他の全身性疾患の検索の項を参照されたい。
血液疾患と骨髄像
[編集]主要な血液疾患でみられる骨髄像の所見を下の表に示す。
| 急性白血病 | 芽球(白血病細胞)が増加(WHO分類では20 %以上[※ 19]、FAB分類では30 %以上)。 |
| 骨髄異形成症候群 | 通常は正形成から過形成、三系統の細胞(赤芽球系、顆粒球系、巨核球)の形態異常。 |
| 慢性骨髄性白血病 | 顆粒球系を中心に過形成が著明。M/E比上昇。 |
| 真性多血症 | 過形成(赤芽球、顆粒球、巨核球の増加)。 |
| 悪性リンパ腫 | 腫瘍細胞の浸潤がみられることがある(進行期であることを意味する。) |
| 多発性骨髄腫 | 形質細胞の増加がみられる。 |
| 再生不良性貧血 | 有核細胞数が減少。相対的にリンパ球、形質細胞、マクロファージが増加。 |
| 鉄欠乏性貧血 | 赤芽球過形成がみられることが多い。鉄染色では赤芽球などの鉄顆粒が減少している。(本疾患診断のために骨髄検査を行うことはない。) |
| 悪性貧血 | 巨赤芽球性変化と過形成がみられる。好中球の過分葉がみられる。(骨髄検査は診断のためには必須ではない。) |
| 溶血性貧血 | 赤芽球過形成がみられる。(通常は骨髄検査は必要ない。) |
| 骨髄線維症 | 骨髄液を採取できないことが多い(ドライタップ)。骨髄生検標本で判定する。 |
| 特発性血小板減少性紫斑病 | 巨核球数は正常か増加。(通常は骨髄検査は必要ない。) |
| 本態性血小板血症 | 巨核球数増加(形態異常もみられることがある)。 |
|
|
|
関連する骨髄検査
[編集]骨髄生検
[編集]細胞の形態学的観察には塗抹標本による骨髄像が優れているが、 骨髄の細胞密度や細胞分布の評価、線維化の評価、悪性腫瘍の転移の組織診断、 などの目的には骨髄生検が優れている。患者の負担は骨髄穿刺よりはやや大きい。 造血能の評価や悪性腫瘍の検索など、病態によっては、骨髄穿刺吸引と骨髄生検が併用されることがある。
骨髄液の遺伝子・染色体検査
[編集]白血病などの造血器腫瘍においては、 骨髄像での形態学的観察が診断の基本であることには変わりないが、 近年は病型診断・予後予測・治療方針の決定(治療薬の選択)に遺伝子・染色体検査が不可欠なものとなっている。 1976年に発表された白血病のFAB分類は骨髄像の形態学的観察に基づくものであり、 今日でも形態学的診断の基盤であるが、 分子遺伝学の進歩により、各腫瘍の生物学的性質を把握することが可能となり、 形態学と遺伝学を統合した2001年のWHO分類提案に至った(2025年現在のWHO分類の最新版は2024年8月に発行された第5版である)。[17][18][7][19][20]。
- G分染法
- G分染法はギムザ染色で染色体の欠失や転座などを調べる方法である。染色体全体の異常を網羅的に可視化でき、複雑な染色体異常も検出できるが、検査には生きた細胞を培養する必要があり、一般に、結果が出るまでに時間を要する。また、検出感度は低く、微量の腫瘍細胞の検出には不向きである。[21][15]
- FISH法
- FISH法は蛍光色素で標識したDNAプローブ(標的遺伝子と相補的な塩基配列をもつDNA断片)をハイブリダイゼーションして観察する方法である。固定後の細胞でも実施可能であり、G分染法に比べ結果が出るのが早いが、プローブを用意する必要があるため、特定の異常の可能性を予想した場合にしか使用できない。
- FISH法の応用例としては、慢性骨髄性白血病の90から95 %にみられる、フィラデルフィア染色体と呼ばれる22番染色体と9番染色体の間での相互転座の検出があげられる(これにより病因となるBCR-ABL1融合遺伝子が構成されている)。[15]
- PCR法
- PCR法は、各疾患に特徴的な遺伝子変異や融合遺伝子をPCR反応を用いて検出する方法であり、病型診断と治療方針の決定に不可欠になってきている[※ 20]。
- また、10-5から10-6レベルのごく微量の腫瘍細胞を検出可能であり、治療後に光学顕微鏡レベルで寛解と判断された後も残存している腫瘍細胞(微小残存病変)の検出に重要な役割を果たす。[14][8]
- サザンブロット法
- サザンブロット法は、リンパ系の腫瘍を疑う例で、免疫グロブリン(IgH)遺伝子やT細胞レセプター(TCR)遺伝子の再構成のクローナリティ(細胞集団がいくつのクローンに由来するか)の検出に用いられる。腫瘍性疾患ではモノクローナルな増殖が認められる。[14]
骨髄液の細胞表面マーカー検査
[編集]細胞表面マーカー検査(フローサイトメトリー)は、 細胞表面の特定の抗原を識別することにより、腫瘍細胞の免疫表現型を知る検査である。 形態学的観察では困難な細胞系統の同定や病型診断、少数の異常細胞の検出、微小残存病変の評価などに有用である。 また、一般に、遺伝子・染色体検査よりも早く結果が出ることが多い。 例をあげれば、急性白血病が骨髄性かリンパ性かの区別はペルオキシダーゼ染色がもちいられるが、 一部のペルオキシダーゼ陰性の急性骨髄性白血病例には骨髄系の細胞表面マーカーであるCD13、CD33の検索が有用である[22]。
注釈
[編集]- ^ 骨髄像、特に有核細胞分画は英語でmyelogramと呼ばれることもある。 しかし、myelogramという語は「脊髄造影」の意味で使用されるのが通常であるため、混乱が起きないよう注意を要する。
- ^ 骨髄穿刺液を多量に採取すると末梢血が混入して形態学的観察に支障をきたすため、骨髄像用には最初に0.5 mL未満のごく少量を吸引し、細胞表面マーカー検査・遺伝子検査・染色体検査等に必要な検体は注射器を取り替えて別途採取する。
- ^ 骨髄穿刺液の凝血塊を固定して病理標本を作成して検査する場合もある。標本作成に脱灰が必要ないというメリットがあり、骨髄生検標本に近い骨髄実質の構造や細胞密度等の情報が得られるとされる。
- ^ a b 「有核細胞」は、ここでは、赤血球、血小板のような核を持たない細胞を除く、血液系の細胞という意味である。成熟白血球に加え、末梢血には原則的に出現しない幼若な赤芽球や骨髄芽球が主体となる。
- ^ 診断済みの疾患の治療効果の判定など、有核細胞分画で特に追加で有用な情報が得られない場合は算定を省略することもある。
- ^ 血液疾患であれば全て骨髄検査の適応があるわけでなく、鉄欠乏性貧血、ビタミンB12や葉酸の欠乏による巨赤芽球性貧血、などは血算や血液生化学検査のみで診断可能であるため、骨髄検査は特別な理由がない限り実施されないのが通常である。
- ^ 骨髄癌腫症は、胃がんなどの悪性腫瘍が骨髄にびまん性に転移して骨髄組織を置き換える、予後不良の疾患である。
- ^ リンパ系以外の固形癌でも骨髄転移が認められたら進行期であるが、比較的に頻度が低いため、骨髄癌腫症(骨髄に広汎に腫瘍細胞が転移・増殖する病態)を疑う等、特別な事情がない限り、ルーチンに骨髄検査を行うことはない。
- ^ a b ゴーシェ細胞とは、グルコセレブロシダーゼ活性の低下のためにグルコセレブロシドが大量に蓄積したマクロファージのことである。「丸めたティッシュペーパー」と形容される。ゴーシェ細胞の画像については外部サイト(ASH IMage Bank) Gaucher's Diseaseを参照されたい。ニーマンピック病A型・B型では、スフィンゴミエリンが大量に蓄積した泡沫状のニーマン・ピック細胞、C型では脂質を含む泡沫細胞が見られる。ニーマン・ピック細胞の画像については(ASH Image Bank)Niemann–Pick diseaseを参照されたい。
- ^ 好塩基性特異顆粒をもつ細胞は核がよく見えず分類困難なことがあるため、好塩基球として一括分類される。
- ^ a b 細胞質内のゴルジ体がよく発達していると、染色観察時、細胞質がやや明るくみえる。核のまわりの明るく見える部分を核周明庭とよび、ゴルジ体の存在する領域である。
- ^ a b 低形成性白血病とは、急性白血病のうちで、骨髄が低形成で芽球の増殖が比較的おそいものをいい、高齢者に多い。
- ^ 近年は、細胞系統の同定には細胞表面マーカーの比重が大きくなってきている。
- ^ 非ヘモグロビン鉄とは、フェリチン、ヘモジデリンなどのヘムに結合していない鉄である。(ヘモグロビンやミオグロビンに含まれるポルフィリンに結合した鉄は鉄染色で染まらない。)
- ^ 骨髄生検標本では、標本作成のための脱灰処理(薄切可能とするため骨のカルシウムを除去する処理)のため鉄が失われることがあるので、骨髄液塗抹標本のほうが鉄染色に適している。
- ^ ミエロペルオキシダーゼは好中球の殺菌能に関与しており、骨髄異形成症候群などでペルオキシダーゼ陰性の好中球がみられるのは機能異常を示すと考えられている。
- ^ リンパ系か骨髄系かの鑑別が重要なのは、リンパ系の白血病と骨髄系の白血病では治療法が大きく異なるためである。なお、骨髄系の白血病でも、非常に未熟な芽球(FAB-M0)や幼若な単球(FAB-M5a)、巨核芽球性白血病(FAB-M7)ではペルオキシダーゼ染色が陰性であるため、細胞表面マーカーなどもあわせて確認する必要がある。
- ^ 赤芽球癆の骨髄像は外部サイト(AHS Image Bank)Pure Red Cell Aplasia (PRCA) – parvovirus infectionなどを参照されたい。
- ^ WHO分類第5版では、遺伝子型によっては20 %以上という制限がなくなっている。
- ^ 例をあげれば、FLT3遺伝子は急性骨髄性白血病の約三分の一の例で変異がみられ、FLT3の活性化により白血病細胞の増殖を促進している。FLT3阻害薬の適応決定には欠かせない検査である。
出典
[編集]- ^ 吉冨一恵, 上硲俊法「〈臨床検査シリーズ〉血液検査室の流れ:血球算定から骨髄像検査まで」『近畿大学医学雑誌』第34巻第4号、近畿大学医学会、2009年、275-284頁、CRID 1050282677516207616、ISSN 03858367。
- ^ a b c d e Keohane, E. M., Smith, L., Walenga, J. M. (2015). Rodak’s Hematology - E-Book: Rodak’s Hematology - E-Book. Elsevier Health Sciences. ISBN 978-0-323-32716-9
- ^ 千葉陽一 (1997). “白赤芽球症について”. 医療 51 (9): 398–402. doi:10.11261/iryo1946.51.398.
- ^ David, A., Quinlan, J. D. (2022). “Fever of Unknown Origin in Adults”. Am Fam Physician 105: 137-143.
- ^ 駒形嘉紀 (2013). “4.マクロファージ活性化症候群と血球貪食症候群”. 日本内科学会雑誌 102 (10): 2639–2644. doi:10.2169/naika.102.2639.
- ^ Gangireddy, M., Ciofoaia, G. A. (2025). “StatPearls”. Systemic Mastocytosis. StatPearls Publishing
- ^ a b 松永卓也 (2013). “2.診断プロセス”. 日本内科学会雑誌 102 (7): 1676–1681. doi:10.2169/naika.102.1676.
- ^ a b c d e f 櫻林郁之介 編『今日の臨床検査2021-2022』南江堂、2021年、65-66頁。ISBN 978-4-524-22803-4。
- ^ a b Parmentier S, Kramer M, Weller S, Schuler U, Ordemann R, Rall G (2020). “Reevaluation of reference values for bone marrow differential counts in 236 healthy bone marrow donors.”. Ann Hematol 99 (12): 2723–2729. doi:10.1007/s00277-020-04255-4. PMC 7683448. PMID 32935189.
- ^ a b 血球形態標準化ワーキンググループ(日本検査血液学会・日本臨床衛生検査技師会) (2021年). “顆粒球系細胞の分化連続画像”. 日本検査血液学会標準化委員会. 日本検査血液学会標準化委員会. 2025年2月22日閲覧。
- ^ 「ネットで形態」 血液形態自習塾 第2部 末梢血・骨髄像の見方&考え方/ベックマン・コールター 22 February 2025閲覧。
- ^ 血球形態標準化ワーキンググループ(日本検査血液学会・日本臨床衛生検査技師会) (2021年). “赤芽球系細胞の分化連続画像”. 日本検査血液学会標準化委員会. 日本検査血液学会標準化委員会. 2025年2月22日閲覧。
- ^ a b c d e f 金井正光 編『臨床検査法提要』(改定第31版)金原出版株式会社、1998年、298-309頁。ISBN 4-307-05033-9。
- ^ a b c d e f g h i 黒川清 編『臨床検査データブック2025-2026』医学書院、2025年1月15日、355-357,939-950頁。ISBN 978-4-260-05672-4。
- ^ a b c d e f g h i j k l 大西宏明, Medical Practice編集委員会 編『臨床検査ガイド 2020年改訂版』文光堂、2020年、481-484頁。ISBN 978-4-8306-8037-3。
- ^ a b 通山薫「2.血液形態学」『日本内科学会雑誌』第101巻第7号、日本内科学会、2012年、1919-1927頁、doi:10.2169/naika.101.1919、ISSN 00215384、PMID 22896995。
- ^ 通山薫 (2013). “1.fab分類とwho分類”. 日本内科学会雑誌 102 (7): 1667–1675. doi:10.2169/naika.102.1667.
- ^ 清井仁 (2018). “2.白血病の診断と治療―最近の進歩―”. 日本内科学会雑誌 107 (3): 493–498. doi:10.2169/naika.107.493.
- ^ 通山薫 (2022). “近く発刊予定の造血器腫瘍のWHO分類第5版----特に骨髄系腫瘍の概要”. モダンメディア 68 (9): 390-394.
- ^ 石川裕一 (2022). “I.急性骨髄性白血病の初期診断と外来治療”. 日本内科学会雑誌 111 (7): 1344–1350. doi:10.2169/naika.111.1344.
- ^ 三浦偉久男 (2011). “血液悪性腫瘍の染色体異常―最新の知見―”. 日本内科学会雑誌 100 (2): 503–508. doi:10.2169/naika.100.503.
- ^ 増田亜希子 (2011). “4.細胞表面形質”. 日本内科学会雑誌 100 (7): 1807–1816. doi:10.2169/naika.100.1807.
関連項目
[編集]- 検査
- 血液細胞・関連する細胞
- 血液疾患・病態
- 貧血、巨赤芽球性貧血、鉄芽球性貧血、溶血性貧血、鉄過剰症、再生不良性貧血、骨髄線維症
- 白血病、急性白血病
- 急性骨髄性白血病、慢性骨髄性白血病
- 急性リンパ性白血病、成人T細胞白血病、慢性リンパ性白血病、悪性リンパ腫
- リンパ球増多症・リンパ球減少症・異型リンパ球
- 左方移動・好中球増多症・好中球減少症
- 好酸球増多症・好酸球減少症
- 好塩基球・好塩基球増多症・好塩基球減少症
- 単球増多症・単球減少症


 French
French Deutsch
Deutsch