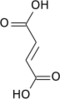
リンゴ酸
| リンゴ酸 | |
|---|---|
 | |
 | |
 | |
2-ヒドロキシブタン二酸 | |
別称 L-リンゴ酸 D-リンゴ酸 (-)-リンゴ酸 (+)-リンゴ酸 (S)-ヒドロキシブタン二酸 (R)-ヒドロキシブタン二酸 | |
| 識別情報 | |
| CAS登録番号 | 6915-15-7 |
| ChemSpider | 510 |
| EC番号 | 230-022-8 |
| E番号 | E296 (防腐剤) |
| KEGG | C00149 |
| 特性 | |
| 化学式 | C4H6O5 |
| モル質量 | 134.09 g mol−1 |
| 示性式 | HOOC-CH(OH)-CH2-COOH |
| 密度 | 1.609 g/cm3 |
| 融点 | 130 ℃ |
| 水への溶解度 | 558 g/l (at 20 ℃)[1] |
| 酸解離定数 pKa | pKa1 = 3.4, pKa2 = 5.13 |
| 関連する物質 | |
| その他の陰イオン | リンゴ酸イオン |
| 関連するカルボン酸 | プロピオン酸 酪酸 コハク酸 酒石酸 クロトン酸 フマル酸 吉草酸 |
| 関連物質 | 1-ブタノール ブチルアルデヒド クロトンアルデヒド リンゴ酸ナトリウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
リンゴ酸(林檎酸、リンゴさん、malic acid)とは、ヒドロキシ酸に分類される有機化合物の一種。オキシコハク酸ともいう。リンゴ酸の和名は、リンゴから見つかったことに由来する。IUPAC置換命名法では 2-ヒドロキシブタン二酸 (2-hydroxybutanedioic acid) と表される。2位に光学中心を持ち、リンゴに多く含まれる異性体は (S)-(-)-L体 である。0.1% 水溶液の pH は 2.82。 リンゴ酸は2つの光学活性形態とラセミ混合物として存在する。ヨーロッパとアメリカで商業的に生産されている合成材料はラセミ混合物であり、リンゴや多くの他の果物や植物で発見されている天然材料は左回りである[2]。
生化学
[編集]天然にはL-リンゴ酸が見られる。
-
L-リンゴ酸 -
D-リンゴ酸
リンゴ酸は生化学で重要な役割を果たす。
C4型光合成では、カルビン回路のCO2源となる。クエン酸回路ではH2Oがフマル酸のSi面に付加することで(S)-リンゴ酸が生成する。(S)-リンゴ酸はリンゴ酸デヒドロゲナーゼによって酸化され、オキサロ酢酸となる。ピルビン酸から補充反応によって生成されることもある。
サボテンなどのCAM型光合成では、夜間に気孔を開き二酸化炭素をリンゴ酸の形で取り込み、日中にリンゴ酸から二酸化炭素を取り出すことで、水分の蒸散を最小限としている[3]。
孔辺細胞では、ホスホエノールピルビン酸のカルボキシル化によっても合成される。これは細胞がカリウムを取り込む際にその対イオンとなる。細胞内の溶質の濃度が上昇すると浸透圧が低下し、水が流入して細胞が膨張することで気孔が閉じる。
生理学
[編集]用途
[編集]
爽快感のある酸味を持つため、飲料や食品の酸味料として用いられる。また、pH調整剤、乳化剤など、食品工業においてさまざまな用途に利用されている。
キレート性を持つ酸であることから、金属表面の洗浄などにも用いられる。アルミニウムをキレートする能力が高い。
食品、工業に使われるリンゴ酸は、多くの場合ラセミ体が用いられる。
食品との関連
[編集]リンゴ酸は1785年、カール・ヴィルヘルム・シェーレによってリンゴジュースから単離された。1787年、アントワーヌ・ラヴォアジエがラテン語mālum(リンゴ)に由来するacide maliqueという名を提唱した[6]。リンゴの酸味に寄与する。ブドウにも存在し、ワインでは5g/l以上の濃度になることもある[7]。ブドウが熟していくと共にその量は減少するが、ワインに酸味を与える。マロラクティック発酵は、2塩基のリンゴ酸をよりまろやかな1塩基の乳酸に変換する。
食品添加物としては、E296というE番号が与えられている。酸味の少ないクエン酸の代用としても使われるが、過剰摂取により口の中に炎症を引き起こす可能性もある。食品添加物として欧州[8]・米国[9]・オーストラリア、ニュージーランド[10]で認可されている。
サプリメントとしてはアメリカなどで販売されている。
サプリメントにおいてはリンゴ酸のカルシウム化合物であるリンゴ酸カルシウムがクエン酸カルシウムの溶解性を高めるために用いられる。この混合物は特にクエン酸リンゴ酸カルシウム(CCM - calcium citrate malate(英語版))と呼ばれている[注 1]。
反応
[編集]発煙硫酸によって自己縮合し、ピロンであるクマリン酸(o-クマル酸ではないので注意)を与える[12]。
(-)-リンゴ酸はPCl5の作用で(+)-クロロコハク酸となり、(+)-クロロコハク酸は酸化銀(I)触媒により(+)-リンゴ酸となる。(+)-リンゴ酸にPCl5を作用させると(-)-クロロコハク酸となる。このことからヴァルデン反転が発見された。
脚注
[編集]注釈
[編集]- ^ 1981年に日本の特許(特開昭56-097248)でクエン酸リンゴ酸カルシウムが比較的溶解しやすい事が示されてから、その構成比率(カルシウム:クエン酸:リンゴ酸のモル比5:2:2等)についての調整が行われつつ現在に至っている。
出典
[編集]- ^ chemBlink Online Database of Chemicals from Around the World
- ^ “Malic acid”. 2023年6月19日閲覧。
- ^ “サボテンの秘密(形態・生理的特徴) 堀部研究室(園芸学研究室)”. 中部大学(www3.chubu.ac.jp). 2024年3月25日閲覧。
- ^ Bjornar Hassel, Anders Brathe and Dirk Petersen (July 2002). “Cerebral dicarboxylate transport and metabolism studied with isotopically labelled fumarate, malate and malonate”. Journal of Neurochemistry 82 (2): 410-419. doi:10.1046/j.1471-4159.2002.00986.x 2020年8月24日閲覧。.
- ^ “Malic acid supplementation increases urinary citrate excretion and urinary pH: implications for the potential treatment of calcium oxalate stone disease”. Journal of endourology 28 (2). (2014). doi:10.1089/end.2013.0477. PMID 24059642.
- ^ The Origin of the Names Malic, Maleic, and Malonic Acid Jensen, William B. J. Chem. Educ. 2007, 84, 924. Abstract
- ^ "Methods For Analysis of Musts and Wines", Ough and Amerine, John Wiley and Sons, 2nd Edition, 1988, page 67
- ^ UK Food Standards Agency: “Current EU approved additives and their E Numbers”. 2011年10月27日閲覧。
- ^ US Food and Drug Administration: “Listing of Food Additives Status Part II”. 2011年10月27日閲覧。
- ^ Australia New Zealand Food Standards Code“Standard 1.2.4 - Labelling of ingredients”. 2011年10月27日閲覧。
- ^ Karlheinz Miltenberger "Hydroxycarboxylic Acids, Aliphatic" in Ullmann's Encyclopedia of Industrial Chemistry,2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a13 507
- ^ Richard H. Wiley and Newton R. Smith (1963). "Coumalic acid". Organic Syntheses (英語).; Collective Volume, vol. 4, p. 201


 French
French Deutsch
Deutsch