Zawał mózgu – Wikipedia, wolna encyklopedia
| Infarctus cerebri | |
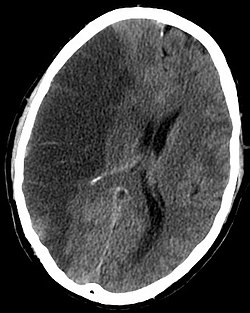 Obraz TK prawostronnego zawału mózgu (lewa strona zdjęcia) | |
| Klasyfikacje | |
| ICD-10 | I63 |
|---|---|
Zawał mózgu, udar niedokrwienny mózgu – udar mózgu spowodowany niedokrwieniem. Od zawału należy odróżnić dwa inne rodzaje udarów: krwotok śródmózgowy i krwotok podpajęczynówkowy.
Klasyfikacja
[edytuj | edytuj kod]Wśród zawałów mózgu wyróżnia się: zawały miażdżycowe, zatory pochodzenia sercowego[1] i zawały lakunarne w obrębie małych naczyń. Dalsza klasyfikacja zawałów mózgu związana jest z rodzajem zamkniętego naczynia tętniczego (np. zawał w obszarze tętnicy mózgu środkowej, zawał w obszarze tętnicy móżdżkowej dolnej tylnej) i to ona determinuje jaki zespół objawów będzie towarzyszył danemu zawałowi mózgu.
Inny podział zawałów mózgu to tzw. klasyfikacja oksfordzka, według której wyróżnia się:
- TACI (total anterior circulation infarct), czyli zawał mózgu w obszarze całego przedniego unaczynienia tzn. tętnicy środkowej i tętnicy przedniej mózgu
- PACI (partial anterior circulation infarct), czyli częściowy zawał mózgu z zakresu tętnicy przedniej lub środkowej
- LACI (lacunar infarct), czyli zawał lakunarny albo zatokowaty
- POCI (posterior circulation infarct), czyli zawał mózgu w obszarze unaczynienia tylnego, tzn. kręgowo-podstawnego[2].
Te cztery typy określają rozległość zawału, nasilenie objawów, rokowanie oraz najbardziej prawdopodobną przyczynę[3][4].
Objawy
[edytuj | edytuj kod]Objawy zawału mózgu są określone przez topograficzną lokalizację ogniska uszkodzenia mózgowia. I tak, jeśli uszkodzenie obejmuje korę mózgu ruchową, to pojawia się przeciwstronny niedowład, jeśli czuciową – przeciwstronne zaburzenie czucia, wzrokową – korowe zaburzenia widzenia. W przypadku lokalizacji ogniska zawału w pniu mózgu objawy towarzyszące będą układać się w jeden z naprzemiennych zespołów pniowych: zespół Wallenberga, zespół Webera, zespół Millarda i Gublera, zespół Foville'a, zespół Benedikta lub inne rzadsze[5].
Leczenie
[edytuj | edytuj kod]Od końca lat 90., na wzór leczenia ostrego zawału serca, wprowadzono do leczenia udaru niedokrwiennego mózgu leki trombolityczne. Są to leki aktywujące trombolizę, czyli "rozpuszczanie" skrzepu będącego przyczyną niedokrwienia mózgu. Leczenie należy wykonać w trybie nagłym, doraźnym, najszybciej jak to jest możliwe, w trakcie tak zwanego okna terapeutycznego, które dla obecnie stosowanego leku – rt-PA (rekombinowany tkankowy aktywator plazminogenu) – podawanego dożylnie wynosi do 4,5 godziny od pierwszych objawów (w szczególnych wypadkach do sześciu godzin). W Polsce, od roku 2003, na podstawie wytycznych Narodowego Programu Profilaktyki i Leczenia Chorób Sercowo-Naczyniowych POLKARD 2003–2005, prowadzone jest leczenie trombolityczne w udarze niedokrwiennym w specjalnie przygotowanych do tego oddziałach udarowych.
Mechaniczna trombektomia
[edytuj | edytuj kod]Innym dostępnym rodzajem leczenia w ostrym udarze niedokrwiennym jest bezpośrednie usunięcie skrzepliny ze światła tętnicy. Osiąga się to poprzez wprowadzenie cewnika do tętnicy udowej, następnie kieruje się go do krążenia mózgowego i za pomocą urządzenia przypominającego korkociąg chwyta się skrzep, a następnie usuwa go z organizmu. Jak wykazały badania kliniczne mechaniczna embolektomia okazała się skutecznym sposobem na przywrócenie przepływu krwi u pacjentów, którzy nie byli w stanie przyjmować leków trombolitycznych, lub dla których tromboliza dożylna była nieskuteczna. Trombektomię przeprowadza się do 6 godziny od początku udaru, w wyjątkowych przypadkach nawet do 24 godziny[6]. W Polsce od jesieni 2018 roku istnieje program pilotażowy obejmujący od lipca 2019 każde województwo w którym to jest wyznaczony CILUM (Centrum Interwencyjnego Leczenia Udaru Mózgu) który przeprowadza zabiegi trombektomii 24 godziny na dobę, 7 dni w tygodniu[7].
Angioplastyka i stentowanie
[edytuj | edytuj kod]Angioplastyka i implantacja stentów naczyniowych zaczęły być uważane za realnie możliwe w leczeniu ostrego udaru niedokrwiennego mózgu. W systematycznego przeglądzie sześciu jednoośrodkowych badań, obejmujących łącznie 300 pacjentów, z implantacją stentu do wewnątrz czaszki w objawowym zwężeniu tętnic wewnątrzczaszkowych, osiągnięto zadowalające efekty (redukcja do zwężenia poniżej 50%) w 90–98%, a częstość poważnych powikłań okołozabiegowych wahała się w zakresie 4–10%. Częstość restenozy i udaru mózgu po zabiegu utrzymywały się również na możliwym do zaakceptowania poziomie.[8] Dane te sugerują, że duże, randomizowane badanie jest potrzebne do pełnej oceny ewentualnych korzyści terapeutycznych związanych z tym leczeniem.
Profilaktyka
[edytuj | edytuj kod]Z uwagi na duże trudności w leczeniu zawału mózgu bardzo ważna dla ograniczenia zachorowalności na udar niedokrwienny jest odpowiednia profilaktyka. Obejmuje ona przede wszystkim wczesne wykrywanie zwężeń tętnic domózgowych (zwłaszcza tych najgroźniejszych, w tętnicach szyjnych) i ich odpowiednie leczenie zabiegowe, czyli endarterektomię tętnicy szyjnej.
Do profilaktyki zawału mózgu należy także stosowanie ogólnych zasad profilaktyki miażdżycy: dieta niskotłuszczowa, zwalczanie nadciśnienia tętniczego, unikanie palenia tytoniu.
Klasyfikacja ICD10
[edytuj | edytuj kod]| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: I63 | Zawał mózgu |
| ICD-10: I63.0 | Zawał mózgu spowodowany przez zakrzep tętnic przedmózgowych |
| ICD-10: I63.1 | Zawał mózgu spowodowany przez zator tętnic przedmózgowych |
| ICD-10: I63.2 | Zawał mózgu spowodowany przez nieokreśloną niedrożność lub zwężenie tętnic przedmózgowych |
| ICD-10: I63.3 | Zawał mózgu spowodowany przez zakrzep tętnic mózgowych |
| ICD-10: I63.4 | Zawał mózgu spowodowany przez zator tętnic mózgowych |
| ICD-10: I63.5 | Zawał mózgu spowodowany przez nieokreśloną niedrożność lub zwężenie tętnic mózgowych |
| ICD-10: I63.6 | Zawał mózgu spowodowany przez zakrzep żył mózgowych, nieropny |
| ICD-10: I63.8 | Inny zawał mózgu |
| ICD-10: I63.9 | Zawał mózgu nieokreślony |
Przypisy
[edytuj | edytuj kod]- ↑ Allan H. Ropper, Raymond Delacy Adams, Robert F. Brown, Maurice Victor: Adams and Victor's principles of neurology. New York: McGraw-Hill Medical Pub. Division, 2005. ISBN 0-07-141620-X.
- ↑ Janusz Siebert, Andrzej Basiński, Walenty Michał Nyka: Udar mózgu : postępowanie diagnostyczne i terapia w ostrym okresie udaru. Gdańsk: Via Medica, 2006, s. 9. ISBN 83-60072-37-X.
- ↑ J. Bamford, P. Sandercock, M. Dennis, J. Burn i inni. Classification and natural history of clinically identifiable subtypes of cerebral infarction.. „Lancet”. 337 (8756), s. 1521-6, Jun 1991. PMID: 1675378.
- ↑ JM. Bamford. The role of the clinical examination in the subclassification of stroke.. „Cerebrovasc Dis”. 10 Suppl 4, s. 2-4, 2000. PMID: 11070389.
- ↑ Peter Duus, Rolf Hassler: Diagnostyka topograficzna w neurologii: anatomia, fizjologia, klinika. Warszawa: Państ. Zakład Wydawnictw Lekarskich, 1989. ISBN 83-200-1444-1.
- ↑ Matthew R.B. Evans i inni, Revolution in acute ischaemic stroke care: a practical guide to mechanical thrombectomy, 2017.
- ↑ Aktualizacja wykazu realizatorów przezcewnikowej trombektomii mechanicznej w pilotażu [online], www.politykazdrowotna.com [dostęp 2019-12-03].
- ↑ CP. Derdeyn, MI. Chimowitz. Angioplasty and stenting for atherosclerotic intracranial stenosis: rationale for a randomized clinical trial.. „Neuroimaging Clin N Am”. 17 (3), s. 355-63, viii-ix, Aug 2007. DOI: 10.1016/j.nic.2007.05.001. PMID: 17826637.
Bibliografia
[edytuj | edytuj kod]- Rowland LP (red) "Neurologia Merritta" (tłum.: Kwieciński H i Kamińska AM), Elselvier Urban&Partner, Wrocław, 2008, ISBN 83-89581-11-6.


 French
French Deutsch
Deutsch