Ácido tioacético – Wikipédia, a enciclopédia livre
| Ácido tioacético Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
| Nome IUPAC | Ácido tioetanoico |
| Outros nomes | ácido S-tioacético ácido tiolacético |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| KEGG | |
| ChEBI | |
| SMILES |
|
| InChI | 1/C2H4OS/c1-2(3)4/h1H3,(H,3,4) |
| Propriedades | |
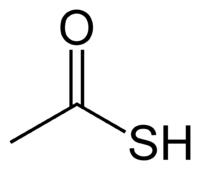
| Fórmula molecular | C2H4OS |
| Massa molar | 76.11756 |
| Densidade | 1.08 g/mL |
| Ponto de fusão | -58 °C, 215 K, -72 °F |
| Ponto de ebulição | 93 °C, 366 K, 199 °F |
| Riscos associados | |
| MSDS | Fischer Scientific |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Ácido tioacético é um composto organossulfurado com a fórmula molecular CH3COSH. É um líquido incolor com um forte cheiro de tiol. É usado em síntese orgânica para a introdução de grupos tiol em moléculas[1]
Síntese e propriedades
[editar | editar código-fonte]O ácido tioacético é preparado pela reação de anidrido acético com sulfeto de hidrogênio:
- (CH3C(O))2O + H2S → CH3C(O)SH + CH3CO2H
Ácido tioacético é tipicamente contaminado por ácido acético.
O composto existe exclusivamente como o tautômero tiol, consistente com a força da ligação dupla C=O. Refletindo a influência da ligação de hidrogênio, o ponto de ebulição (93 °C) e fusão são respectivamente 20 e 75K mais baixos que aqueles do ácido acético. Ele é também aproximadamente 15x mais ácido que o ácido acético.
Reatividade
[editar | editar código-fonte]O ânion de tioacetato e o radical gerado a partir do ácido tioacético são utilizados para gerar os ésteres tioacetato. Ésteres de tioacetato sofrem hidrólise resultando nos tióis. Um método típico para a preparação de um tiol a partir de haleto de alquilo utilizando ácido tioacético prossegue em quatro etapas distintas, algumas das quais podem ser realizadas sequencialmente, no mesmo recipiente:
- CH3C(O)SH + NaOH → CH3C(O)SNa + H2O
- CH3C(O)SNa + RX → CH3C(O)SR + NaX (X = Cl, Br, I, etc)
- CH3C(O)SR + 2 NaOH → CH3CO2Na + RSNa + H2O
- RSNa + HCl → RSH + NaCl
Uma aplicação que ilustra a utilização do comportamento de seu radical, o ácido tioacético é usado com AIBN em uma adição nucleofílica mediada por radical livre a um alceno exocíclico formando um tioéster:[2]
Referências
- ↑ Jeannie R. Phillips "Thiolacetic Acid" Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley. doi:10.1002/047084289X.rt096.
- ↑ Synthesis of methyl 6-deoxy-4-O-(sodium sulfonato)-α-L-talopyranoside, its C-4 epimer and both isosteric [4-C-(potassium sulfonatomethyl)] derivatives László Lázár, Magdolna Csávás, Anikó Borbás, Gyöngyi Gyémánt, and András Lipták ARKIVOC 2004 (vii) 196-207 Link


 French
French Deutsch
Deutsch