Adalimumabe – Wikipédia, a enciclopédia livre
Adalimumabe | |
 | |
Nome IUPAC (sistemática) | |
Identificadores | |
| 331731-18-1 | |
| L04AA17 | |
| BTD00049 | |
Informação química | |
| 144190.3 g/mol | |
Farmacocinética | |
| 64% | |
| 10-20 dias | |
Considerações terapêuticas | |
| Injeção subcutânea | |
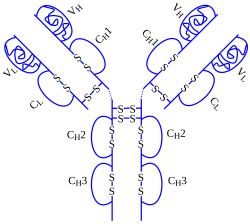
Adalimumabe é um medicamento usado como inibidor do fator de necrose tumoral, obtido da imunoglobulina humana. É um anticorpo monoclonal unicamente humano, diferendo de outros anti-TNFs quiméricos.
O adalimumabe age nos processos inflamatórios das doenças imuno-mediadas como a psoríase e artrite psoriásica de forma mais seletiva, sendo por essa razão mais eficaz e mais seguro que as drogas clássicas como o metotrexato. A aplicação é via subcutânea e para psoríase com dose de indução e depois doses de manutenção de 40 mg a cada 15 dias. Tem alto custo de tratamento. Já são utilizadas há quase 17 anos em vários países. É fundamental avaliação prévia da saúde, especialmente para tuberculose latente (ou ativa) por intermédio do exame PPD e radiografia do tórax. Recentemente (2015) teve patente liberada permitindo a fabricação de biossimilares.[1]
Propriedades
[editar | editar código-fonte]É obtido pela tecnologia do ADN recombinante. Bloqueia o fator de necrose tumoral alfa ou TNF-α, que desencadeia uma função específica na resposta inflamatória, responsável por muitas doenças auto-imunes. Os receptores celulares de membrana p55 e p75 ficam bloqueados.
Indicações
[editar | editar código-fonte]- Tratamento da psoríase
- Uso em pacientes reumáticos
- Espondilite anquilosante
- Doença de Crohn
Nomes comerciais
[editar | editar código-fonte]- Humira®
Referências
- ↑ Sabbag, CY, Psoríase Descobertas Além da Pele (2010). Psoríase Descobertas Além da Pele. [S.l.: s.n.] ISBN 978857728180-0
Ligações externas
[editar | editar código-fonte]- «MEDICAMENTO HUMIRA, DA ABBOTT, É APROVADO PELA UNIÃO EUROPEIA PARA O TRATAMENTO DA PSORÍASE». Consultado em 1 de janeiro de 2008


 French
French Deutsch
Deutsch