Fluido supercrítico – Wikipédia, a enciclopédia livre
Fluido supercrítico é qualquer substância em uma temperatura e pressão acima do seu ponto crítico, no qual não existe mais distinção entre as fases líquida e gasosa. Ele sofre efusão através de sólidos como um gás, e pode dissolver materiais como um líquido. Além disso, perto do seu ponto crítico, pequenas mudanças em sua pressão ou temperatura resultam em grandes mudanças de densidade, permitindo que sejam feitos pequenos ajustes nas propriedades de um fluido supercrítico.
Os fluidos supercríticos são substitutos adequados a solventes orgânicos em uma variedade de processos industriais e laboratoriais. Dióxido de Carbono e água são os fluidos supercríticos mais comumente usados, para descafeinação e geração de eletricidade, respectivamente.
Propriedades
[editar | editar código-fonte]Em termos gerais, fluidos supercríticos tem propriedades entre a de um gás e a de um líquido. Na Tabela 1, as propriedades críticas de alguns componentes que são comumente usados como fluidos supercríticos são mostradas.
| Solvente | Peso molecular | Temperatura Crítica | Pressão Crítica | Densidade Crítica |
|---|---|---|---|---|
| g/mol | K | MPa (atm) | g/cm3 | |
| Dióxido de Carbono (CO2) | 44.01 | 304.1 | 7.38 (72.8) | 0.469 |
| Água (H2O) | 18.015 | 647.096 | 22.064 (217.755) | 0.322 |
| Metano (CH4) | 16.04 | 190.4 | 4.60 (45.4) | 0.162 |
| Etano (C2H6) | 30.07 | 305.3 | 4.87 (48.1) | 0.203 |
| Propano (C3H8) | 44.09 | 369.8 | 4.25 (41.9) | 0.217 |
| Etileno (C2H4) | 28.05 | 282.4 | 5.04 (49.7) | 0.215 |
| Propileno (C3H6) | 42.08 | 364.9 | 4.60 (45.4) | 0.232 |
| Metanol (CH3OH) | 32.04 | 512.6 | 8.09 (79.8) | 0.272 |
| Etanol (C2H5OH) | 46.07 | 513.9 | 6.14 (60.6) | 0.276 |
| Acetona (C3H6O) | 58.08 | 508.1 | 4.70 (46.4) | 0.278 |
A Tabela 2 mostra densidade, coeficiente de difusão e viscosidade para gases, líquidos e fluidos supercríticos típicos.
| Densidade (kg/m3) | Viscosidade (µPa∙s) | Coeficiente de difusão (mm²/s) | |
|---|---|---|---|
| Gases | 1 | 10 | 1–10 |
| Fluidos supercríticos | 100–1000 | 50–100 | 0.01–0.1 |
| Líquidos | 1000 | 500–1000 | 0.001 |
Além disso, não há tensão superficial em um fluido supercrítico, já que não há uma divisão entre as fases líquida e gasosa. Mudando a pressão e temperatura do fluido, as propriedades podem ser ajustadas para serem mais parecidas com as de um líquido ou de um gás. Uma das mais importantes propriedades é a solubilidade do material no fluido. Solubilidade num fluido supercrítico tende a aumentar com a densidade do fluido (a uma temperatura constante). Já que a densidade aumenta com a pressão, a solubilidade tende a aumentar com a pressão. A relação com a temperatura é mais complicada. À uma densidade constante, a solubilidade irá aumentar com a temperatura, no entanto, perto do ponto crítico, a densidade pode cair abruptamente com um pequeno aumento de temperatura. Portanto, perto da temperatura crítica, a solubilidade geralmente cai com um aumento de temperatura e então cresce de novo.[2]
Todos os fluidos supercríticos são completamente miscíveis uns com os outros, então para uma mistura uma única fase pode ser garantida se o seu ponto crítico for excedido. O ponto crítico de uma mistura de dois elementos pode ser estimada através da média aritmética das temperaturas e pressões críticas dos dois componentes.[3]
onde:
- e são as frações molares dos componente A e B e,
- e : são suas respectivas Temperaturas Críticas.
Para uma maior precisão, o ponto crítico pode ser calculado usando equações de estado, como as de Peng Robinson, ou métodos de contribuição de grupo. Outras propriedades, como a densidade, podem ser calculadas usando equações de estado.
Diagrama de fase
[editar | editar código-fonte]
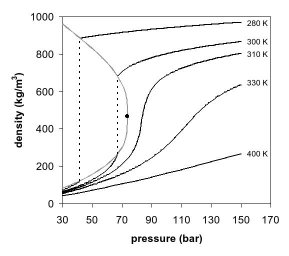
As figuras 1 e 2 mostram projeções de diagramas de fase. No diagrama de fase de pressão por temperatura (Fig. 1) as fases líquida e gasosa são separadas pela ebulição até o ponto crítico, onde essas duas fases somem e viram uma única fase supercrítica. Isso pode ser observado no diagrama de fase de pressão por densidade do dióxido de carbono, como mostra a Figura 2. Bem abaixo da temperatura crítica, como, por exemplo, à 280K, conforme a pressão aumenta, o gás é comprimido e eventualmente, a apenas 40 bar, condensa em um líquido muito mais denso, resultando na descontinuidade na linha (linha vertical pontilhada). O sistema consiste de duas fases em equilíbrio, um líquido de alta densidade e um gás de baixa densidade. Conforme se chega próximo à temperatura crítica (300K), a densidade do gás em equilíbrio se torna maior e a do líquido menor. No ponto crítico, (304.1 K e 7.38 MPa (73.8 bar)) não há diferença na densidade, e as duas fases se tornam uma única fase fluida. Portanto, acima da temperatura crítica, um gás não pode ser liquefeito através de pressão. Um pouco acima da temperatura crítica (310K), nas proximidades da pressão crítica, a linha é quase vertical. Um pequeno incremento na pressão causa um grande aumento na densidade da fase supercrítica. Muitas outras propriedades física também mostram grandes gradientes com a pressão perto do ponto crítico, como por exemplo, a viscosidade, a constante dielétrica e a força do solvente, que são intimamente relacionados com a densidade. Em temperaturas mais altas, o fluido começa a se comportar como um gás, como pode ser visto na Figura 2. Para o dióxido de carbono, a 400K, a densidade aumenta quase linearmente com a pressão.
Muitos gases pressurizados são na verdade fluidos supercríticos. Por exemplo, o Nitrogênio tem um ponto crítico de 126.2K (-147 °C) e 3.4 MPa (34 bar). Portanto, Nitrogênio (ou ar comprimido) em um cilindro de gás acima dessa temperatura é na verdade um fluido supercrítico. Estes são mais comumente conhecidos como gases permanentes. Em temperatura ambiente, eles estão bem acima de sua temperatura crítica, e portanto se comportam como um gás, como o CO2 a 400K e acima. No entanto, eles não podem ser liquefeitos por pressão a não ser que sejam resfriados abaixo de sua temperatura crítica.
Ocorrências Naturais
[editar | editar código-fonte]Vulcões submarinos
[editar | editar código-fonte]
Vulcões submarinos são comuns no fundo oceânico. Alguns são ativos e, em águas rasas, mostram sua presença através de um jato de vapor e detritos muito acima da superfície do mar. Muitos outros ficam em profundidades tão grandes que a imensa pressão do peso da água sobre eles previne esses jatos explosivos de vapor e gases. Isso faz com que a água seja aquecida a mais de 375 °C, transformando a água nas partes mais quentes do vulcão em um fluido supercrítico, já que a pressão numa profundidade de 3 km é de mais de 300 atmosferas, bem acima das 218 atmosferas necessárias.
Atmosferas planetárias
[editar | editar código-fonte]A atmosfera de Vênus é 96.5% dióxido de carbono e 3.5% Nitrogênio. A pressão na sua superfície é de 9.3 MPa (93 bar) e a temperatura é de 735K, acima dos pontos críticos dos seus principais constituintes e fazendo a superfície de sua atmosfera um fluido supercrítico.
As atmosferas interiores dos gigantes gasosos do Sistema Solar são compostas principalmente de Hidrogênio e Hélio a temperaturas muito acima de seus pontos críticos. As atmosferas gasosas exteriores de Júpiter e Saturno se transicionam suavemente até o interior fluido dos planetas. Modelos teoréticos dos planetas extra solares 55 Cancri e e Gliese 876 d postularam um oceano de água pressurizada e supercrítica com uma camada de gelo sólido a uma alta pressão no fundo.
Aplicações
[editar | editar código-fonte]Lavagem a seco
[editar | editar código-fonte]Dióxido de Carbono supercrítico pode ser usado ao invés de Percloroetileno ou outro solvente indesejável para lavagem a seco. O dióxido de carbono supercrítico às vezes se intercala nos botões, e, quando despressurizado, os botões estouram ou se quebram. Detergentes que são solúveis em dióxido de carbono melhoram o poder solvente do solvente.[4]
Fluidos supercríticos na geração de energia
[editar | editar código-fonte]A eficiência de uma máquina térmica é dependente da diferença de temperatura entre a fonte de calor e a fonte fria. Para melhorar a eficiência de usinas, a temperatura de operação precisa ser aumentada. Usando água como fluido funcional, isto a leva a condições supercríticas.[5] Eficiência pode ser aumentada de cerca de 39% para operação subcrítica para cerca de 45% usando a tecnologia atual. Reatores de água supercrítica são sistemas nucleares avançados promissores que oferecem um ganho termal de eficiência similar. Dióxido de carbono também pode ser usado em ciclos supercríticos em plantas nucleares, com ganhos similares de eficiência.[6]
Produção de biodiesel
[editar | editar código-fonte]A conversão de óleo vegetal para biodiesel é feita via uma reação de transesterificação, onde o triglicerídeo é convertido no metil éster mais glicerol. Isso é geralmente feito usando metanol e um catalisador básico ou ácido, mas pode ser feito usando-se metanol supercrítico sem um catalisador. Esse método tem a vantagem de permitir uma maior variedade de material bruto para ser usado, o produto não precisa ser lavado para se remover o catalisador e é mais fácil de ser projetado como um processo contínuo.[7]
Refrigeração
[editar | editar código-fonte]Dióxido de carbono supercrítico é também um importante refrigerante emergente, sendo usado em novas soluções para bombas de calor domésticas. Esses sistemas estão sob contínuo desenvolvimento com bombas de calor com dióxido de carbono supercrítico sendo vendidas com sucesso na Ásia. Os sistemas EcoCute do Japão, desenvolvidos por um consórcio de companhias, incluindo a Mitsubishi, dão água doméstica a altas temperaturas com um pequeno gasto de energia colocando calor dentro do sistema vindo dos seus arredores. Seu sucesso prevê um futuro uso em outras regiões possível.[8]
História
[editar | editar código-fonte]Em 1822, o barão Charles Cagniard de la Tour descobriu o ponto crítico de uma substância em seus famosos experimentos em barris de canhão. Escutando às descontinuidades no som de uma bola de Silex rolando dentro de um canhão selado com fluidos a várias temperaturas, ele observou a temperatura crítica. Acima dessa temperatura, as densidades das fases líquidas e gasosas se tornam iguais e a distinção entre elas desaparece, resultando numa única fase fluida supercrítica.[9]
Referências
- ↑ Edit Székely. «Supercritical Fluid Extraction». Budapest University of Technology and Economics. Consultado em 14 de abril de 2013. Arquivado do original em 24 de outubro de 2007
- ↑ «Supercritical Fluid Extraction, Density Considerations». Consultado em 14 de abril de 2013
- ↑ A.A. Clifford (4 de dezembro de 2007). «Calculation of Thermodynamic Properties of CO2 using Peng Robinson equation of state.». Critical Processes Ltd. Consultado em 14 de abril de 2013. Arquivado do original em 31 de março de 2012
- ↑ «Science News Online». Consultado em 14 de abril de 2013
- ↑ Malhotra, Ashok and Satyakam,R, 2000,Influence of climatic parameters on optimal design of supercritical power plants,IECEC, Energy Conversion Engineering Conference, pp1053-1058,
- ↑ Dostal, M.J. Driscoll, P. Hejzlar. «A Supercritical Carbon Dioxide Cycle for Next Generation Nuclear Reactors» (PDF). MIT-ANP-TR-100. MIT-ANP-Series. Consultado em 14 de abril de 2013
- ↑ Kunchana Bunyakiat, Sukunya Makmee, Ruengwit Sawangkeaw, and Somkiat Ngamprasertsith (2006). «Continuous Production of Biodiesel via Transesterification from Vegetable Oils in Supercritical Methanol». Energy and Fuels. 20 (2): 812–817. doi:10.1021/ef050329b
- ↑ FAQs - Everything R744
- ↑ Berche, Bertrand; Henkel, Malte; Kenna, Ralph (2009). «Critical phenomena: 150 years since Cagniard de la Tour». Journal of Physical Studies. 13 (3): 3


 French
French Deutsch
Deutsch



